Экзаменационная работа состоит из двух частей, включающих в себя 24 задания. Часть 1 содержит 19 заданий с кратким ответом, часть 2 содержит 5 заданий с развёрнутым ответом.
На выполнение экзаменационной работы по химии отводится 3 часа (180 минут).
Ответы к заданиям 1–19 записываются в виде последовательности цифр (чисел) или числа. Ответ запишите в поле ответа в тексте работы, а затем перенесите в бланк ответов № 1.
К заданиям 20–23 следует дать полный развёрнутый ответ, включающий в себя необходимые уравнения реакций и расчёты. Ответы на задания записываются на бланке ответов № 2. Задание 24 предполагает выполнение эксперимента под наблюдением экспертов.
К выполнению задания 24 следует приступать после выполнения участником экзамена задания 23 и не ранее чем через 30 минут после начала экзамена.
Все бланки заполняются яркими чёрными чернилами. Допускается использование гелевой или капиллярной ручки.
При выполнении работы Вы можете пользоваться Периодической системой химических элементов Д.И. Менделеева, таблицей растворимости солей, кислот и оснований в воде, электрохимическим рядом напряжений металлов и непрограммируемым калькулятором.
При выполнении заданий можно пользоваться черновиком. Записи в черновике, а также в тексте контрольных измерительных материалов не учитываются при оценивании работы.
Баллы, полученные Вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов.
После завершения работы проверьте, чтобы ответ на каждое задание в бланках ответов № 1 и № 2 был записан под правильным номером.
Желаем успеха!
Часть 1
Ответом к заданиям 1–17 является цифра или последовательность цифр (чисел). Ответы сначала укажите в тексте работы, а затем перенесите в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки, без пробелов, запятых и других дополнительных символов. Каждую цифру пишите в отдельной клеточке в соответствии с приведёнными в бланке образцами. Цифры в ответах на задания 4, 9, 10, 12, 15, 17 могут повторяться.
1 Выберите два высказывания, в которых говорится о железе как химическом элементе.
1) Железо реагирует с хлором.
2) Железо быстро ржавеет во влажном воздухе.
3) Пирит является сырьём для получения железа.
4) Гемоглобин, содержащий железо, переносит кислород.
5) В состав ржавчины входит железо.
Запишите номера выбранных ответов.
Ответ: __ __
Ответ:
45
Порядок следования цифр в ответе не имеет значения
2 На приведённом рисунке изображена модель атома химического элемента. Запишите в таблицу величину заряда ядра (Х) атома химического элемента, модель которого изображена на рисунке, и номер группы (Y), в которой этот элемент расположен в Периодической системе. (Для записи ответа используйте арабские цифры.)
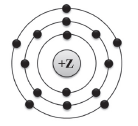
X Y
Ответ: __ __
Ответ:
155
3 Расположите химические элементы
1) сера 2) хлор 3) фосфор
в порядке увеличения их электроотрицательности.
Запишите номера элементов в соответствующем порядке.
Ответ: __ __ __
Ответ:
312
4 Установите соответствие между формулой соединения и степенью окисления
азота в этом соединении: к каждой позиции, обозначенной буквой, подберите
соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СТЕПЕНЬ
СОЕДИНЕНИЯ ОКИСЛЕНИЯ АЗОТА
А) HNO3 1) +1
Б) N2O 2) –3
В) NH3 3) +3
4) +5
Запишите в таблицу выбранные цифры под соответствующими буквами.
А Б В
Ответ: __ __ __
Ответ:
412
5 Из предложенного перечня выберите два вещества с ионной связью.
1) СаО
2) РCl3
3) Br2
4) Li3N
5) H2S
Запишите номера выбранных ответов.
Ответ: __ __
Ответ:
14
Порядок следования цифр в ответе не имеет значения
6 Какие два утверждения верны для характеристики как магния, так и кремния?
1) Электроны в атоме расположены на трёх электронных слоях.
2) Соответствующее простое вещество существует в виде двухатомных молекул.
3) Химический элемент относится к металлам.
4) Значение электроотрицательности меньше, чем у фосфора.
5) Химический элемент образует высшие оксиды с общей формулой ЭО2.
Запишите номера выбранных ответов.
Ответ: __ __
Ответ:
14
Порядок следования цифр в ответе не имеет значения
7 Из предложенного перечня веществ выберите кислотный оксид и основание.
1) CO
2) Mg(OH)2
3) SO2
4) NaClO4
5) Al(OH)3
Запишите в поле ответа сначала номер кислотного оксида, а затем номер основания.
Ответ: __ __
Ответ:
32
8 Какие два вещества из предложенного перечня вступают в реакцию с оксидом алюминия?
1) Cu(OH)2
2) HNO3
3) O2
4) Be(OH)2
5) Na2O
Запишите номера выбранных ответов.
Ответ: __ __
Ответ:
25
Порядок следования цифр в ответе не имеет значения
9 Установите соответствие между реагирующими веществами
и продуктом(-ами) их взаимодействия: к каждой позиции, обозначенной
буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) MgO + SO3 →
Б) Mg(OH)2 + H2SO4 →
В) Mg + H2SO4(разб.) →
ПРОДУКТ(Ы) ВЗАИМОДЕЙСТВИЯ
1) → MgSО3 + H2
2) → MgSO4 + H2O
3) → MgSO3
4) → MgSO4 + H2
5) → MgSO4
Запишите в таблицу выбранные цифры под соответствующими буквами.
А Б В
Ответ: __ __ __
Ответ:
524
10 Установите соответствие между веществом и реагентами, с которыми это вещество может вступать в реакцию: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) C
Б) Al2O3
В) CuCl2
РЕАГЕНТЫ
1) О2, H2SO4 (конц.)
2) Mg, AgNO3 (р-р)
3) KOH (р-р), HCl (р-р)
4) N2, K2SO4 (р-р)
Запишите в таблицу выбранные цифры под соответствующими буквами.
А Б В
Ответ: __ __ __
Ответ:
132
11 Из предложенного перечня выберите две пары веществ, между которыми протекает реакция замещения.
1) железо и нитрат серебра
2) оксид серы(VI) и оксид железа(III)
3) оксид меди(II) и соляная кислота
4) алюминий и хлор
5) натрий и вода
Запишите номера выбранных ответов.
Ответ: __ __
Ответ:
15
Порядок следования цифр в ответе не имеет значения
12 Установите соответствие между реагирующими веществами и признаком протекающей между ними реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) FeCl3 (р-р) и NaOH (р-р)
Б) FeSO4 (р-р) и Ba(NO3)2 (р-р)
В) FeS и H2SO4 (р-р)
ПРИЗНАК РЕАКЦИИ
1) выпадение белого осадка
2) выпадение бурого осадка
3) выпадение серо-зелёного осадка
4) выделение газа
Запишите в таблицу выбранные цифры под соответствующими буквами.
А Б В
Ответ: __ __ __
Ответ:
214
13 Выберите два вещества, при полной диссоциации 1 моль которых образуется 2 моль анионов.
1) нитрат магния
2) гидроксид бария
3) хлорид натрия
4) фосфат калия
5) сульфат натрия
Запишите номера выбранных ответов.
Ответ: __ __
Ответ:
12
Порядок следования цифр в ответе не имеет значения
14 Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции
Ca2+ + SО32– = СаSО3
1) СаО
2) Ca
3) CaCl2
4) K2SO3
5) Н2SO3
6) SO2
Запишите номера выбранных ответов.
Ответ: __ __
Ответ:
34
Порядок следования цифр в ответе не имеет значения
15 Установите соответствие между схемой процесса, происходящего
в окислительно-восстановительной реакции, и названием этого процесса:
к каждой позиции, обозначенной буквой, подберите соответствующую
позицию, обозначенную цифрой.
СХЕМА НАЗВАНИЕ
ПРОЦЕССА ПРОЦЕССА
А S–2 → S0 1) окисление
Б) H20 → 2H+ 2) восстановление
В) Cr+6 → Cr+3
Запишите в таблицу выбранные цифры под соответствующими буквами.
А Б В
Ответ: __ __ __
Ответ:
112
16 Из перечисленных суждений о правилах работы с веществами в лаборатории и быту выберите верное(-ые) суждение(-я).
1) Хлор можно получать только в вытяжном шкафу.
2) При приготовлении раствора кислоты концентрированную серную кислоту приливают к воде.
3) При нагревании раствора пробирку с жидкостью держат строго вертикально.
4) Работу с едкими веществами следует проводить в резиновых перчатках.
Запишите в поле ответа номер(а) верного(-ых) суждения(-й).
Ответ: ___________________________.
Ответ:
124
Порядок следования цифр в ответе не имеет значения
17 Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВА
А) KCl и K2SiO3
Б) K2CO3 и Li2CO3
В) Na2SO4 и NaOH
РЕАКТИВ
1) NH4NO3
2) HCl
3) MgO
4) K3PO4
Запишите в таблицу выбранные цифры под соответствующими буквами.
А Б В
Ответ: __ __ __
Ответ:
241
Ответом к заданиям 18, 19 является целое число или конечная десятичная дробь. Ответы сначала укажите в тексте работы, а затем перенесите в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки. Каждый символ пишите в отдельной клеточке в соответствии с приведёнными в бланке образцами. Единицы измерения физических величин в бланке ответа указывать не нужно.
Задания 18 и 19 выполняются с использованием следующего текста.
Нитрат аммония (аммиачная селитра) – химическое соединение NH4NO3, соль азотной кислоты, которое используется в качестве азотного удобрения.
18 Вычислите в процентах массовую долю азота в нитрате аммония. Запишите число с точностью до целых.
Ответ: ___________________________ %.
Ответ:
35
19 При подкормках овощных и цветочных культур в почву вносится 200 г азота на 100 м². Вычислите, сколько граммов аммиачной селитры надо внести на земельный участок площадью 70 м². Запишите число с точностью до целых.
Ответ: ___________________________ г.
Ответ:
400
Не забудьте перенести все ответы в бланк ответов № 1 в соответствии с инструкцией по выполнению работы. Проверьте, чтобы каждый ответ был записан в строке с номером соответствующего задания.
Часть 2
Для ответов на задания 20–22 используйте БЛАНК ОТВЕТОВ № 2. Запишите сначала номер задания (20, 21 или 22), а затем развёрнутый ответ к нему. Ответы записывайте чётко и разборчиво.
20 Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
MnO2 + HBr → MnBr2 + Br2 + H2O
Определите окислитель и восстановитель.
Ответ:
Элементы ответа:
1) Составлен электронный баланс:
1| Mn+4 + 2ē → Mn+2
1| 2Br–1 – 2ē → Br20
2) Расставлены коэффициенты в уравнении реакции:
MnO2 + 4HBr = MnBr2 + Br2 + 2H2O
3) Указано, что MnO2 (или марганец в степени окисления +4) является окислителем, а HBr (или бром в степени окисления –1) – восстановителем
21 Дана схема превращений:
Fe(NO3)2 → Fe(OH)2 → X ⎯t⎯→ Fe2O3
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
Ответ:
Элементы ответа:
Написаны уравнения реакций, соответствующие схеме превращений:
1) Fe(NO3)2 + 2NaOH = Fe(OH)2 + 2NaNO3
2) 4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3
3) 2Fe(OH)3 ⎯t⎯→Fe2O3 + 3H2O
Составлено сокращённое ионное уравнение первого превращения:
4) Fe2+ + 2OH– = Fe(OH)2
22 После пропускания через раствор гидроксида натрия 2,24 л сернистого газа (н.у.) получили 252 г раствора сульфита натрия. Вычислите массовую долю соли в полученном растворе.
Ответ:
Элементы ответа:
1) Составлено уравнение реакции:
SО2 + 2NаOH = Nа2SO3 + H2O
2) Рассчитано количество вещества сульфита натрия, полученного
в результате реакции:
n(SО2) = V (SО2) / Vm = 2,24 : 22,4 = 0,1 моль
по уравнению реакции n(Na2SО3) = n(SО2) = 0,1 моль
3) Определена массовая доля сульфита натрия в растворе:
m(NNa2SО3) = n(Na2SО3) ∙ M(Na2SО3) = 0,1 ∙ 126 = 12,6 г
ω(Na2SО3) = m(Na2SО3) ∙ 100 : m(р-ра) = 12,6 ∙ 100 : 252 = 5%
Проверьте, чтобы каждый ответ был записан рядом с номером соответствующего задания.
Практическая часть
Прочитайте текст и выполните задания 23 и 24.
Для ответа на задание 23 используйте БЛАНК ОТВЕТОВ № 2. Запишите сначала номер задания (23), а затем развёрнутый ответ к нему. Ответ записывайте чётко и разборчиво.
Задание 24 выполняйте только под наблюдением экспертов. При выполнении задания 24 или сразу после выполнения можно делать записи в черновике, после чего нужно вернуться к выполнению других заданий экзаменационной работы до момента окончания экзамена.
Дан раствор сульфата магния, а также набор следующих реактивов: цинк; соляная кислота; растворы гидроксида натрия, хлорида бария и нитрата калия.
23 Используя только реактивы из приведённого перечня, запишите молекулярные уравнения двух реакций, которые характеризуют химические свойства сульфата магния, и укажите признаки их протекания (наличие/отсутствие запаха у газа, цвет осадка или раствора).
Ответ:
Элементы ответа:
Составлены уравнения двух реакций, характеризующих химические свойства сульфата магния, и указаны признаки их протекания:
1) MgSO4 + BaCl2 = BaSO4 + MgCl2
2) выпадение белого осадка;
3) MgSO4 + 2NaOH = Mg(OH)2 + Na2SO4
4) выпадение белого осадка
Ознакомьтесь с инструкцией по выполнению задания 24, прилагаемой к заданиям КИМ.
Сообщите организатору в аудитории о своей готовности приступить к выполнению задания 24.
Подготовьте лабораторное оборудование, необходимое для проведения эксперимента.
24 Проведите химические реакции между сульфатом магния и выбранными веществами в соответствии с составленными уравнениями реакции, соблюдая правила техники безопасности, приведённые в инструкции к заданию. Проверьте, правильно ли указаны в ответе на задание 23 признаки протекания реакций. При необходимости дополните ответ или скорректируйте его.
Ответ:
Химический эксперимент выполнен в соответствии с инструкцией к заданию 24:
• отбор веществ проведён в соответствии с пунктами 3.1–3.5 инструкции;
• смешивание веществ выполнено в соответствии с пунктами 3.6–3.8 инструкции
Инструкция по выполнению задания 24
Внимание: в случае ухудшения самочувствия перед началом опытов или во время их выполнения обязательно сообщите об этом организатору в аудитории. 1. Вы приступаете к выполнению задания 24. Для этого получите лоток с лабораторным оборудованием и реактивами у специалиста по обеспечению лабораторных работ в аудитории.
2. Прочтите ещё раз перечень веществ, приведённый в тексте к заданиям 23 и 24, и убедитесь (по формулам на этикетках) в том, что на выданном лотке находится шесть указанных в перечне веществ (или их растворов). При обнаружении несоответствия набора веществ на лотке перечню веществ в условии задания сообщите об этом организатору в аудитории.
3. Перед началом выполнения эксперимента осмотрите ёмкости с реактивами и продумайте способ работы с ними. При этом обратите внимание на рекомендации, которым Вы должны следовать.
3.1. В склянке находится пипетка. Это означает, что отбор жидкости и переливание её в пробирку для проведения реакции необходимо проводить только с помощью пипетки. Для проведения опытов отбирают 7–10 капель реактива.
3.2. Пипетка в склянке с жидкостью отсутствует. В этом случае переливание раствора осуществляют через край склянки, которую располагают так, чтобы при её наклоне этикетка оказалась сверху («этикетку – в ладонь!»). Склянку медленно наклоняют над пробиркой, пока нужный объём раствора не перельётся в неё. Объём перелитого раствора должен составлять 1–2 мл (1–2 см по высоте пробирки).
3.3. Для проведения опыта требуется порошкообразное (сыпучее) вещество. Отбор порошкообразного вещества из ёмкости осуществляют только с помощью ложечки или шпателя.
3.4. При отборе исходного реактива взят его излишек. Возврат излишка реактива в исходную ёмкость категорически запрещён. Его помещают в отдельную, резервную пробирку.
3.5. Сосуд с исходным реактивом (жидкостью или порошком) обязательно закрывают крышкой (пробкой) от этой же ёмкости.
3.6. При растворении в воде порошкообразного вещества или при перемешивании реактивов следует слегка ударять пальцем по дну пробирки.
3.7. Для определения запаха вещества следует взмахом руки над горлышком сосуда направлять на себя пары этого вещества.
3.8. Если реактив попал на рабочий стол, кожу или одежду, необходимо незамедлительно обратиться за помощью к специалисту по обеспечению лабораторных работ в аудитории.
4. Вы готовы к выполнению эксперимента. Поднимите руку и попросите организатора в аудитории пригласить экспертов для оценивания проводимого Вами эксперимента.
5. Начинайте выполнять опыт. После проведения каждой реакции или обоих опытов записывайте в черновик свои наблюдения за изменениями, происходящими с веществами.
6. Вы завершили эксперимент. Проверьте, соответствуют ли результаты опытов записям решения задания 23. При необходимости скорректируйте ответ на задание 23, используя записи в черновике, которые сделаны при выполнении задания 24.

