23-е задание ОГЭ по химии - эксперимент (лабораторная работа). Инструкция к каждому заданию одна и та же, вот она:
1) только из указанных в перечне трёх реактивов выберите два, которые необходимы для определения каждого вещества, находящегося в склянках № 1 и № 2;
2) составьте молекулярное, полное и сокращённое ионные уравнения реакции, которую планируете провести для определения вещества из склянки № 1;
3) составьте молекулярное, полное и сокращённое ионные уравнения реакции, которую планируете провести для определения вещества из склянки № 2;
4) для оформления хода эксперимента используйте предложенную ниже таблицу;
Таблица для записи результатов эксперимента
|
№ опыта |
Реактив (формула или название) |
Наблюдаемые признаки реакции |
|
|
Вещество |
Вещество |
||
|
1 |
|
|
|
|
2 |
|
|
|
|
ВЫВОД: |
|
|
|
5) приступайте к выполнению эксперимента.
Инструкция по проведению эксперимента
1) из склянки 1 отберите в две чистые пробирки по 1–2 мл раствора;
2) добавьте в одну из пробирок 1–2 мл первого из двух реактивов,
а во вторую – второго из двух реактивов, отобранных Вами на этапе планирования эксперимента;
3) запишите наблюдаемые признаки протекания реакций (наличие/ отсутствие запаха у газа, цвет осадка или раствора) или укажите на их отсутствие в соответствующих ячейках таблицы;
4) из склянки 2 отберите в две новые чистые пробирки по 1–2 мл раствора;
5) добавьте в одну из пробирок 1–2 мл первого из двух реактивов,
а во вторую – второго из двух реактивов, отобранных Вами на этапе планирования эксперимента;
6) запишите наблюдаемые признаки протекания реакций (наличие/ отсутствие запаха у газа, цвет осадка или раствора) или укажите на их отсутствие в соответствующих ячейках таблицы;
7) в строке «вывод» запишите формулы или названия веществ, содержащихся в склянках № 1 и № 2.
Инструкция по выполнению практического задания
Внимание: в случае ухудшения самочувствия перед началом опытов или во время их выполнения обязательно сообщите об этом организатору в аудитории.
1. Вы приступаете к выполнению практического задания. Для этого получите лоток с лабораторным оборудованием и реактивами у специалиста по обеспечению лабораторных работ в аудитории.
2. Прочтите ещё раз перечень веществ, приведённый в тексте к заданию, и убедитесь (по формулам на этикетках) в том, что на выданном лотке находятся указанные в перечне вещества (или их растворы). При обнаружении несоответствия набора веществ на лотке перечню веществ в условии задания сообщите об этом организатору в аудитории.
3. Перед началом выполнения эксперимента осмотрите ёмкости с реактивами и продумайте способ работы с ними. При этом обратите внимание на правила, которым Вы должны следовать.
3.1. В склянке находится пипетка. Это означает, что отбор жидкости и переливание её в пробирку для проведения реакции необходимо проводить только с помощью пипетки. Для проведения опытов отбирают 7–10 капель реактива.
3.2. Пипетка в склянке с жидкостью отсутствует. В этом случае переливание раствора осуществляют через край склянки, которую располагают так, чтобы при её наклоне этикетка оказалась сверху («этикетку – в ладонь!»). Склянку медленно наклоняют над пробиркой, пока нужный объём раствора не перельётся в неё. Объём перелитого раствора должен составлять 1–2 мл (1–2 см по высоте пробирки).
3.3. Для проведения опыта требуется порошкообразное (сыпучее) вещество. Отбор порошкообразного вещества из ёмкости осуществляют только с помощью ложечки или шпателя.
3.4. При отборе исходного реактива взят его излишек. Возврат излишка реактива в исходную ёмкость категорически запрещён. Его помещают в отдельную, резервную пробирку.
3.5. Сосуд с исходным реактивом (жидкостью или порошком) обязательно закрывают крышкой (пробкой) от этой же ёмкости.
3.6. При растворении в воде порошкообразного вещества или при перемешивании реактивов следует слегка ударять пальцем по дну пробирки.
3.7. Для определения запаха вещества следует взмахом руки над горлышком сосуда направлять на себя пары этого вещества.
3.8. Если реактив попал на рабочий стол, кожу или одежду, необходимо незамедлительно обратиться за помощью к специалисту по обеспечению лабораторных работ в аудитории.
4. Начинайте выполнять опыт. После проведения каждой реакции записывайте в черновик свои наблюдения за изменениями (или их отсутствием), происходящими с веществами.
5. Вы завершили эксперимент. Проверьте, соответствуют ли результаты опытов теоретическим предсказаниям. При необходимости скорректируйте их, используя записи в черновике, которые сделаны при проведении эксперимента.
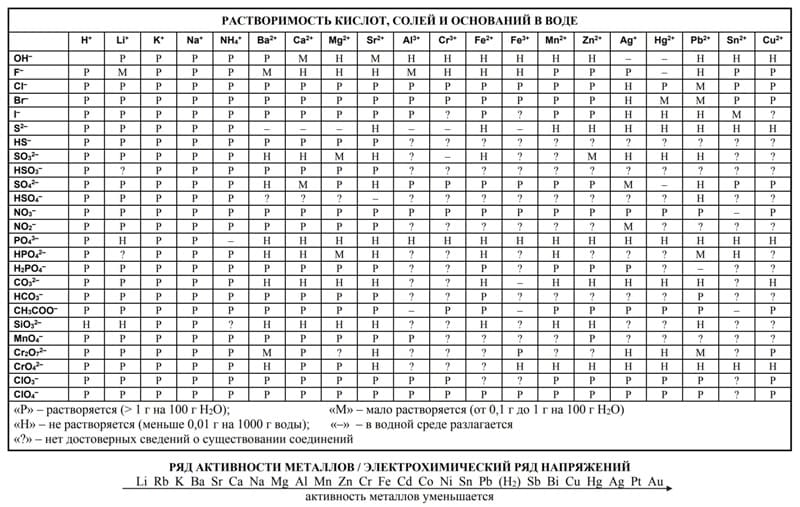
Пригодится таблица растворимости
Теперь непосредственно задания.
В ответах у нас порядок склянок с растворами такой же как в задании, НО на экзамене, вам могут склянки местами поменять, так что если бездумно спишете ответ, он не подойдет. Смотрите по признакам реакций (осадок, газ и т.д.)!
Дайте развернутый ответ
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами хлорида магния и хлорида бария, а также три реактива: соляная кислота, растворы гидроксида натрия и серной кислоты.
Ответ:
Таблица для записи результатов эксперимента
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | NaOH (раствор) | Белый осадок | Нет изменений |
| 2 | H₂SO₄ (раствор) | Нет изменений | Белый осадок |
Вывод:
-
Склянка №1 содержит хлорид магния (MgCl₂).
-
Склянка №2 содержит хлорид бария (BaCl₂).
Обоснование:
-
Реактивы: Для идентификации веществ выбраны NaOH и H₂SO₄.
-
NaOH взаимодействует с MgCl₂ с образованием нерастворимого Mg(OH)₂.
-
H₂SO₄ реагирует с BaCl₂ с образованием нерастворимого BaSO₄.
-
-
Уравнения реакций для склянки №1 (MgCl₂):
-
Молекулярное:
MgCl₂ + 2NaOH → Mg(OH)₂↓ + 2NaCl -
Полное ионное:
Mg²⁺ + 2Cl⁻ + 2Na⁺ + 2OH⁻ → Mg(OH)₂↓ + 2Na⁺ + 2Cl⁻ -
Сокращённое ионное:
Mg²⁺ + 2OH⁻ → Mg(OH)₂↓
-
-
Уравнения реакций для склянки №2 (BaCl₂):
-
Молекулярное:
BaCl₂ + H₂SO₄ → BaSO₄↓ + 2HCl -
Полное ионное:
Ba²⁺ + 2Cl⁻ + 2H⁺ + SO₄²⁻ → BaSO₄↓ + 2H⁺ + 2Cl⁻ -
Сокращённое ионное:
Ba²⁺ + SO₄²⁻ → BaSO₄↓
-
Примечание:
-
Соляная кислота (HCl) не использовалась, так как оба исходных вещества содержат хлорид-ионы (Cl⁻), и реакция не даёт видимых изменений.
-
Реакции с NaOH и H₂SO₄ позволили однозначно определить вещества по характерным осадкам.
Номер: A38E45
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами сульфата цинка и хлорида алюминия, а также растворы трёх реактивов: гидроксида натрия, нитрата бария и хлорида аммония.
Ответ:
Таблица для записи результатов эксперимента
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | Ba(NO₃)₂ (раствор) | Белый осадок | Нет изменений |
| 2 | NaOH (раствор) | Белый осадок, растворяющийся | Белый осадок, растворяющийся |
Вывод:
-
Склянка №1 содержит сульфат цинка (ZnSO₄).
-
Склянка №2 содержит хлорид алюминия (AlCl₃).
Обоснование:
-
Реактивы: Для идентификации веществ выбраны Ba(NO₃)₂ и NaOH.
-
Ba(NO₃)₂ взаимодействует с сульфат-ионами (SO₄²⁻) из ZnSO₄, образуя нерастворимый BaSO₄.
-
NaOH реагирует с Zn²⁺ и Al³⁺, образуя гидроксиды, которые растворяются в избытке щелочи.
-
-
Уравнения реакций для склянки №1 (ZnSO₄):
-
С Ba(NO₃)₂:
ZnSO₄ + Ba(NO₃)₂ → BaSO₄↓ + Zn(NO₃)₂
Сокращённое ионное: SO₄²⁻ + Ba²⁺ → BaSO₄↓ -
С NaOH:
ZnSO₄ + 2NaOH → Zn(OH)₂↓ + Na₂SO₄ (осадок)
При избытке NaOH: Zn(OH)₂ + 2NaOH → Na₂[Zn(OH)₄] (растворение)
Сокращённое ионное: Zn²⁺ + 2OH⁻ → Zn(OH)₂↓ → [Zn(OH)₄]²⁻
-
-
Уравнения реакций для склянки №2 (AlCl₃):
-
С Ba(NO₃)₂: реакция отсутствует (AlCl₃ не содержит SO₄²⁻).
-
С NaOH:
AlCl₃ + 3NaOH → Al(OH)₃↓ + 3NaCl (осадок)
При избытке NaOH: Al(OH)₃ + NaOH → Na[Al(OH)₄] (растворение)
Сокращённое ионное: Al³⁺ + 3OH⁻ → Al(OH)₃↓ → [Al(OH)₄]⁻
-
Примечание:
-
Хлорид аммония (NH₄Cl) не использовался, так как не даёт характерных реакций с ZnSO₄ и AlCl₃.
-
Реакция с Ba(NO₃)₂ позволяет однозначно определить ZnSO₄ по белому осадку BaSO₄.
-
Реакция с NaOH подтверждает наличие Al³⁺ в AlCl₃ (осадок Al(OH)₃ растворяется в избытке щелочи).
Номер: A7A94E
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами гидроксида натрия и серной кислоты, а также три реактива: соляная кислота, растворы нитрата бария и сульфата цинка.
Ответ:
Таблица для записи результатов эксперимента
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | Ba(NO₃)₂ (раствор) | Нет изменений | Белый осадок |
| 2 | ZnSO₄ (раствор) | Белый осадок, растворяющийся | Нет изменений |
Вывод:
-
Склянка №1 содержит гидроксид натрия (NaOH).
-
Склянка №2 содержит серную кислоту (H₂SO₄).
Обоснование:
-
Реактивы: Для идентификации веществ выбраны Ba(NO₃)₂ и ZnSO₄.
-
Ba(NO₃)₂ взаимодействует с серной кислотой (H₂SO₄), образуя нерастворимый сульфат бария (BaSO₄).
-
ZnSO₄ реагирует с гидроксидом натрия (NaOH), образуя осадок гидроксида цинка (Zn(OH)₂), который растворяется в избытке щелочи.
-
-
Уравнения реакций для склянки №1 (NaOH):
-
С ZnSO₄:
ZnSO₄ + 2NaOH → Zn(OH)₂↓ + Na₂SO₄ (осадок)
При избытке NaOH: Zn(OH)₂ + 2NaOH → Na₂[Zn(OH)₄] (растворение)
Сокращённое ионное:
Zn²⁺ + 2OH⁻ → Zn(OH)₂↓ → [Zn(OH)₄]²⁻
-
-
Уравнения реакций для склянки №2 (H₂SO₄):
-
С Ba(NO₃)₂:
H₂SO₄ + Ba(NO₃)₂ → BaSO₄↓ + 2HNO₃
Сокращённое ионное: Ba²⁺ + SO₄²⁻ → BaSO₄↓
-
Примечание:
-
Соляная кислота (HCl) не использовалась, так как реакция с NaOH (нейтрализация) не даёт видимых изменений, а с H₂SO₄ не протекает.
-
Реакция с Ba(NO₃)₂ позволяет определить H₂SO₄ по характерному белому осадку BaSO₄.
-
Реакция с ZnSO₄ подтверждает наличие NaOH (осадок Zn(OH)₂ растворяется в избытке щелочи).
Номер: C76A4F
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами сульфата магния и карбоната натрия, а также три реактива: соляная кислота, растворы гидроксида калия и хлорида бария.
Ответ:
Таблица для записи результатов эксперимента
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | KOH (раствор) | Белый осадок | Нет изменений |
| 2 | HCl (раствор) | Нет изменений | Выделение газа (CO₂) |
Вывод:
-
Склянка №1 содержит сульфат магния (MgSO₄).
-
Склянка №2 содержит карбонат натрия (Na₂CO₃).
Обоснование:
-
Реактивы: Для идентификации веществ выбраны KOH и HCl.
-
KOH взаимодействует с MgSO₄, образуя нерастворимый гидроксид магния (Mg(OH)₂).
-
HCl реагирует с Na₂CO₃, выделяя углекислый газ (CO₂).
-
-
Уравнения реакций для склянки №1 (MgSO₄):
-
Молекулярное:
MgSO₄ + 2KOH → Mg(OH)₂↓ + K₂SO₄ -
Полное ионное:
Mg²⁺ + SO₄²⁻ + 2K⁺ + 2OH⁻ → Mg(OH)₂↓ + 2K⁺ + SO₄²⁻ -
Сокращённое ионное:
Mg²⁺ + 2OH⁻ → Mg(OH)₂↓
-
-
Уравнения реакций для склянки №2 (Na₂CO₃):
-
Молекулярное:
Na₂CO₃ + 2HCl → 2NaCl + H₂O + CO₂↑ -
Полное ионное:
2Na⁺ + CO₃²⁻ + 2H⁺ + 2Cl⁻ → 2Na⁺ + 2Cl⁻ + H₂O + CO₂↑ -
Сокращённое ионное:
CO₃²⁻ + 2H⁺ → H₂O + CO₂↑
-
Примечание:
-
Хлорид бария (BaCl₂) не использовался, так как реакция с MgSO₄ дала бы осадок BaSO₄, а с Na₂CO₃ — осадок BaCO₃, который растворяется в HCl. Однако выбор KOH и HCl более эффективен для однозначного определения веществ.
-
Реакция с KOH позволяет выявить MgSO₄ по белому осадку.
-
Реакция с HCl подтверждает Na₂CO₃ по выделению газа CO₂.
Номер: 1DEFF3
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами фосфата калия и сульфата цинка, а также растворы трёх реактивов: гидроксида натрия, хлорида магния и хлорида аммония.
Ответ:
Таблица для записи результатов эксперимента
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | MgCl₂ (раствор) | Белый осадок | Нет изменений |
| 2 | NaOH (раствор) | Нет изменений | Белый осадок |
Вывод:
-
Склянка №1 содержит фосфат калия (K₃PO₄).
-
Склянка №2 содержит сульфат цинка (ZnSO₄).
Обоснование:
-
Реактивы: Для идентификации выбраны MgCl₂ и NaOH.
-
MgCl₂ взаимодействует с K₃PO₄, образуя нерастворимый фосфат магния (Mg₃(PO₄)₂).
-
NaOH реагирует с ZnSO₄, образуя гидроксид цинка (Zn(OH)₂), который не растворяется в избытке щелочи (в условиях ОГЭ часто фиксируют только факт образования осадка).
-
-
Уравнения реакций для склянки №1 (K₃PO₄):
-
Молекулярное:
2K₃PO₄ + 3MgCl₂ → Mg₃(PO₄)₂↓ + 6KCl -
Полное ионное:
6K⁺ + 2PO₄³⁻ + 3Mg²⁺ + 6Cl⁻ → Mg₃(PO₄)₂↓ + 6K⁺ + 6Cl⁻ -
Сокращённое ионное:
3Mg²⁺ + 2PO₄³⁻ → Mg₃(PO₄)₂↓
-
-
Уравнения реакций для склянки №2 (ZnSO₄):
-
Молекулярное:
ZnSO₄ + 2NaOH → Zn(OH)₂↓ + Na₂SO₄ -
Полное ионное:
Zn²⁺ + SO₄²⁻ + 2Na⁺ + 2OH⁻ → Zn(OH)₂↓ + 2Na⁺ + SO₄²⁻ -
Сокращённое ионное:
Zn²⁺ + 2OH⁻ → Zn(OH)₂↓
-
Примечание:
-
Хлорид аммония (NH₄Cl) не использовался, так как не даёт характерных реакций с K₃PO₄ и ZnSO₄.
-
Реакция с MgCl₂ позволяет определить K₃PO₄ по белому осадку.
-
Реакция с NaOH подтверждает ZnSO₄ по образованию белого осадка Zn(OH)₂.
Номер: E0ACF2
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами сульфата алюминия и нитрата бария, а также растворы трёх реактивов: нитрата серебра, фосфата калия и серной кислоты.
Ответ:
Таблица для записи результатов эксперимента
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | H₂SO₄ (раствор) | Нет изменений | Белый осадок |
| 2 | K₃PO₄ (раствор) | Белый осадок | Белый осадок |
Вывод:
-
Склянка №1 содержит сульфат алюминия (Al₂(SO₄)₃).
-
Склянка №2 содержит нитрат бария (Ba(NO₃)₂).
Обоснование:
-
Реактивы: Для идентификации выбраны H₂SO₄ и K₃PO₄.
-
H₂SO₄ взаимодействует с Ba(NO₃)₂, образуя нерастворимый сульфат бария (BaSO₄).
-
K₃PO₄ реагирует с Al₂(SO₄)₃, образуя нерастворимый фосфат алюминия (AlPO₄), а с Ba(NO₃)₂ — фосфат бария (Ba₃(PO₄)₂).
-
-
Уравнения реакций для склянки №1 (Al₂(SO₄)₃):
-
С K₃PO₄:
Al₂(SO₄)₃ + 2K₃PO₄ → 2AlPO₄↓ + 3K₂SO₄
Полное ионное:
2Al³⁺ + 3SO₄²⁻ + 6K⁺ + 2PO₄³⁻ → 2AlPO₄↓ + 6K⁺ + 3SO₄²⁻
Сокращённое ионное:
Al³⁺ + PO₄³⁻ → AlPO₄↓
-
-
Уравнения реакций для склянки №2 (Ba(NO₃)₂):
-
С H₂SO₄:
Ba(NO₃)₂ + H₂SO₄ → BaSO₄↓ + 2HNO₃
Полное ионное:
Ba²⁺ + 2NO₃⁻ + 2H⁺ + SO₄²⁻ → BaSO₄↓ + 2H⁺ + 2NO₃⁻
Сокращённое ионное:
Ba²⁺ + SO₄²⁻ → BaSO₄↓ -
С K₃PO₄:
3Ba(NO₃)₂ + 2K₃PO₄ → Ba₃(PO₄)₂↓ + 6KNO₃
Полное ионное:
3Ba²⁺ + 6NO₃⁻ + 6K⁺ + 2PO₄³⁻ → Ba₃(PO₄)₂↓ + 6K⁺ + 6NO₃⁻
Сокращённое ионное:
3Ba²⁺ + 2PO₄³⁻ → Ba₃(PO₄)₂↓
-
Примечание:
-
Нитрат серебра (AgNO₃) не использовался, так как не даёт характерных реакций с Al₂(SO₄)₃ и Ba(NO₃)₂.
-
Реакция с H₂SO₄ позволяет определить Ba(NO₃)₂ по белому осадку BaSO₄.
-
Реакция с K₃PO₄ подтверждает Al₂(SO₄)₃ (осадок AlPO₄), а также показывает, что Ba(NO₃)₂ реагирует с фосфатом.
-
Различие в количестве реакций (№1 даёт осадок только с K₃PO₄, №2 — с обоими реактивами) позволяет однозначно идентифицировать вещества.
Номер: E9C9F9
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами гидроксида натрия и хлорида лития, а также три реактива: соляная кислота, растворы фосфата калия и хлорида железа(III).
Ответ:
Таблица для записи результатов эксперимента
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | FeCl₃ (раствор) | Красно-бурый осадок | Нет изменений |
| 2 | K₃PO₄ (раствор) | Нет изменений | Белый осадок |
Вывод:
-
Склянка №1 содержит гидроксид натрия (NaOH).
-
Склянка №2 содержит хлорид лития (LiCl).
Обоснование:
-
Реактивы: Для идентификации выбраны FeCl₃ и K₃PO₄.
-
FeCl₃ реагирует с NaOH, образуя красно-бурый осадок гидроксида железа(III).
-
K₃PO₄ взаимодействует с LiCl, образуя малорастворимый фосфат лития.
-
-
Уравнения реакций для склянки №1 (NaOH):
-
С FeCl₃:
FeCl₃ + 3NaOH → Fe(OH)₃↓ + 3NaCl
Полное ионное:
Fe³⁺ + 3Cl⁻ + 3Na⁺ + 3OH⁻ → Fe(OH)₃↓ + 3Cl⁻ + 3Na⁺
Сокращённое ионное:
Fe³⁺ + 3OH⁻ → Fe(OH)₃↓
-
-
Уравнения реакций для склянки №2 (LiCl):
-
С K₃PO₄:
3LiCl + K₃PO₄ → Li₃PO₄↓ + 3KCl
Полное ионное:
3Li⁺ + 3Cl⁻ + 3K⁺ + PO₄³⁻ → Li₃PO₄↓ + 3Cl⁻ + 3K⁺
Сокращённое ионное:
3Li⁺ + PO₄³⁻ → Li₃PO₄↓
-
Примечание:
-
Соляная кислота (HCl) не использовалась, так как реакция нейтрализации с NaOH не имеет визуальных признаков, а с LiCl не протекает.
-
Реакция с FeCl₃ позволяет определить NaOH по характерному осадку Fe(OH)₃.
-
Реакция с K₃PO₄ подтверждает LiCl по образованию белого осадка Li₃PO₄.
Номер: 6553FE
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами фосфата калия и хлорида магния, а также растворы трёх реактивов: сульфата цинка, соляной кислоты и аммиака.
Ответ:
Таблица для записи результатов эксперимента
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | ZnSO₄ (раствор) | Белый осадок | Нет изменений |
| 2 | NH₃ (раствор) | Нет изменений | Белый осадок |
Вывод:
-
Склянка №1 содержит фосфат калия (K₃PO₄).
-
Склянка №2 содержит хлорид магния (MgCl₂).
Обоснование:
-
Реактивы: Для идентификации выбраны ZnSO₄ и NH₃.
-
ZnSO₄ реагирует с K₃PO₄, образуя нерастворимый фосфат цинка (Zn₃(PO₄)₂).
-
NH₃ взаимодействует с MgCl₂, образуя гидроксид магния (Mg(OH)₂).
-
-
Уравнения реакций для склянки №1 (K₃PO₄):
-
С ZnSO₄:
2K₃PO₄ + 3ZnSO₄ → Zn₃(PO₄)₂↓ + 3K₂SO₄
Полное ионное:
6K⁺ + 2PO₄³⁻ + 3Zn²⁺ +3SO₄²⁻ → Zn₃(PO₄)₂↓ + 6K⁺ + 3SO₄²⁻
Сокращённое ионное:
2PO₄³⁻ + 3Zn²⁺ → Zn₃(PO₄)₂↓
-
-
Уравнения реакций для склянки №2 (MgCl₂):
-
С NH₃:
MgCl₂ + 2NH₃ + 2H₂O → Mg(OH)₂↓ + 2NH₄Cl
Полное ионное:
Mg²⁺ + 2Cl⁻ + 2NH₃ + 2H₂O → Mg(OH)₂↓ + 2NH₄⁺ + 2Cl⁻
Сокращённое ионное:
Mg²⁺ + 2NH₃ + 2H₂O → Mg(OH)₂↓ + 2NH₄⁺
-
Примечание:
-
Соляная кислота (HCl) не использовалась, так как не даёт характерных признаков реакции с K₃PO₄ и MgCl₂.
-
Реакция с ZnSO₄ позволяет определить K₃PO₄ по белому осадку.
-
Реакция с NH₃ подтверждает MgCl₂ по образованию белого осадка Mg(OH)₂.
-
Осадок Mg(OH)₂ не растворяется в избытке аммиака, что делает реакцию однозначной.
Номер: 3CECF2
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами серной кислоты и хлорида магния, а также три реактива: цинк, растворы гидроксида натрия и хлорида меди(II).
Ответ:
Таблица для записи результатов эксперимента
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | Zn (металл) | Выделение газа (H₂) | Нет изменений |
| 2 | NaOH (раствор) | Нет изменений | Белый осадок |
Вывод:
-
Склянка №1 содержит серную кислоту (H₂SO₄).
-
Склянка №2 содержит хлорид магния (MgCl₂).
Обоснование:
-
Реактивы: Для идентификации выбраны Zn и NaOH.
-
Zn реагирует с H₂SO₄, выделяя водород (H₂).
-
NaOH взаимодействует с MgCl₂, образуя нерастворимый Mg(OH)₂.
-
-
Уравнения реакций для склянки №1 (H₂SO₄):
-
С Zn:
Zn + H₂SO₄ → ZnSO₄ + H₂↑
Полное ионное:
Zn + 2H⁺ + SO₄²⁻→ Zn²⁺ + H₂↑ + SO₄²⁻
Сокращённое ионное:
Zn + 2H⁺ → Zn²⁺ + H₂↑
-
-
Уравнения реакций для склянки №2 (MgCl₂):
-
С NaOH:
MgCl₂ + 2NaOH → Mg(OH)₂↓ + 2NaCl
Полное ионное:
Mg²⁺ + 2Cl⁻ + 2Na⁺ + 2OH⁻ → Mg(OH)₂↓ + 2Cl⁻ + 2Na⁺
Сокращённое ионное:
Mg²⁺ + 2OH⁻ → Mg(OH)₂↓
-
Примечание:
-
Хлорид меди(II) (CuCl₂) не использовался, так как не даёт характерных реакций с H₂SO₄ и MgCl₂.
-
Реакция с Zn позволяет определить H₂SO₄ по выделению газа.
-
Реакция с NaOH подтверждает MgCl₂ по образованию белого осадка Mg(OH)₂.
Номер: 0DCA0B
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами сульфата алюминия и фосфата натрия, а также три реактива: соляная кислота, растворы хлорида лития и нитрата бария.
Ответ:
Таблица для записи результатов эксперимента
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | Ba(NO₃)₂ (раствор) | Белый осадок | Белый осадок |
| 2 | LiCl (раствор) | Нет изменений | Белый осадок |
Вывод:
-
Склянка №1 содержит сульфат алюминия (Al₂(SO₄)₃).
-
Склянка №2 содержит фосфат натрия (Na₃PO₄).
Обоснование:
-
Реактивы: Для идентификации выбраны Ba(NO₃)₂ и LiCl.
-
Ba(NO₃)₂ взаимодействует с Al₂(SO₄)₃ и Na₃PO₄, образуя белые осадки сульфата бария (BaSO₄) и фосфата бария (Ba₃(PO₄)₂).
-
LiCl реагирует только с Na₃PO₄, образуя малорастворимый фосфат лития (Li₃PO₄).
-
-
Уравнения реакций для склянки №1 (Al₂(SO₄)₃):
-
С Ba(NO₃)₂:
Al₂(SO₄)₃ + 3Ba(NO₃)₂ → 3BaSO₄↓ + 2Al(NO₃)₃
Полное ионное:
2Al³⁺ + 3SO₄²⁻ + 3Ba²⁺ + 6NO₃⁻ → 3BaSO₄↓ + 2Al³⁺ + 6NO₃⁻
Сокращённое ионное:
SO₄²⁻ + Ba²⁺ → BaSO₄↓ -
С LiCl: реакция отсутствует.
-
-
Уравнения реакций для склянки №2 (Na₃PO₄):
-
С Ba(NO₃)₂:
2Na₃PO₄ + 3Ba(NO₃)₂ → Ba₃(PO₄)₂↓ + 6NaNO₃
Полное ионное:
6Na⁺ + 2PO₄³⁻ + 3Ba²⁺ + 6NO₃⁻ → Ba₃(PO₄)₂↓ + 6Na⁺ + 6NO₃⁻
Сокращённое ионное:
3Ba²⁺ + 2PO₄³⁻ → Ba₃(PO₄)₂↓ -
С LiCl:
Na₃PO₄ + 3LiCl → Li₃PO₄↓ + 3NaCl
Полное ионное:
3Na⁺ + PO₄³⁻ + 3Li⁺ + 3Cl⁻ → Li₃PO₄↓ + 3Na⁺ + 3Cl⁻
Сокращённое ионное:
PO₄³⁻ + 3Li⁺ → Li₃PO₄↓
-
Примечание:
-
Соляная кислота (HCl) не использовалась, так как не даёт характерных признаков реакции с Al₂(SO₄)₃ и Na₃PO₄.
-
Реакция с Ba(NO₃)₂ позволяет обнаружить сульфат- и фосфат-ионы, но различить их помогает реакция с LiCl.
-
Только Na₃PO₄ образует осадок с LiCl, что однозначно идентифицирует вещество в склянке №2.
Номер: 7AB401
Для проведения эксперимента выданы склянки № 1 и № 2 с соляной кислотой и раствором фосфата натрия, а также растворы трёх реактивов: карбоната калия, гидроксида калия и нитрата бария.
Ответ:
Таблица для записи результатов эксперимента
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | K₂CO₃ (раствор) | Выделение газа (CO₂) | Нет изменений |
| 2 | Ba(NO₃)₂ (раствор) | Нет изменений | Белый осадок |
Вывод:
-
Склянка №1 содержит соляную кислоту (HCl).
-
Склянка №2 содержит фосфат натрия (Na₃PO₄).
Обоснование:
1. Реакции для склянки №1 (HCl):
С K₂CO₃:
-
Молекулярное уравнение:
2HCl + K₂CO₃ → 2KCl + H₂O + CO₂↑ -
Полное ионное уравнение:
2H⁺ + 2Cl⁻ + 2K⁺ + CO₃²⁻ → 2K⁺ + 2Cl⁻ + H₂O + CO₂↑ -
Сокращённое ионное уравнение:
2H⁺ + CO₃²⁻ → H₂O + CO₂↑
С Ba(NO₃)₂:
Реакция отсутствует (HCl и Ba(NO₃)₂ не взаимодействуют).
2. Реакции для склянки №2 (Na₃PO₄):
С K₂CO₃:
Реакция отсутствует (Na₃PO₄ и K₂CO₃ оба растворимы).
С Ba(NO₃)₂:
-
Молекулярное уравнение:
2Na₃PO₄ + 3Ba(NO₃)₂ → Ba₃(PO₄)₂↓ + 6NaNO₃ -
Полное ионное уравнение:
6Na⁺ + 2PO₄³⁻ + 3Ba²⁺ + 6NO₃⁻ → Ba₃(PO₄)₂↓ + 6Na⁺ + 6NO₃⁻ -
Сокращённое ионное уравнение:
3Ba²⁺ + 2PO₄³⁻ → Ba₃(PO₄)₂↓
Примечание:
-
Гидроксид калия (KOH) не использовался, так как реакция с HCl (нейтрализация) не имеет визуальных признаков, а с Na₃PO₄ не протекает.
-
K₂CO₃ позволяет определить HCl по выделению газа CO₂.
-
Ba(NO₃)₂ идентифицирует Na₃PO₄ по образованию белого осадка Ba₃(PO₄)₂.
Номер: 718F0C
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами сульфата магния и карбоната калия, а также растворы трёх реактивов: гидроксида натрия, хлорида бария и серной кислоты.
Ответ:
Результаты эксперимента:
| № опыта | Реактив | Наблюдаемые признаки (Склянка №1) | Наблюдаемые признаки (Склянка №2) |
|---|---|---|---|
| 1 | BaCl₂ | Белый осадок | Белый осадок |
| 2 | H₂SO₄ | Нет изменений | Выделение газа (CO₂) |
Вывод:
Склянка №1 содержит сульфат магния (MgSO₄), склянка №2 — карбонат калия (K₂CO₃).
Уравнения реакций для склянки №1 (MgSO₄):
-
С BaCl₂:
-
Молекулярное:
MgSO₄ + BaCl₂ → BaSO₄↓ + MgCl₂ -
Полное ионное:
Mg²⁺ + SO₄²⁻ + Ba²⁺ + 2Cl⁻ → BaSO₄↓ + Mg²⁺ + 2Cl⁻ -
Сокращённое ионное:
Ba²⁺ + SO₄²⁻ → BaSO₄↓
-
С H₂SO₄:
Реакция не происходит.
Уравнения реакций для склянки №2 (K₂CO₃):
-
С BaCl₂:
-
Молекулярное:
K₂CO₃ + BaCl₂ → BaCO₃↓ + 2KCl -
Полное ионное:
2K⁺ + CO₃²⁻ + Ba²⁺ + 2Cl⁻ → BaCO₃↓ + 2K⁺ + 2Cl⁻ -
Сокращённое ионное:
Ba²⁺ + CO₃²⁻ → BaCO₃↓
-
С H₂SO₄:
-
Молекулярное:
K₂CO₃ + H₂SO₄ → K₂SO₄ + CO₂↑ + H₂O -
Полное ионное:
2K⁺ + CO₃²⁻ + 2H⁺ + SO₄²⁻ → 2K⁺ + SO₄²⁻ + CO₂↑ + H₂O -
Сокращённое ионное:
2H⁺ + CO₃²⁻ → CO₂↑ + H₂O
Проверка:
-
Для MgSO₄ характерны реакции с BaCl₂ (белый осадок) и отсутствие реакции с H₂SO₄.
-
Для K₂CO₃ наблюдаются осадок с BaCl₂ и выделение газа с H₂SO₄.
Номер: D4ED01
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами гидроксида натрия и сульфата натрия, а также растворы трёх реактивов: хлорида бария, серной кислоты и сульфата железа(II).
Ответ:
Результаты эксперимента:
| № опыта | Реактив | Наблюдаемые признаки (Склянка №1) | Наблюдаемые признаки (Склянка №2) |
|---|---|---|---|
| 1 | FeSO₄ | Зеленовато-белый осадок (Fe(OH)₂), переходящий в бурый (Fe(OH)₃) | Нет изменений |
| 2 | BaCl₂ | Нет изменений | Белый осадок (BaSO₄↓) |
Вывод:
Склянка №1 содержит гидроксид натрия (NaOH), склянка №2 — сульфат натрия (Na₂SO₄).
Уравнения реакций для склянки №1 (NaOH):
-
С FeSO₄:
-
Молекулярное:
2NaOH + FeSO₄ → Fe(OH)₂↓ + Na₂SO₄
(осадок Fe(OH)₂ окисляется на воздухе: 4Fe(OH)₂ + O₂ + 2H₂O → 4Fe(OH)₃↓ -
Полное ионное:
2OH⁻ + Fe²⁺ → Fe(OH)₂↓ -
Сокращённое ионное:
Fe²⁺ + 2OH⁻ → Fe(OH)₂↓
-
С BaCl₂:
Реакция не происходит (оба вещества растворимы).
Уравнения реакций для склянки №2 (Na₂SO₄):
-
С FeSO₄:
Реакция не происходит (оба вещества содержат сульфат-ионы). -
С BaCl₂:
-
Молекулярное:
Na₂SO₄ + BaCl₂ → BaSO₄↓ + 2NaCl -
Полное ионное:
2Na⁺ + SO₄²⁻ + Ba²⁺ + 2Cl⁻ → BaSO₄↓ + 2Na⁺ + 2Cl⁻ -
Сокращённое ионное:
Ba²⁺ + SO₄²⁻ → BaSO₄↓
Почему не выбрали H₂SO₄?
-
Для NaOH: Реакция нейтрализации (2NaOH + H₂SO₄ → Na₂SO₄ + 2H₂O) не даёт видимых изменений без индикатора.
-
Для Na₂SO₄: Реакция с H₂SO₄ невозможна, так как оба вещества содержат сульфат-ионы.
Эффективность выбранных реактивов:
-
FeSO₄ позволяет отличить NaOH (осадок гидроксида железа) от Na₂SO₄ (нет реакции).
-
BaCl₂ даёт чёткий признак для Na₂SO₄ (белый осадок BaSO₄↓), тогда как с NaOH реакция отсутствует.
Номер: C3F803
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами сульфата цинка и нитрата бария, а также растворы трёх реактивов: хлорида железа(III), сульфата алюминия и нитрата серебра.
Ответ:
Результаты эксперимента:
| № опыта | Реактив | Наблюдаемые признаки (Склянка №1) | Наблюдаемые признаки (Склянка №2) |
|---|---|---|---|
| 1 | Al₂(SO₄)₃ | Нет изменений | Белый осадок (BaSO₄↓) |
| 2 | AgNO₃ | Белый осадок (Ag₂SO₄↓) | Нет изменений |
Вывод:
Склянка №1 содержит сульфат цинка (ZnSO₄), склянка №2 — нитрат бария (Ba(NO₃)₂).
Уравнения реакций для склянки №1 (ZnSO₄):
-
С AgNO₃:
-
Молекулярное:
ZnSO₄ + 2AgNO₃ → Ag₂SO₄↓ + Zn(NO₃)₂ -
Полное ионное:
Zn²⁺ + SO₄²⁻ + 2Ag⁺ + 2NO₃⁻ → Ag₂SO₄↓ + Zn²⁺ + 2NO₃⁻ -
Сокращённое ионное:
2Ag⁺ + SO₄²⁻ → Ag₂SO₄↓
-
С Al₂(SO₄)₃:
Реакция не происходит (оба вещества содержат сульфат-ионы).
Уравнения реакций для склянки №2 (Ba(NO₃)₂):
-
С Al₂(SO₄)₃:
-
Молекулярное:
3Ba(NO₃)₂ + Al₂(SO₄)₃ → 3BaSO₄↓ + 2Al(NO₃)₃ -
Полное ионное:
3Ba²⁺ + 6NO₃⁻ + 2Al³⁺ + 3SO₄²⁻ → 3BaSO₄↓ + 2Al³⁺ + 6NO₃⁻ -
Сокращённое ионное:
Ba²⁺ + SO₄²⁻ → BaSO₄↓
-
С AgNO₃:
Реакция не происходит (нитрат бария и нитрат серебра оба растворимы).
Почему не выбрали FeCl₃?
-
Для ZnSO₄: FeCl₃ не даёт однозначного признака (возможен гидролиз, но осадок Fe(OH)₃ не образуется в кислой среде ZnSO₄).
-
Для Ba(NO₃)₂: FeCl₃ не реагирует с нитратом бария (продукты растворимы).
Эффективность выбранных реактивов:
-
Al₂(SO₄)₃ вызывает осадок BaSO₄ только в склянке №2.
-
AgNO₃ даёт осадок Ag₂SO₄ только в склянке №1.
Номер: 9D4906
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами хлорида бария и гидроксида натрия, а также три реактива: растворы нитрата натрия, серной кислоты и хлорида железа(III).
Ответ:
Результаты эксперимента:
| № опыта | Реактив | Наблюдаемые признаки (Склянка №1) | Наблюдаемые признаки (Склянка №2) |
|---|---|---|---|
| 1 | H₂SO₄ | Белый осадок (BaSO₄↓) | Нет изменений |
| 2 | FeCl₃ | Нет изменений | Красно-бурый осадок (Fe(OH)₃↓) |
Вывод:
Склянка №1 содержит хлорид бария (BaCl₂), склянка №2 — гидроксид натрия (NaOH).
Уравнения реакций для склянки №1 (BaCl₂):
-
С H₂SO₄:
-
Молекулярное:
BaCl₂ + H₂SO₄ → BaSO₄↓ + 2HCl -
Полное ионное:
Ba²⁺ + 2Cl⁻ + 2H⁺ + SO₄²⁻ → BaSO₄↓ + 2H⁺ + 2Cl⁻ -
Сокращённое ионное:
Ba²⁺ + SO₄²⁻ → BaSO₄↓
-
С FeCl₃:
Реакция не происходит (продукты растворимы).
Уравнения реакций для склянки №2 (NaOH):
-
С FeCl₃:
-
Молекулярное:
3NaOH + FeCl₃ → Fe(OH)₃↓ + 3NaCl -
Полное ионное:
3Na⁺ + 3OH⁻ + Fe³⁺ + 3Cl⁻ → Fe(OH)₃↓ + 3Na⁺ + 3Cl⁻ -
Сокращённое ионное:
Fe³⁺ + 3OH⁻ → Fe(OH)₃↓Fe³⁺ + 3OH⁻ → Fe(OH)₃↓
-
С H₂SO₄:
-
Молекулярное:
2NaOH + H₂SO₄ → Na₂SO₄ + 2H₂O -
Полное ионное:
2Na⁺ + 2OH⁻ + 2H⁺ + SO₄²⁻ → 2Na⁺ + SO₄²⁻ + 2H₂O -
Сокращённое ионное:
H⁺ + OH⁻ → H₂O
Почему не выбрали NaNO₃?
Нитрат натрия (NaNO₃) не взаимодействует ни с BaCl₂, ни с NaOH, так как продукты реакций (Ba(NO₃)₂ и NaNO₃) растворимы. Это делает его бесполезным для идентификации веществ.
Эффективность выбранных реактивов:
-
H₂SO₄ даёт чёткий признак для BaCl₂ (белый осадок BaSO₄↓), тогда как с NaOH реакция нейтрализации не имеет видимых изменений.
-
FeCl₃ вызывает образование красно-бурого осадка Fe(OH)₃ только с NaOH, что позволяет однозначно определить гидроксид натрия.
Номер: 36590C
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами фосфата калия и сульфата аммония, а также растворы трёх реактивов: гидроксида калия, хлорида лития и карбоната натрия (возможно использование лакмусовой бумаги).
Ответ:
Результаты эксперимента:
| № опыта | Реактив | Наблюдаемые признаки (Склянка №1) | Наблюдаемые признаки (Склянка №2) |
|---|---|---|---|
| 1 | KOH (гидроксид калия) | Выделение газа с резким запахом (аммиак), лакмус синеет. | Нет изменений. |
| 2 | LiCl (хлорид лития) | Нет изменений. | Образование белого осадка. |
Вывод:
-
Склянка №1 содержит сульфат аммония — (NH₄)₂SO₄.
-
Склянка №2 содержит фосфат калия — K₃PO₄.
Почему не выбран карбонат натрия:
Карбонат натрия (Na₂CO₃) не используется, так как реакции с данными веществами либо не дают однозначных признаков (например, выделение смеси газов), либо протекают медленно. Выбранные реактивы (KOH и LiCl) обеспечивают четкие и быстрые реакции для идентификации веществ.
Уравнения реакций для склянки №1 ((NH₄)₂SO₄):
-
Молекулярное:
(NH₄)₂SO₄ + 2KOH → K₂SO₄ + 2NH₃↑ + 2H₂O -
Полное ионное:
2NH₄⁺ + SO₄²⁻ + 2K⁺ + 2OH⁻ → 2K⁺ + SO₄²⁻ + 2NH₃↑ + 2H₂O -
Сокращенное ионное:
NH₄⁺ + OH⁻ → NH₃↑ + H₂O
Уравнения реакций для склянки №2 (K₃PO₄):
-
Молекулярное:
3LiCl + K₃PO₄ → Li₃PO₄↓ + 3KCl -
Полное ионное:
3Li⁺ + 3Cl⁻ + 3K⁺ + PO₄³⁻ → Li₃PO₄↓ + 3K⁺ + 3Cl⁻ -
Сокращенное ионное:
3Li⁺ + PO₄³⁻ → Li₃PO₄↓
Обоснование выбора реактивов:
-
KOH позволяет идентифицировать (NH₄)₂SO₄ по выделению аммиака.
-
LiCl взаимодействует с K₃PO₄, образуя нерастворимый Li₃PO₄.
-
Na₂CO₃ исключен, так как не дает однозначных результатов для данных веществ.
Номер: 8CEE06
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами гидроксида калия и сульфата натрия, а также растворы трёх реактивов: хлорида бария, пероксида водорода и сульфата железа(II).
Ответ:
Результаты эксперимента:
| № опыта | Реактив | Наблюдаемые признаки (Склянка №1) | Наблюдаемые признаки (Склянка №2) |
|---|---|---|---|
| 1 | FeSO₄ (сульфат железа(II)) | Образование белого осадка, быстро темнеющего до бурого. | Нет изменений. |
| 2 | BaCl₂ (хлорид бария) | Нет изменений. | Образование белого кристаллического осадка. |
Вывод:
-
Склянка №1 содержит гидроксид калия (KOH).
-
Склянка №2 содержит сульфат натрия (Na₂SO₄).
Почему не выбран пероксид водорода (H₂O₂):
Пероксид водорода не дает однозначных признаков реакции с KOH или Na₂SO₄. С KOH H₂O₂ может медленно разлагаться с выделением кислорода, но это сложно наблюдать без дополнительных индикаторов. С Na₂SO₄ реакция отсутствует. Выбранные реактивы (FeSO₄ и BaCl₂) обеспечивают четкие визуальные признаки для идентификации веществ.
Уравнения реакций для склянки №1 (KOH):
-
Молекулярное:
FeSO₄ + 2KOH → Fe(OH)₂↓ (белый) + K₂SO₄
Осадок Fe(OH)₂ окисляется до Fe(OH)₃ (бурого):
4Fe(OH)₂ + O₂ + 2H₂O → 4Fe(OH)₃↓ -
Полное ионное:
Fe²⁺ + SO₄²⁻ + 2K⁺ + 2OH⁻ → Fe(OH)₂↓ + 2K⁺ + SO₄²⁻ -
Сокращенное ионное:
Fe²⁺ + 2OH⁻ → Fe(OH)₂↓
Уравнения реакций для склянки №2 (Na₂SO₄):
-
Молекулярное:
Na₂SO₄ + BaCl₂ → BaSO₄↓ (белый) + 2NaCl -
Полное ионное:
2Na⁺ + SO₄²⁻ + Ba²⁺ + 2Cl⁻ → BaSO₄↓ + 2Na⁺ + 2Cl⁻ -
Сокращенное ионное:
Ba²⁺ + SO₄²⁻ → BaSO₄↓
Обоснование выбора реактивов:
-
FeSO₄ взаимодействует с KOH, образуя характерный осадок Fe(OH)₂, который окисляется до бурого Fe(OH)₃.
-
BaCl₂ реагирует с Na₂SO₄, давая нерастворимый BaSO₄.
-
H₂O₂ исключен, так как его реакции с данными веществами не дают четких визуальных признаков.
Номер: 07A579
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами нитрата кальция и фосфата калия, а также три реактива: железо, растворы карбоната натрия и нитрата серебра.
Ответ:
Результаты эксперимента:
| № опыта | Реактив | Наблюдаемые признаки (Склянка №1) | Наблюдаемые признаки (Склянка №2) |
|---|---|---|---|
| 1 | Na₂CO₃ | Образование белого осадка (CaCO₃). | Нет изменений. |
| 2 | AgNO₃ | Нет изменений. | Образование жёлтого осадка (Ag₃PO₄). |
Вывод:
-
Склянка №1 содержит нитрат кальция — Ca(NO₃)₂.
-
Склянка №2 содержит фосфат калия — K₃PO₄.
Почему не выбрано железо (Fe):
Железо не реагирует с нитратом кальция и фосфатом калия, так как кальций и калий — более активные металлы, чем железо. Реакции замещения не происходит.
Уравнения реакций для склянки №1 (Ca(NO₃)₂):
-
Молекулярное:
Ca(NO₃)₂ + Na₂CO₃ → CaCO₃↓ + 2NaNO₃ -
Полное ионное:
Ca²⁺ + 2NO₃⁻ + 2Na⁺ + CO₃²⁻ → CaCO₃↓ + 2Na⁺ + 2NO₃⁻ -
Сокращенное ионное:
Ca²⁺ + CO₃²⁻ → CaCO₃↓
Уравнения реакций для склянки №2 (K₃PO₄):
-
Молекулярное:
K₃PO₄ + 3AgNO₃ → Ag₃PO₄↓ + 3KNO₃ -
Полное ионное:
3K⁺ + PO₄³⁻ + 3Ag⁺ + 3NO₃⁻ → Ag₃PO₄↓ + 3K⁺ + 3NO₃⁻ -
Сокращенное ионное:
PO₄³⁻ + 3Ag⁺ → Ag₃PO₄↓
Обоснование выбора реактивов:
-
Na₂CO₃ реагирует с Ca(NO₃)₂, образуя нерастворимый CaCO₃.
-
AgNO₃ взаимодействует с K₃PO₄, давая жёлтый осадок Ag₃PO₄.
-
Fe исключён, так как не участвует в реакциях с данными веществами.
Номер: 794C7E
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами гидроксида калия и хлорида магния, а также растворы трёх реактивов: сульфата меди(II), серной кислоты и карбоната натрия.
Ответ:
Результаты эксперимента:
| № опыта | Реактив | Наблюдаемые признаки (Склянка №1) | Наблюдаемые признаки (Склянка №2) |
|---|---|---|---|
| 1 | CuSO₄ (сульфат меди(II)) | Образование голубого осадка (Cu(OH)₂). | Нет изменений. |
| 2 | Na₂CO₃ (карбонат натрия) | Нет изменений. | Образование белого осадка (MgCO₃). |
Вывод:
-
Склянка №1 содержит гидроксид калия — KOH.
-
Склянка №2 содержит хлорид магния — MgCl₂.
Почему не выбрана серная кислота (H₂SO₄):
Серная кислота не дает четких визуальных признаков для различения KOH и MgCl₂. С KOH она реагирует нейтрализацией без осадка или газа, а с MgCl₂ образует растворимые продукты (MgSO₄ и HCl). Выбранные реактивы (CuSO₄ и Na₂CO₃) обеспечивают однозначные реакции с образованием характерных осадков.
Уравнения реакций для склянки №1 (KOH):
-
Молекулярное:
CuSO₄ + 2KOH → Cu(OH)₂↓ + K₂SO₄ -
Полное ионное:
Cu²⁺ + SO₄²⁻ + 2K⁺ + 2OH⁻ → Cu(OH)₂↓ + 2K⁺ + SO₄²⁻ -
Сокращенное ионное:
Cu²⁺ + 2OH⁻ → Cu(OH)₂↓
Уравнения реакций для склянки №2 (MgCl₂):
-
Молекулярное:
MgCl₂ + Na₂CO₃ → MgCO₃↓ + 2NaCl -
Полное ионное:
Mg²⁺ + 2Cl⁻ + 2Na⁺ + CO₃²⁻ → MgCO₃↓ + 2Na⁺ + 2Cl⁻ -
Сокращенное ионное:
Mg²⁺ + CO₃²⁻ → MgCO₃↓
Обоснование выбора реактивов:
-
CuSO₄ взаимодействует с KOH, образуя голубой осадок Cu(OH)₂.
-
Na₂CO₃ реагирует с MgCl₂, давая белый осадок MgCO₃.
-
H₂SO₄ исключен, так как не позволяет четко различить вещества.
Номер: 14D37E
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами гидрокарбоната натрия и сульфата магния, а также три реактива: соляная кислота, растворы гидроксида калия и хлорида натрия.
Ответ:
Результаты эксперимента:
| № опыта | Реактив | Наблюдаемые признаки (Склянка №1) | Наблюдаемые признаки (Склянка №2) |
|---|---|---|---|
| 1 | HCl (соляная кислота) | Выделение газа (CO₂) с пузырьками. | Нет изменений. |
| 2 | KOH (гидроксид калия) | Нет осадка (возможно слабое помутнение при нагревании). | Образование белого осадка (Mg(OH)₂). |
Вывод:
-
Склянка №1 содержит гидрокарбонат натрия — NaHCO₃.
-
Склянка №2 содержит сульфат магния — MgSO₄.
Почему не выбран хлорид натрия (NaCl):
NaCl не реагирует ни с NaHCO₃, ни с MgSO₄, так как продукты реакций (NaCl и MgCl₂, Na₂SO₄) растворимы. Нет визуальных признаков для идентификации веществ.
Уравнения реакций для склянки №1 (NaHCO₃):
-
Молекулярное:
NaHCO₃ + HCl → NaCl + H₂O + CO₂↑ -
Полное ионное:
Na⁺ + HCO₃⁻ + H⁺ + Cl⁻ → Na⁺ + Cl⁻ + H₂O + CO₂↑ -
Сокращенное ионное:
HCO₃⁻ + H⁺ → H₂O + CO₂↑
Уравнения реакций для склянки №2 (MgSO₄):
-
Молекулярное:
MgSO₄ + 2KOH → Mg(OH)₂↓ + K₂SO₄ -
Полное ионное:
Mg²⁺ + SO₄²⁻ + 2K⁺ + 2OH⁻ → Mg(OH)₂↓ + 2K⁺ + SO₄²⁻ -
Сокращенное ионное:
Mg²⁺ + 2OH⁻ → Mg(OH)₂↓
Обоснование выбора реактивов:
-
HCl взаимодействует с NaHCO₃, выделяя CO₂, что позволяет идентифицировать гидрокарбонат.
-
KOH реагирует с MgSO₄, образуя характерный белый осадок Mg(OH)₂.
-
NaCl исключен, так как не дает реакций с данными веществами.
Номер: 27897F
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами гидроксида калия и хлорида алюминия, а также растворы трёх реактивов: аммиака, сульфата цинка и хлорида аммония.
Ответ:
Результаты эксперимента:
| № опыта | Реактив | Наблюдаемые признаки (Склянка №1) | Наблюдаемые признаки (Склянка №2) |
|---|---|---|---|
| 1 | NH₃ (аммиак) | Нет изменений. | Образование белого осадка (Al(OH)₃). |
| 2 | NH₄Cl (хлорид аммония) | Выделение газа с резким запахом (NH₃). | Нет изменений. |
Вывод:
-
Склянка №1 содержит гидроксид калия — KOH.
-
Склянка №2 содержит хлорид аммония — AlCl₃.
Почему не выбран сульфат цинка (ZnSO₄):
Сульфат цинка реагирует только с KOH, образуя осадок Zn(OH)₂, который может растворяться в избытке щёлочи. Однако это требует точного дозирования реактива и не даёт однозначного различия между веществами. Выбранные реактивы (NH₃ и NH₄Cl) обеспечивают четкие и уникальные признаки для идентификации.
Уравнения реакций для склянки №1 (KOH):
-
Молекулярное:
NH₄Cl + KOH → KCl + NH₃↑ + H₂O -
Полное ионное:
NH₄⁺ + Cl⁻ + K⁺ + OH⁻ → K⁺ + Cl⁻ + NH₃↑ + H₂O -
Сокращенное ионное:
NH₄⁺ + OH⁻ → NH₃↑ + H₂O
Уравнения реакций для склянки №2 (AlCl₃):
-
Молекулярное:
AlCl₃ + 3NH₃ + 3H₂O → Al(OH)₃↓ + 3NH₄Cl -
Полное ионное:
Al³⁺ + 3Cl⁻ + 3NH₃ + 3H₂O → Al(OH)₃↓ + 3NH₄⁺ + 3Cl⁻ -
Сокращенное ионное:
Al³⁺ + 3NH₃ + 3H₂O → Al(OH)₃↓ + 3NH₄⁺
Обоснование выбора реактивов:
-
NH₃ взаимодействует с AlCl₃, образуя белый осадок Al(OH)₃.
-
NH₄Cl реагирует с KOH при нагревании, выделяя аммиак (NH₃).
-
ZnSO₄ исключён, так как не даёт однозначных признаков для различения веществ.
Номер: 284579
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами гидроксида калия и хлорида бария, а также три реактива: соляная кислота, растворы хлорида меди(II) и карбоната натрия.
Ответ:
Результаты эксперимента:
| № опыта | Реактив | Наблюдаемые признаки (Склянка №1) | Наблюдаемые признаки (Склянка №2) |
|---|---|---|---|
| 1 | CuCl₂ (хлорид меди(II)) | Образование голубого осадка (Cu(OH)₂). | Нет изменений. |
| 2 | Na₂CO₃ (карбонат натрия) | Нет изменений. | Образование белого осадка (BaCO₃). |
Вывод:
-
Склянка №1 содержит гидроксид калия — KOH.
-
Склянка №2 содержит хлорид бария — BaCl₂.
Почему не выбрана соляная кислота (HCl):
HCl не дает визуальных признаков реакции с KOH (нейтрализация без осадка или газа) и не взаимодействует с BaCl₂. Выбранные реактивы (CuCl₂ и Na₂CO₃) обеспечивают четкие реакции с образованием характерных осадков.
Уравнения реакций для склянки №1 (KOH):
-
Молекулярное:
CuCl₂ + 2KOH → Cu(OH)₂↓ + 2KCl -
Полное ионное:
Cu²⁺ + 2Cl⁻ + 2K⁺ + 2OH⁻ → Cu(OH)₂↓ + 2K⁺ + 2Cl⁻ -
Сокращенное ионное:
Cu²⁺ + 2OH⁻ → Cu(OH)₂↓
Уравнения реакций для склянки №2 (BaCl₂):
-
Молекулярное:
BaCl₂ + Na₂CO₃ → BaCO₃↓ + 2NaCl -
Полное ионное:
Ba²⁺ + 2Cl⁻ + 2Na⁺ + CO₃²⁻ → BaCO₃↓ + 2Na⁺ + 2Cl⁻ -
Сокращенное ионное:
Ba²⁺ + CO₃²⁻ → BaCO₃↓
Обоснование выбора реактивов:
-
CuCl₂ реагирует с KOH, образуя голубой осадок Cu(OH)₂.
-
Na₂CO₃ взаимодействует с BaCl₂, давая белый осадок BaCO₃.
-
HCl исключена, так как не позволяет однозначно определить вещества.
Номер: D6767D
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами хлорида бария и фосфата калия, а также растворы трёх реактивов: серной кислоты, гидроксида натрия и хлорида лития.
Ответ:
Результаты эксперимента:
| № опыта | Реактив | Наблюдаемые признаки (Склянка №1) | Наблюдаемые признаки (Склянка №2) |
|---|---|---|---|
| 1 | H₂SO₄ (серная кислота) | Образование белого осадка (BaSO₄). | Нет изменений. |
| 2 | LiCl (хлорид лития) | Нет изменений. | Образование белого осадка (Li₃PO₄). |
Вывод:
-
Склянка №1 содержит хлорид бария — BaCl₂.
-
Склянка №2 содержит фосфат калия — K₃PO₄.
Почему не выбран гидроксид натрия (NaOH):
Гидроксид натрия не взаимодействует с BaCl₂ и K₃PO₄ с образованием осадка или газа, так как продукты реакций (Ba(OH)₂ и KOH) растворимы в воде. Выбранные реактивы (H₂SO₄ и LiCl) обеспечивают четкие визуальные признаки для идентификации веществ.
Уравнения реакций для склянки №1 (BaCl₂):
-
Молекулярное:
BaCl₂ + H₂SO₄ → BaSO₄↓ + 2HCl -
Полное ионное:
Ba²⁺ + 2Cl⁻ + 2H⁺ + SO₄²⁻ → BaSO₄↓ + 2H⁺ + 2Cl⁻ -
Сокращенное ионное:
Ba²⁺ + SO₄²⁻ → BaSO₄↓
Уравнения реакций для склянки №2 (K₃PO₄):
-
Молекулярное:
K₃PO₄ + 3LiCl → Li₃PO₄↓ + 3KCl -
Полное ионное:
3K⁺ + PO₄³⁻ + 3Li⁺ + 3Cl⁻ → Li₃PO₄↓ + 3K⁺ + 3Cl⁻ -
Сокращенное ионное:
PO₄³⁻ + 3Li⁺ → Li₃PO₄↓
Обоснование выбора реактивов:
-
H₂SO₄ реагирует с BaCl₂, образуя нерастворимый BaSO₄ (белый осадок).
-
LiCl взаимодействует с K₃PO₄, давая осадок Li₃PO₄ (белый).
-
NaOH исключен, так как не позволяет различить вещества визуально.
Номер: 4C25B6
Для проведения эксперимента выданы склянки № 1 и № 2 с соляной кислотой и раствором гидроксида калия, а также три реактива: растворы карбоната натрия, хлорида бария и сульфата железа(II).
Ответ:
Результаты эксперимента:
| № опыта | Реактив | Наблюдаемые признаки (Склянка №1) | Наблюдаемые признаки (Склянка №2) |
|---|---|---|---|
| 1 | Na₂CO₃ (карбонат натрия) | Выделение газа (CO₂) с пузырьками. | Нет изменений. |
| 2 | FeSO₄ (сульфат железа(II)) | Нет изменений. | Образование белого осадка, постепенно темнеющего до бурого (Fe(OH)₂ → Fe(OH)₃). |
Вывод:
-
Склянка №1 содержит соляную кислоту — HCl.
-
Склянка №2 содержит гидроксид калия — KOH.
Почему не выбран хлорид бария (BaCl₂):
Хлорид бария не взаимодействует ни с HCl, ни с KOH. Продукты реакций (Ba(OH)₂ и BaCl₂) растворимы, поэтому визуальные признаки отсутствуют.
Уравнения реакций для склянки №1 (HCl):
-
Молекулярное:
2HCl+Na2CO3→2NaCl+H2O+CO2↑ -
Полное ионное:
2H++2Cl−+2Na++CO32−→ 2Na++2Cl−+H2O+CO2↑ -
Сокращенное ионное:
2H++CO32−→ H2O+CO2↑
Уравнения реакций для склянки №2 (KOH):
-
Молекулярное:
FeSO4+2KOH→Fe(OH)2↓+K2SO4Окисление осадка:
4Fe(OH)2+O2+2H2O→4Fe(OH)3↓ -
Полное ионное:
Fe2++SO42−+2K++2OH−→Fe(OH)2↓+2K++SO42− -
Сокращенное ионное:
Fe2++2OH−→Fe(OH)2↓
Обоснование выбора реактивов:
-
Na₂CO₃ позволяет определить HCl по выделению CO₂.
-
FeSO₄ реагирует с KOH, образуя характерный осадок Fe(OH)₂.
-
BaCl₂ исключен, так как не дает визуальных признаков.
Номер: 27E3B3
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами сульфата натрия и гидроксида калия, а также растворы трёх реактивов: нитрата натрия, хлорида бария и хлорида железа(III).
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | BaCl₂ | Белый осадок | Нет изменений |
| 2 | FeCl₃ | Нет изменений | Бурый осадок |
Вывод:
В склянке №1 находится сульфат натрия (Na₂SO₄), в склянке №2 — гидроксид калия (KOH).
Обоснование выбора реактивов:
-
Хлорид бария (BaCl₂) реагирует с сульфатом натрия, образуя белый осадок сульфата бария:
Na₂SO₄ + BaCl₂ → BaSO₄↓ + 2NaCl. -
Хлорид железа(III) (FeCl₃) реагирует с гидроксидом калия, образуя бурый осадок гидроксида железа(III):
3KOH + FeCl₃ → Fe(OH)₃↓ + 3KCl. -
Нитрат натрия (NaNO₃) не выбран, так как не взаимодействует ни с Na₂SO₄, ни с KOH (продукты реакций растворимы).
Уравнения реакций для склянки №1 (Na₂SO₄):
-
Молекулярное: Na₂SO₄ + BaCl₂ → BaSO₄↓ + 2NaCl
-
Полное ионное: 2Na⁺ + SO₄²⁻ + Ba²⁺ + 2Cl⁻ → BaSO₄↓ + 2Na⁺ + 2Cl⁻
-
Сокращённое ионное: Ba²⁺ + SO₄²⁻ → BaSO₄↓
Уравнения реакций для склянки №2 (KOH):
-
Молекулярное: 3KOH + FeCl₃ → Fe(OH)₃↓ + 3KCl
-
Полное ионное: 3K⁺ + 3OH⁻ + Fe³⁺ + 3Cl⁻ → Fe(OH)₃↓ + 3K⁺ + 3Cl⁻
-
Сокращённое ионное: Fe³⁺ + 3OH⁻ → Fe(OH)₃↓
Примечание: Реактивы выбраны на основе различий в химических свойствах сульфатов (реакция с Ba²⁺) и гидроксидов (реакция с Fe³⁺). Нитрат натрия исключён, так как не даёт видимых признаков реакций.
Номер: 971DBF
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами фосфата калия и сульфата цинка, а также растворы трёх реактивов: хлорида магния, соляной кислоты и аммиака.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | MgCl₂ | Белый осадок | Нет изменений |
| 2 | NH₃ (водн.) | Нет изменений | Белый осадок |
Вывод:
В склянке №1 находится фосфат калия (K₃PO₄), в склянке №2 — сульфат цинка (ZnSO₄).
Обоснование выбора реактивов:
-
Хлорид магния (MgCl₂) реагирует с фосфатом калия, образуя белый осадок фосфата магния:
2K₃PO₄ + 3MgCl₂ → Mg₃(PO₄)₂↓ + 6KCl. -
Аммиак (NH₃) реагирует с сульфатом цинка, образуя белый осадок гидроксида цинка:
ZnSO₄ + 2NH₃ + 2H₂O → Zn(OH)₂↓ + (NH₄)₂SO₄. -
Соляная кислота (HCl) не выбрана, так как не взаимодействует с K₃PO₄ (продукты реакции растворимы) и с ZnSO₄ (реакция не идёт).
Уравнения реакций для склянки №1 (K₃PO₄):
-
Молекулярное:
2K₃PO₄ + 3MgCl₂ → Mg₃(PO₄)₂↓ + 6KCl -
Полное ионное:
6K⁺ + 2PO₄³⁻ + 3Mg²⁺ + 6Cl⁻ → Mg₃(PO₄)₂↓ + 6K⁺ + 6Cl⁻ -
Сокращённое ионное:
3Mg²⁺ + 2PO₄³⁻ → Mg₃(PO₄)₂↓
Уравнения реакций для склянки №2 (ZnSO₄):
-
Молекулярное:
ZnSO₄ + 2NH₃ + 2H₂O → Zn(OH)₂↓ + (NH₄)₂SO₄ -
Полное ионное:
Zn²⁺ + SO₄²⁻ + 2NH₃ + 2H₂O → Zn(OH)₂↓ + 2NH₄⁺ + SO₄²⁻ -
Сокращённое ионное:
Zn²⁺ + 2NH₃ + 2H₂O → Zn(OH)₂↓ + 2NH₄⁺
Примечание:
-
Фосфат калия определён по реакции с MgCl₂ (характерный белый осадок).
-
Сульфат цинка идентифицирован по взаимодействию с NH₃ (белый осадок гидроксида).
-
Соляная кислота исключена, так как не даёт визуальных изменений с данными веществами.
Номер: 309BBF
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами сульфата цинка и фосфата калия, а также три реактива: соляная кислота, растворы нитрата серебра и нитрата бария.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | Ba(NO₃)₂ | Белый осадок | Белый осадок |
| 2 | AgNO₃ | Нет изменений | Жёлтый осадок |
Вывод:
В склянке №1 находится сульфат цинка (ZnSO₄), в склянке №2 — фосфат калия (K₃PO₄).
Обоснование выбора реактивов:
-
Нитрат бария (Ba(NO₃)₂) взаимодействует с сульфатом цинка, образуя белый осадок сульфата бария:
ZnSO₄ + Ba(NO₃)₂ → BaSO₄↓ + Zn(NO₃)₂.
С фосфатом калия также образуется белый осадок фосфата бария:
2K₃PO₄ + 3Ba(NO₃)₂ → Ba₃(PO₄)₂↓ + 6KNO₃. -
Нитрат серебра (AgNO₃) не реагирует с сульфатом цинка (сульфат серебра растворим), но с фосфатом калия даёт жёлтый осадок фосфата серебра:
K₃PO₄ + 3AgNO₃ → Ag₃PO₄↓ + 3KNO₃. -
Соляная кислота (HCl) не выбрана, так как не вызывает видимых изменений с данными веществами.
Уравнения реакций для склянки №1 (ZnSO₄):
-
Молекулярное:
ZnSO₄ + Ba(NO₃)₂ → BaSO₄↓ + Zn(NO₃)₂ -
Полное ионное:
Zn²⁺ + SO₄²⁻ + Ba²⁺ + 2NO₃⁻ → BaSO₄↓ + Zn²⁺ + 2NO₃⁻ -
Сокращённое ионное:
Ba²⁺ + SO₄²⁻ → BaSO₄↓
Уравнения реакций для склянки №2 (K₃PO₄):
-
Молекулярное:
K₃PO₄ + 3AgNO₃ → Ag₃PO₄↓ + 3KNO₃ -
Полное ионное:
3K⁺ + PO₄³⁻ + 3Ag⁺ + 3NO₃⁻ → Ag₃PO₄↓ + 3K⁺ + 3NO₃⁻ -
Сокращённое ионное:
3Ag⁺ + PO₄³⁻ → Ag₃PO₄↓
Примечание:
-
Сульфат цинка определён по реакции с Ba(NO₃)₂ (белый осадок) и отсутствию реакции с AgNO₃.
-
Фосфат калия идентифицирован по образованию белого осадка с Ba(NO₃)₂ и жёлтого осадка с AgNO₃.
-
Соляная кислота исключена, так как не даёт визуальных признаков взаимодействия.
Номер: 3C0CB3
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами нитрата серебра и серной кислоты, а также три реактива: медь, оксид кремния(IV) и раствор нитрата кальция.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | Cu (медь) | Серебристый осадок, голубой раствор | Нет изменений |
| 2 | Ca(NO₃)₂ | Нет изменений | Белый осадок |
Вывод:
В склянке №1 находится нитрат серебра (AgNO₃), в склянке №2 — серная кислота (H₂SO₄).
Обоснование выбора реактивов:
-
Медь (Cu) реагирует с нитратом серебра, вытесняя серебро:
Cu + 2AgNO₃ → Cu(NO₃)₂ + 2Ag↓.
Наблюдается серебристый осадок и голубой раствор нитрата меди(II). -
Нитрат кальция (Ca(NO₃)₂) взаимодействует с серной кислотой, образуя белый осадок сульфата кальция:
H₂SO₄ + Ca(NO₃)₂ → CaSO₄↓ + 2HNO₃. -
Оксид кремния(IV) (SiO₂) не выбран, так как не реагирует ни с AgNO₃, ни с H₂SO₄.
Уравнения реакций для склянки №1 (AgNO₃):
-
Молекулярное:
Cu + 2AgNO₃ → Cu(NO₃)₂ + 2Ag↓ -
Полное ионное:
Cu + 2Ag⁺ + 2NO₃⁻ → Cu²⁺ + 2NO₃⁻ + 2Ag↓ -
Сокращённое ионное:
Cu + 2Ag⁺ → Cu²⁺ + 2Ag↓
Уравнения реакций для склянки №2 (H₂SO₄):
-
Молекулярное:
H₂SO₄ + Ca(NO₃)₂ → CaSO₄↓ + 2HNO₃ -
Полное ионное:
2H⁺ + SO₄²⁻ + Ca²⁺ + 2NO₃⁻ → CaSO₄↓ + 2H⁺ + 2NO₃⁻ -
Сокращённое ионное:
Ca²⁺ + SO₄²⁻ → CaSO₄↓
Примечание:
-
Нитрат серебра идентифицирован по реакции с медью (выпадение серебра и изменение цвета раствора).
-
Серная кислота определена по взаимодействию с нитратом кальция (белый осадок сульфата кальция).
-
Оксид кремния(IV) исключён, так как не даёт видимых реакций.
Номер: 434914
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами хлорида лития и нитрата бария, а также растворы трёх реактивов: гидроксида натрия, нитрата серебра и серной кислоты.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | AgNO₃ | Белый творожистый осадок | Нет изменений |
| 2 | H₂SO₄ | Нет изменений | Белый кристаллический осадок |
Вывод:
В склянке №1 находится хлорид лития (LiCl), в склянке №2 — нитрат бария (Ba(NO₃)₂).
Обоснование выбора реактивов:
-
Нитрат серебра (AgNO₃):
-
Реагирует с хлоридом лития, образуя белый творожистый осадок хлорида серебра:
LiCl + AgNO₃ → AgCl↓ + LiNO₃. -
С нитратом бария реакция не происходит (нитрат серебра и нитрат бария оба растворимы).
-
-
Серная кислота (H₂SO₄):
-
Взаимодействует с нитратом бария, образуя белый кристаллический осадок сульфата бария:
Ba(NO₃)₂ + H₂SO₄ → BaSO₄↓ + 2HNO₃. -
С хлоридом лития реакция не идёт (продукты растворимы).
-
-
Гидроксид натрия (NaOH) не выбран, так как:
-
С LiCl и Ba(NO₃)₂ не образует нерастворимых продуктов (LiOH и Ba(OH)₂ растворимы в воде).
-
Уравнения реакций для склянки №1 (LiCl):
-
Молекулярное:
LiCl + AgNO₃ → AgCl↓ + LiNO₃ -
Полное ионное:
Li⁺ + Cl⁻ + Ag⁺ + NO₃⁻ → AgCl↓ + Li⁺ + NO₃⁻ -
Сокращённое ионное:
Ag⁺ + Cl⁻ → AgCl↓
Уравнения реакций для склянки №2 (Ba(NO₃)₂):
-
Молекулярное:
Ba(NO₃)₂ + H₂SO₄ → BaSO₄↓ + 2HNO₃ -
Полное ионное:
Ba²⁺ + 2NO₃⁻ + 2H⁺ + SO₄²⁻ → BaSO₄↓ + 2H⁺ + 2NO₃⁻ -
Сокращённое ионное:
Ba²⁺ + SO₄²⁻ → BaSO₄↓
Примечание:
-
Хлорид лития идентифицирован по реакции с AgNO₃ (белый осадок).
-
Нитрат бария определён по взаимодействию с H₂SO₄ (белый осадок сульфата бария).
-
Гидроксид натрия исключён, так как не даёт видимых признаков реакций.
Номер: C83218
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами гидроксида калия и нитрата серебра, а также три реактива: соляная кислота, оксид меди(II) и раствор нитрата кальция.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | HCl | Нет изменений | Белый творожистый осадок |
| 2 | Ca(NO₃)₂ | Белый осадок | Нет изменений |
Вывод:
В склянке №1 находится гидроксид калия (KOH), в склянке №2 — нитрат серебра (AgNO₃).
Обоснование выбора реактивов:
-
Соляная кислота (HCl):
-
Реагирует с нитратом серебра (AgNO₃), образуя белый творожистый осадок хлорида серебра:
AgNO₃ + HCl → AgCl↓ + HNO₃. -
С гидроксидом калия (KOH) реакция нейтрализации проходит без видимых изменений:
KOH + HCl → KCl + H₂O.
-
-
Нитрат кальция (Ca(NO₃)₂):
-
Взаимодействует с гидроксидом калия (KOH), образуя белый осадок гидроксида кальция:
Ca(NO₃)₂ + 2KOH → Ca(OH)₂↓ + 2KNO₃. -
С нитратом серебра (AgNO₃) реакция не происходит (оба вещества растворимы).
-
-
Оксид меди(II) (CuO) не выбран, так как не реагирует ни с KOH, ни с AgNO₃ при обычных условиях.
Уравнения реакций для склянки №1 (KOH):
-
Молекулярное:
Ca(NO₃)₂ + 2KOH → Ca(OH)₂↓ + 2KNO₃ -
Полное ионное:
Ca²⁺ + 2NO₃⁻ + 2K⁺ + 2OH⁻ → Ca(OH)₂↓ + 2K⁺ + 2NO₃⁻ -
Сокращённое ионное:
Ca²⁺ + 2OH⁻ → Ca(OH)₂↓
Уравнения реакций для склянки №2 (AgNO₃):
-
Молекулярное:
AgNO₃ + HCl → AgCl↓ + HNO₃ -
Полное ионное:
Ag⁺ + NO₃⁻ + H⁺ + Cl⁻ → AgCl↓ + H⁺ + NO₃⁻ -
Сокращённое ионное:
Ag⁺ + Cl⁻ → AgCl↓
Примечание:
-
Гидроксид калия определён по реакции с нитратом кальция (белый осадок).
-
Нитрат серебра идентифицирован по взаимодействию с соляной кислотой (белый творожистый осадок).
-
Оксид меди(II) исключён, так как не даёт видимых признаков реакций.
Номер: 91C015
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами гидроксида калия и хлорида аммония, а также растворы трёх реактивов: гидроксида кальция, фосфата натрия и хлорида меди(II) (возможно использование лакмусовой бумаги).
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | CuCl₂ | Голубой осадок | Нет изменений |
| 2 | Ca(OH)₂ | Нет изменений | Выделение газа с резким запахом (лакмусовая бумага синеет) |
Вывод:
В склянке №1 находится гидроксид калия (KOH), в склянке №2 — хлорид аммония (NH₄Cl).
Обоснование выбора реактивов:
-
Хлорид меди(II) (CuCl₂):
-
Реагирует с гидроксидом калия, образуя голубой осадок гидроксида меди(II):
2KOH + CuCl₂ → Cu(OH)₂↓ + 2KCl. -
С хлоридом аммония реакция не происходит (продукты растворимы).
-
-
Гидроксид кальция (Ca(OH)₂):
-
При нагревании взаимодействует с хлоридом аммония, выделяя аммиак (характерный резкий запах):
2NH₄Cl + Ca(OH)₂ → CaCl₂ + 2NH₃↑ + 2H₂O. -
С гидроксидом калия реакция не идёт (оба вещества — щёлочи).
-
-
Фосфат натрия (Na₃PO₄) не выбран, так как не даёт видимых изменений с KOH и NH₄Cl.
Уравнения реакций для склянки №1 (KOH):
-
Молекулярное:
2KOH + CuCl₂ → Cu(OH)₂↓ + 2KCl -
Полное ионное:
2K⁺ + 2OH⁻ + Cu²⁺ + 2Cl⁻ → Cu(OH)₂↓ + 2K⁺ + 2Cl⁻ -
Сокращённое ионное:
Cu²⁺ + 2OH⁻ → Cu(OH)₂↓
Уравнения реакций для склянки №2 (NH₄Cl):
-
Молекулярное:
2NH₄Cl + Ca(OH)₂ → CaCl₂ + 2NH₃↑ + 2H₂O -
Полное ионное:
2NH₄⁺ + 2Cl⁻ + Ca²⁺ + 2OH⁻ → Ca²⁺ + 2Cl⁻ + 2NH₃↑ + 2H₂O -
Сокращённое ионное:
NH₄⁺ + OH⁻ → NH₃↑ + H₂O
Примечание:
-
Гидроксид калия определён по реакции с CuCl₂ (голубой осадок).
-
Хлорид аммония идентифицирован по взаимодействию с Ca(OH)₂ (выделение аммиака).
-
Для поиска, в какой склянке что налито, можно просто использовать лакмусовую бумагу (но для ответа на ОГЭ этого недостаточно):
-
KOH окрасит лакмус в синий цвет (щёлочь).
-
NH₄Cl окрасит лакмус в красный цвет (кислая среда).
-
Номер: E31C15
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами карбоната натрия и хлорида лития, а также три реактива: растворы гидроксида калия, нитрата кальция и фосфата калия.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | Ca(NO₃)₂ | Белый осадок | Нет изменений |
| 2 | K₃PO₄ | Нет изменений | Белый осадок |
Вывод:
В склянке №1 находится карбонат натрия (Na₂CO₃), в склянке №2 — хлорид лития (LiCl).
Обоснование выбора реактивов:
-
Нитрат кальция (Ca(NO₃)₂):
-
Реагирует с карбонатом натрия, образуя белый осадок карбоната кальция:
Na₂CO₃ + Ca(NO₃)₂ → CaCO₃↓ + 2NaNO₃. -
С хлоридом лития реакция не происходит (продукты растворимы).
-
-
Фосфат калия (K₃PO₄):
-
Взаимодействует с хлоридом лития, образуя белый осадок фосфата лития (Li₃PO₄ малорастворим):
3LiCl + K₃PO₄ → Li₃PO₄↓ + 3KCl. -
С карбонатом натрия реакция не идёт (оба вещества растворимы).
-
-
Гидроксид калия (KOH) не выбран, так как не даёт видимых изменений с Na₂CO₃ и LiCl (продукты реакций растворимы).
Уравнения реакций для склянки №1 (Na₂CO₃):
-
Молекулярное:
Na₂CO₃ + Ca(NO₃)₂ → CaCO₃↓ + 2NaNO₃ -
Полное ионное:
2Na⁺ + CO₃²⁻ + Ca²⁺ + 2NO₃⁻ → CaCO₃↓ + 2Na⁺ + 2NO₃⁻ -
Сокращённое ионное:
Ca²⁺ + CO₃²⁻ → CaCO₃↓
Уравнения реакций для склянки №2 (LiCl):
-
Молекулярное:
3LiCl + K₃PO₄ → Li₃PO₄↓ + 3KCl -
Полное ионное:
3Li⁺ + 3Cl⁻ + 3K⁺ + PO₄³⁻ → Li₃PO₄↓ + 3K⁺ + 3Cl⁻ -
Сокращённое ионное:
3Li⁺ + PO₄³⁻ → Li₃PO₄↓
Примечание:
-
Карбонат натрия определён по реакции с Ca(NO₃)₂ (белый осадок).
-
Хлорид лития идентифицирован по взаимодействию с K₃PO₄ (белый осадок фосфата лития).
-
Гидроксид калия исключён, так как не даёт визуальных признаков реакций.
Номер: 04F32D
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами гидроксида натрия и хлорида кальция, а также растворы трёх реактивов: нитрата натрия, карбоната калия и хлорида алюминия.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | AlCl₃ | Белый осадок (Al(OH)₃) | Нет изменений |
| 2 | K₂CO₃ | Нет изменений | Белый осадок (CaCO₃) |
Вывод:
В склянке №1 находится гидроксид натрия (NaOH), в склянке №2 — хлорид кальция (CaCl₂).
Обоснование выбора реактивов:
-
Хлорид алюминия (AlCl₃):
-
Реагирует с гидроксидом натрия, образуя белый осадок гидроксида алюминия:
AlCl₃ + 3NaOH → Al(OH)₃↓ + 3NaCl. -
С хлоридом кальция реакция не происходит (продукты растворимы).
-
-
Карбонат калия (K₂CO₃):
-
Взаимодействует с хлоридом кальция, образуя белый осадок карбоната кальция:
CaCl₂ + K₂CO₃ → CaCO₃↓ + 2KCl. -
С гидроксидом натрия реакция не идёт (оба вещества растворимы).
-
-
Нитрат натрия (NaNO₃) не выбран, так как не даёт видимых изменений с NaOH и CaCl₂.
Уравнения реакций для склянки №1 (NaOH):
-
Молекулярное:
AlCl₃ + 3NaOH → Al(OH)₃↓ + 3NaCl -
Полное ионное:
Al³⁺ + 3Cl⁻ + 3Na⁺ + 3OH⁻ → Al(OH)₃↓ + 3Na⁺ + 3Cl⁻ -
Сокращённое ионное:
Al³⁺ + 3OH⁻ → Al(OH)₃↓
Уравнения реакций для склянки №2 (CaCl₂):
-
Молекулярное:
CaCl₂ + K₂CO₃ → CaCO₃↓ + 2KCl -
Полное ионное:
Ca²⁺ + 2Cl⁻ + 2K⁺ + CO₃²⁻ → CaCO₃↓ + 2K⁺ + 2Cl⁻ -
Сокращённое ионное:
Ca²⁺ + CO₃²⁻ → CaCO₃↓
Примечание:
-
Гидроксид натрия определён по реакции с AlCl₃ (белый осадок).
-
Хлорид кальция идентифицирован по взаимодействию с K₂CO₃ (белый осадок).
-
Нитрат натрия исключён, так как не участвует в реакциях.
Номер: 75262E
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами карбоната натрия и нитрата серебра, а также три реактива: растворы фосфата калия, нитрата калия и нитрата бария.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | Ba(NO₃)₂ | Белый осадок | Нет изменений |
| 2 | K₃PO₄ | Нет изменений | Жёлтый осадок |
Вывод:
В склянке №1 находится карбонат натрия (Na₂CO₃), в склянке №2 — нитрат серебра (AgNO₃).
Обоснование выбора реактивов:
-
Нитрат бария (Ba(NO₃)₂):
-
Реагирует с карбонатом натрия, образуя белый осадок карбоната бария:
Na₂CO₃ + Ba(NO₃)₂ → BaCO₃↓ + 2NaNO₃. -
С нитратом серебра реакция не происходит (оба вещества растворимы).
-
-
Фосфат калия (K₃PO₄):
-
Взаимодействует с нитратом серебра, образуя жёлтый осадок фосфата серебра:
3AgNO₃ + K₃PO₄ → Ag₃PO₄↓ + 3KNO₃. -
С карбонатом натрия реакция не идёт (продукты растворимы).
-
-
Нитрат калия (KNO₃) не выбран, так как не вызывает видимых изменений с Na₂CO₃ и AgNO₃.
Уравнения реакций для склянки №1 (Na₂CO₃):
-
Молекулярное:
Na₂CO₃ + Ba(NO₃)₂ → BaCO₃↓ + 2NaNO₃ -
Полное ионное:
2Na⁺ + CO₃²⁻ + Ba²⁺ + 2NO₃⁻ → BaCO₃↓ + 2Na⁺ + 2NO₃⁻ -
Сокращённое ионное:
Ba²⁺ + CO₃²⁻ → BaCO₃↓
Уравнения реакций для склянки №2 (AgNO₃):
-
Молекулярное:
3AgNO₃ + K₃PO₄ → Ag₃PO₄↓ + 3KNO₃ -
Полное ионное:
3Ag⁺ + 3NO₃⁻ + 3K⁺ + PO₄³⁻ → Ag₃PO₄↓ + 3K⁺ + 3NO₃⁻ -
Сокращённое ионное:
3Ag⁺ + PO₄³⁻ → Ag₃PO₄↓
Примечание:
-
Карбонат натрия определён по реакции с Ba(NO₃)₂ (белый осадок).
-
Нитрат серебра идентифицирован по взаимодействию с K₃PO₄ (жёлтый осадок).
-
Нитрат калия исключён, так как не участвует в реакциях.
Номер: 58122F
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами гидроксида калия и хлорида бария, а также три реактива: соляная кислота, растворы хлорида магния и карбоната натрия.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | Na₂CO₃ | Нет изменений | Белый осадок |
| 2 | MgCl₂ | Белый осадок | Нет изменений |
Вывод:
В склянке №1 находится гидроксид калия (KOH), в склянке №2 — хлорид бария (BaCl₂).
Обоснование выбора реактивов:
-
Карбонат натрия (Na₂CO₃):
-
Реагирует с хлоридом бария, образуя белый осадок карбоната бария:
BaCl₂ + Na₂CO₃ → BaCO₃↓ + 2NaCl. -
С гидроксидом калия реакция не происходит (продукты растворимы).
-
-
Хлорид магния (MgCl₂):
-
Взаимодействует с гидроксидом калия, образуя белый осадок гидроксида магния:
2KOH + MgCl₂ → Mg(OH)₂↓ + 2KCl. -
С хлоридом бария реакция не идёт (продукты растворимы).
-
-
Соляная кислота (HCl) не выбрана, так как не даёт видимых изменений (реакция нейтрализации с KOH протекает без осадка/газа).
Уравнения реакций для склянки №1 (KOH):
-
Молекулярное:
2KOH + MgCl₂ → Mg(OH)₂↓ + 2KCl -
Полное ионное:
2K⁺ + 2OH⁻ + Mg²⁺ + 2Cl⁻ → Mg(OH)₂↓ + 2K⁺ + 2Cl⁻ -
Сокращённое ионное:
Mg²⁺ + 2OH⁻ → Mg(OH)₂↓
Уравнения реакций для склянки №2 (BaCl₂):
-
Молекулярное:
BaCl₂ + Na₂CO₃ → BaCO₃↓ + 2NaCl -
Полное ионное:
Ba²⁺ + 2Cl⁻ + 2Na⁺ + CO₃²⁻ → BaCO₃↓ + 2Na⁺ + 2Cl⁻ -
Сокращённое ионное:
Ba²⁺ + CO₃²⁻ → BaCO₃↓
Примечание:
-
Гидроксид калия определён по реакции с MgCl₂ (белый осадок).
-
Хлорид бария идентифицирован по взаимодействию с Na₂CO₃ (белый осадок).
-
Соляная кислота исключена, так как не позволяет однозначно различить вещества.
Номер: 976E24
Для проведения эксперимента выданы склянки № 1 и № 2 с соляной кислотой и раствором гидроксида калия, а также три реактива: растворы сульфата меди(II), серной кислоты и карбоната натрия.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | CuSO₄ | Нет изменений | Голубой осадок |
| 2 | Na₂CO₃ | Выделение газа (CO₂) | Нет изменений |
Вывод:
В склянке №1 находится соляная кислота (HCl), в склянке №2 — гидроксид калия (KOH).
Обоснование выбора реактивов:
-
Сульфат меди(II) (CuSO₄):
-
Реагирует с гидроксидом калия, образуя голубой осадок гидроксида меди(II):
2KOH + CuSO₄ → Cu(OH)₂↓ + K₂SO₄. -
С соляной кислотой реакция не происходит (продукты растворимы).
-
-
Карбонат натрия (Na₂CO₃):
-
Взаимодействует с соляной кислотой, выделяя углекислый газ:
2HCl + Na₂CO₃ → 2NaCl + CO₂↑ + H₂O. -
С гидроксидом калия реакция не идёт (продукты растворимы).
-
-
Серная кислота (H₂SO₄) не выбрана, так как не даёт различительных признаков для данных веществ.
Уравнения реакций для склянки №1 (HCl):
-
Молекулярное:
2HCl + Na₂CO₃ → 2NaCl + CO₂↑ + H₂O -
Полное ионное:
2H⁺ + 2Cl⁻ + 2Na⁺ + CO₃²⁻ → 2Na⁺ + 2Cl⁻ + CO₂↑ + H₂O -
Сокращённое ионное:
2H⁺ + CO₃²⁻ → CO₂↑ + H₂O
Уравнения реакций для склянки №2 (KOH):
-
Молекулярное:
2KOH + CuSO₄ → Cu(OH)₂↓ + K₂SO₄ -
Полное ионное:
2K⁺ + 2OH⁻ + Cu²⁺ + SO₄²⁻ → Cu(OH)₂↓ + 2K⁺ + SO₄²⁻ -
Сокращённое ионное:
Cu²⁺ + 2OH⁻ → Cu(OH)₂↓
Примечание:
-
Соляная кислота определена по реакции с Na₂CO₃ (выделение газа).
-
Гидроксид калия идентифицирован по взаимодействию с CuSO₄ (голубой осадок).
-
Серная кислота исключена, так как не позволяет различить вещества.
Номер: 3A1629
Для проведения эксперимента выданы склянки № 1 и № 2 с соляной кислотой и раствором фосфата натрия, а также растворы трёх реактивов: гидроксида калия, карбоната калия и хлорида железа(III).
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | K₂CO₃ | Выделение газа (CO₂) | Нет изменений |
| 2 | FeCl₃ | Нет изменений | Жёлтый осадок |
Вывод:
В склянке №1 находится соляная кислота (HCl), в склянке №2 — фосфат натрия (Na₃PO₄).
Обоснование выбора реактивов:
-
Карбонат калия (K₂CO₃):
-
Реагирует с соляной кислотой, выделяя углекислый газ:
2HCl + K₂CO₃ → 2KCl + CO₂↑ + H₂O. -
С фосфатом натрия реакция не происходит (продукты растворимы).
-
-
Хлорид железа(III) (FeCl₃):
-
Взаимодействует с фосфатом натрия, образуя жёлтый осадок фосфата железа(III):
FeCl₃ + Na₃PO₄ → FePO₄↓ + 3NaCl. -
С соляной кислотой реакция не идёт (продукты растворимы).
-
-
Гидроксид калия (KOH) не выбран, так как не даёт видимых изменений с HCl и Na₃PO₄.
Уравнения реакций для склянки №1 (HCl):
-
Молекулярное:
2HCl + K₂CO₃ → 2KCl + CO₂↑ + H₂O -
Полное ионное:
2H⁺ + 2Cl⁻ + 2K⁺ + CO₃²⁻ → 2K⁺ + 2Cl⁻ + CO₂↑ + H₂O -
Сокращённое ионное:
2H⁺ + CO₃²⁻ → CO₂↑ + H₂O
Уравнения реакций для склянки №2 (Na₃PO₄):
-
Молекулярное:
FeCl₃ + Na₃PO₄ → FePO₄↓ + 3NaCl -
Полное ионное:
Fe³⁺ + 3Cl⁻ + 3Na⁺ + PO₄³⁻ → FePO₄↓ + 3Na⁺ + 3Cl⁻ -
Сокращённое ионное:
Fe³⁺ + PO₄³⁻ → FePO₄↓
Примечание:
-
Соляная кислота определена по реакции с K₂CO₃ (выделение газа).
-
Фосфат натрия идентифицирован по взаимодействию с FeCl₃ (жёлтый осадок).
-
Гидроксид калия исключён, так как не позволяет различить вещества.
Номер: 36482E
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами гидроксида натрия и хлорида бария, а также три реактива: соляная кислота, растворы сульфата натрия и хлорида алюминия.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | Na₂SO₄ | Белый осадок | Нет изменений |
| 2 | AlCl₃ | Нет изменений | Белый осадок |
Вывод:
В склянке №1 находится хлорид бария (BaCl₂), в склянке №2 — гидроксид натрия (NaOH).
Обоснование выбора реактивов:
-
Сульфат натрия (Na₂SO₄):
-
Реагирует с хлоридом бария, образуя белый осадок сульфата бария:
BaCl₂ + Na₂SO₄ → BaSO₄↓ + 2NaCl. -
С гидроксидом натрия реакция не происходит (продукты растворимы).
-
-
Хлорид алюминия (AlCl₃):
-
Взаимодействует с гидроксидом натрия, образуя белый осадок гидроксида алюминия:
AlCl₃ + 3NaOH → Al(OH)₃↓ + 3NaCl. -
С хлоридом бария реакция не идёт (продукты растворимы).
-
-
Соляная кислота (HCl) не выбрана, так как не даёт видимых изменений (реакция нейтрализации с NaOH протекает без осадка/газа).
Уравнения реакций для склянки №1 (BaCl₂):
-
Молекулярное:
BaCl₂ + Na₂SO₄ → BaSO₄↓ + 2NaCl -
Полное ионное:
Ba²⁺ + 2Cl⁻ + 2Na⁺ + SO₄²⁻ → BaSO₄↓ + 2Na⁺ + 2Cl⁻ -
Сокращённое ионное:
Ba²⁺ + SO₄²⁻ → BaSO₄↓
Уравнения реакций для склянки №2 (NaOH):
-
Молекулярное:
AlCl₃ + 3NaOH → Al(OH)₃↓ + 3NaCl -
Полное ионное:
Al³⁺ + 3Cl⁻ + 3Na⁺ + 3OH⁻ → Al(OH)₃↓ + 3Na⁺ + 3Cl⁻ -
Сокращённое ионное:
Al³⁺ + 3OH⁻ → Al(OH)₃↓
Примечание:
-
Хлорид бария определён по реакции с Na₂SO₄ (белый осадок).
-
Гидроксид натрия идентифицирован по взаимодействию с AlCl₃ (белый осадок).
-
Соляная кислота исключена, так как не позволяет однозначно различить вещества.
Номер: CE8BD9
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами гидроксида калия и хлорида лития, а также растворы трёх реактивов: фосфата натрия, сульфата цинка и серной кислоты.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | ZnSO₄ | Белый осадок | Нет изменений |
| 2 | Na₃PO₄ | Нет изменений | Белый осадок |
Вывод:
В склянке №1 находится гидроксид калия (KOH), в склянке №2 — хлорид лития (LiCl).
Обоснование выбора реактивов:
-
Сульфат цинка (ZnSO₄):
-
Реагирует с гидроксидом калия, образуя белый осадок гидроксида цинка:
2KOH + ZnSO₄ → Zn(OH)₂↓ + K₂SO₄. -
С хлоридом лития реакция не происходит (продукты растворимы).
-
-
Фосфат натрия (Na₃PO₄):
-
Взаимодействует с хлоридом лития, образуя белый осадок фосфата лития:
3LiCl + Na₃PO₄ → Li₃PO₄↓ + 3NaCl. -
С гидроксидом калия реакция не идёт (продукты растворимы).
-
-
Серная кислота (H₂SO₄) не выбрана, так как не даёт различительных признаков (реакции нейтрализации с KOH и обмена с LiCl протекают без осадка/газа).
Уравнения реакций для склянки №1 (KOH):
-
Молекулярное:
2KOH + ZnSO₄ → Zn(OH)₂↓ + K₂SO₄ -
Полное ионное:
2K⁺ + 2OH⁻ + Zn²⁺ + SO₄²⁻ → Zn(OH)₂↓ + 2K⁺ + SO₄²⁻ -
Сокращённое ионное:
Zn²⁺ + 2OH⁻ → Zn(OH)₂↓
Уравнения реакций для склянки №2 (LiCl):
-
Молекулярное:
3LiCl + Na₃PO₄ → Li₃PO₄↓ + 3NaCl -
Полное ионное:
3Li⁺ + 3Cl⁻ + 3Na⁺ + PO₄³⁻ → Li₃PO₄↓ + 3Na⁺ + 3Cl⁻ -
Сокращённое ионное:
3Li⁺ + PO₄³⁻ → Li₃PO₄↓
Примечание:
-
Гидроксид калия определён по реакции с ZnSO₄ (белый осадок).
-
Хлорид лития идентифицирован по взаимодействию с Na₃PO₄ (белый осадок).
-
Серная кислота исключена, так как не позволяет различить вещества.
Номер: 9B6FD2
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами серной кислоты и хлорида лития, а также растворы трёх реактивов: сульфата аммония, карбоната калия и фосфата калия.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | K₂CO₃ | Выделение газа (CO₂) | Нет изменений |
| 2 | K₃PO₄ | Нет изменений | Белый осадок |
Вывод:
В склянке №1 находится серная кислота (H₂SO₄), в склянке №2 — хлорид лития (LiCl).
Обоснование выбора реактивов:
-
Карбонат калия (K₂CO₃):
-
Реагирует с серной кислотой, выделяя углекислый газ:
H₂SO₄ + K₂CO₃ → K₂SO₄ + CO₂↑ + H₂O. -
С хлоридом лития реакция не происходит (продукты растворимы).
-
-
Фосфат калия (K₃PO₄):
-
Взаимодействует с хлоридом лития, образуя белый осадок фосфата лития:
3LiCl + K₃PO₄ → Li₃PO₄↓ + 3KCl. -
С серной кислотой реакция не идёт (продукты растворимы).
-
-
Сульфат аммония ((NH₄)₂SO₄) не выбран, так как не даёт видимых изменений с H₂SO₄ и LiCl.
Уравнения реакций для склянки №1 (H₂SO₄):
-
Молекулярное:
H₂SO₄ + K₂CO₃ → K₂SO₄ + CO₂↑ + H₂O -
Полное ионное:
2H⁺ + SO₄²⁻ + 2K⁺ + CO₃²⁻ → 2K⁺ + SO₄²⁻ + CO₂↑ + H₂O -
Сокращённое ионное:
2H⁺ + CO₃²⁻ → CO₂↑ + H₂O
Уравнения реакций для склянки №2 (LiCl):
-
Молекулярное:
3LiCl + K₃PO₄ → Li₃PO₄↓ + 3KCl -
Полное ионное:
3Li⁺ + 3Cl⁻ + 3K⁺ + PO₄³⁻ → Li₃PO₄↓ + 3K⁺ + 3Cl⁻ -
Сокращённое ионное:
3Li⁺ + PO₄³⁻ → Li₃PO₄↓
Примечание:
-
Серная кислота определена по реакции с K₂CO₃ (выделение газа).
-
Хлорид лития идентифицирован по взаимодействию с K₃PO₄ (белый осадок).
-
Сульфат аммония исключён, так как не позволяет различить вещества.
Номер: 3EE0D7
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами сульфата магния и хлорида бария, а также растворы трёх реактивов: гидроксида натрия, хлорида меди(II) и серной кислоты.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | NaOH | Белый осадок | Нет изменений |
| 2 | H₂SO₄ | Нет изменений | Белый осадок |
Вывод:
В склянке №1 находится сульфат магния (MgSO₄), в склянке №2 — хлорид бария (BaCl₂).
Обоснование выбора реактивов:
-
Гидроксид натрия (NaOH):
-
Реагирует с сульфатом магния, образуя белый осадок гидроксида магния:
MgSO₄ + 2NaOH → Mg(OH)₂↓ + Na₂SO₄. -
С хлоридом бария реакция не происходит (продукты растворимы).
-
-
Серная кислота (H₂SO₄):
-
Взаимодействует с хлоридом бария, образуя белый осадок сульфата бария:
BaCl₂ + H₂SO₄ → BaSO₄↓ + 2HCl. -
С сульфатом магния реакция не идёт (продукты растворимы).
-
-
Хлорид меди(II) (CuCl₂) не выбран, так как не даёт видимых изменений с MgSO₄ и BaCl₂.
Уравнения реакций для склянки №1 (MgSO₄):
-
Молекулярное:
MgSO₄ + 2NaOH → Mg(OH)₂↓ + Na₂SO₄ -
Полное ионное:
Mg²⁺ + SO₄²⁻ + 2Na⁺ + 2OH⁻ → Mg(OH)₂↓ + 2Na⁺ + SO₄²⁻ -
Сокращённое ионное:
Mg²⁺ + 2OH⁻ → Mg(OH)₂↓
Уравнения реакций для склянки №2 (BaCl₂):
-
Молекулярное:
BaCl₂ + H₂SO₄ → BaSO₄↓ + 2HCl -
Полное ионное:
Ba²⁺ + 2Cl⁻ + 2H⁺ + SO₄²⁻ → BaSO₄↓ + 2H⁺ + 2Cl⁻ -
Сокращённое ионное:
Ba²⁺ + SO₄²⁻ → BaSO₄↓
Примечание:
-
Сульфат магния определён по реакции с NaOH (белый осадок).
-
Хлорид бария идентифицирован по взаимодействию с H₂SO₄ (белый осадок).
-
Хлорид меди(II) исключён, так как не позволяет различить вещества.
Номер: 4BD457
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами гидроксида натрия и сульфата цинка, а также растворы трёх реактивов: фосфата калия, хлорида железа(III) и серной кислоты.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | FeCl₃ | Бурый осадок | Нет изменений |
| 2 | K₃PO₄ | Нет изменений | Белый осадок |
Вывод:
В склянке №1 находится гидроксид натрия (NaOH), в склянке №2 — сульфат цинка (ZnSO₄).
Обоснование выбора реактивов:
-
Хлорид железа(III) (FeCl₃):
-
Реагирует с гидроксидом натрия, образуя бурый осадок гидроксида железа(III):
3NaOH + FeCl₃ → Fe(OH)₃↓ + 3NaCl. -
С сульфатом цинка реакция не происходит (продукты растворимы).
-
-
Фосфат калия (K₃PO₄):
-
Взаимодействует с сульфатом цинка, образуя белый осадок фосфата цинка:
3ZnSO₄ + 2K₃PO₄ → Zn₃(PO₄)₂↓ + 3K₂SO₄. -
С гидроксидом натрия реакция не идёт (продукты растворимы).
-
-
Серная кислота (H₂SO₄) не выбрана, так как не даёт различительных признаков (реакция нейтрализации с NaOH протекает без осадка, а с ZnSO₄ не реагирует).
Уравнения реакций для склянки №1 (NaOH):
-
Молекулярное:
3NaOH + FeCl₃ → Fe(OH)₃↓ + 3NaCl -
Полное ионное:
3Na⁺ + 3OH⁻ + Fe³⁺ + 3Cl⁻ → Fe(OH)₃↓ + 3Na⁺ + 3Cl⁻ -
Сокращённое ионное:
Fe³⁺ + 3OH⁻ → Fe(OH)₃↓
Уравнения реакций для склянки №2 (ZnSO₄):
-
Молекулярное:
3ZnSO₄ + 2K₃PO₄ → Zn₃(PO₄)₂↓ + 3K₂SO₄ -
Полное ионное:
3Zn²⁺ + 3SO₄²⁻ + 6K⁺ + 2PO₄³⁻ → Zn₃(PO₄)₂↓ + 6K⁺ + 3SO₄²⁻ -
Сокращённое ионное:
3Zn²⁺ + 2PO₄³⁻ → Zn₃(PO₄)₂↓
Примечание:
-
Гидроксид натрия определён по реакции с FeCl₃ (бурый осадок).
-
Сульфат цинка идентифицирован по взаимодействию с K₃PO₄ (белый осадок).
-
Серная кислота исключена, так как не позволяет различить вещества.
Номер: F3735F
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами фосфата натрия и хлорида кальция, а также растворы трёх реактивов: серной кислоты, хлорида натрия и нитрата бария.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | H₂SO₄ | Нет изменений | Белый осадок |
| 2 | Ba(NO₃)₂ | Белый осадок | Нет изменений |
Вывод:
В склянке №1 находится фосфат натрия (Na₃PO₄), в склянке №2 — хлорид кальция (CaCl₂).
Обоснование выбора реактивов:
-
Серная кислота (H₂SO₄):
-
Реагирует с хлоридом кальция, образуя белый осадок сульфата кальция:
CaCl₂ + H₂SO₄ → CaSO₄↓ + 2HCl. -
С фосфатом натрия реакция не происходит (продукты растворимы).
-
-
Нитрат бария (Ba(NO₃)₂):
-
Взаимодействует с фосфатом натрия, образуя белый осадок фосфата бария:
3Ba(NO₃)₂ + 2Na₃PO₄ → Ba₃(PO₄)₂↓ + 6NaNO₃. -
С хлоридом кальция реакция не идёт (продукты растворимы).
-
-
Хлорид натрия (NaCl) не выбран, так как не даёт видимых изменений.
Уравнения реакций для склянки №1 (Na₃PO₄):
-
Молекулярное:
3Ba(NO₃)₂ + 2Na₃PO₄ → Ba₃(PO₄)₂↓ + 6NaNO₃ -
Полное ионное:
3Ba²⁺ + 6NO₃⁻ + 6Na⁺ + 2PO₄³⁻ → Ba₃(PO₄)₂↓ + 6Na⁺ + 6NO₃⁻ -
Сокращённое ионное:
3Ba²⁺ + 2PO₄³⁻ → Ba₃(PO₄)₂↓
Уравнения реакций для склянки №2 (CaCl₂):
-
Молекулярное:
CaCl₂ + H₂SO₄ → CaSO₄↓ + 2HCl -
Полное ионное:
Ca²⁺ + 2Cl⁻ + 2H⁺ + SO₄²⁻ → CaSO₄↓ + 2H⁺ + 2Cl⁻ -
Сокращённое ионное:
Ca²⁺ + SO₄²⁻ → CaSO₄↓
Примечание:
-
Фосфат натрия определён по реакции с Ba(NO₃)₂ (белый осадок).
-
Хлорид кальция идентифицирован по взаимодействию с H₂SO₄ (белый осадок).
-
Хлорид натрия исключён, так как не участвует в реакциях.
Номер: 578953
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами гидроксида натрия и хлорида кальция, а также растворы трёх реактивов: серной кислоты, хлорида меди(II) и хлорида калия.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | CuCl₂ | Голубой осадок | Нет изменений |
| 2 | H₂SO₄ | Нет изменений | Белый осадок |
Вывод:
В склянке №1 находится гидроксид натрия (NaOH), в склянке №2 — хлорид кальция (CaCl₂).
Обоснование выбора реактивов:
-
Хлорид меди(II) (CuCl₂):
-
Реагирует с гидроксидом натрия, образуя голубой осадок гидроксида меди(II):
CuCl₂ + 2NaOH → Cu(OH)₂↓ + 2NaCl. -
С хлоридом кальция реакция не происходит (продукты растворимы).
-
-
Серная кислота (H₂SO₄):
-
Взаимодействует с хлоридом кальция, образуя белый осадок сульфата кальция:
CaCl₂ + H₂SO₄ → CaSO₄↓ + 2HCl. -
С гидроксидом натрия реакция нейтрализации протекает без видимых изменений.
-
-
Хлорид калия (KCl) не выбран, так как не даёт различительных признаков.
Уравнения реакций для склянки №1 (NaOH):
-
Молекулярное:
CuCl₂ + 2NaOH → Cu(OH)₂↓ + 2NaCl -
Полное ионное:
Cu²⁺ + 2Cl⁻ + 2Na⁺ + 2OH⁻ → Cu(OH)₂↓ + 2Na⁺ + 2Cl⁻ -
Сокращённое ионное:
Cu²⁺ + 2OH⁻ → Cu(OH)₂↓
Уравнения реакций для склянки №2 (CaCl₂):
-
Молекулярное:
CaCl₂ + H₂SO₄ → CaSO₄↓ + 2HCl -
Полное ионное:
Ca²⁺ + 2Cl⁻ + 2H⁺ + SO₄²⁻ → CaSO₄↓ + 2H⁺ + 2Cl⁻ -
Сокращённое ионное:
Ca²⁺ + SO₄²⁻ → CaSO₄↓
Примечание:
-
Гидроксид натрия определён по реакции с CuCl₂ (голубой осадок).
-
Хлорид кальция идентифицирован по взаимодействию с H₂SO₄ (белый осадок).
-
Хлорид калия исключён, так как не участвует в реакциях.
Номер: 8ABA5A
Для проведения эксперимента выданы склянки № 1 и № 2 с раствором нитрата бария и соляной кислотой, а также растворы трёх реактивов: хлорида железа(III), нитрата серебра и сульфата алюминия.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | Al₂(SO₄)₃ | Белый осадок (BaSO₄) | Нет изменений |
| 2 | AgNO₃ | Нет изменений | Белый творожистый осадок (AgCl) |
Вывод:
В склянке №1 находится нитрат бария (Ba(NO₃)₂), в склянке №2 — соляная кислота (HCl).
Обоснование выбора реактивов:
-
Сульфат алюминия (Al₂(SO₄)₃):
-
Реагирует с нитратом бария, образуя белый осадок сульфата бария:
Ba(NO₃)₂ + Al₂(SO₄)₃ → 3BaSO₄↓ + 2Al(NO₃)₃. -
С соляной кислотой реакция не происходит (продукты растворимы).
-
-
Нитрат серебра (AgNO₃):
-
Взаимодействует с соляной кислотой, образуя белый творожистый осадок хлорида серебра:
HCl + AgNO₃ → AgCl↓ + HNO₃. -
С нитратом бария реакция не идёт (продукты растворимы).
-
-
Хлорид железа(III) (FeCl₃) не выбран, так как не даёт видимых изменений.
Уравнения реакций для склянки №1 (Ba(NO₃)₂):
-
Молекулярное:
3Ba(NO₃)₂ + Al₂(SO₄)₃ → 3BaSO₄↓ + 2Al(NO₃)₃ -
Полное ионное:
3Ba²⁺ + 6NO₃⁻ + 2Al³⁺ + 3SO₄²⁻ → 3BaSO₄↓ + 2Al³⁺ + 6NO₃⁻ -
Сокращённое ионное:
Ba²⁺ + SO₄²⁻ → BaSO₄↓
Уравнения реакций для склянки №2 (HCl):
-
Молекулярное:
HCl + AgNO₃ → AgCl↓ + HNO₃ -
Полное ионное:
H⁺ + Cl⁻ + Ag⁺ + NO₃⁻ → AgCl↓ + H⁺ + NO₃⁻ -
Сокращённое ионное:
Ag⁺ + Cl⁻ → AgCl↓
Примечание:
-
Нитрат бария определён по реакции с Al₂(SO₄)₃ (белый осадок).
-
Соляная кислота идентифицирована по взаимодействию с AgNO₃ (белый осадок).
-
Хлорид железа(III) исключён, так как не участвует в реакциях.
Номер: F964AE
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами гидроксида калия и хлорида кальция, а также три реактива: соляная кислота, растворы хлорида железа(III) и фосфата натрия.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | FeCl₃ | Бурый осадок | Нет изменений |
| 2 | Na₃PO₄ | Нет изменений | Белый осадок |
Вывод:
В склянке №1 находится гидроксид калия (KOH), в склянке №2 — хлорид кальция (CaCl₂).
Обоснование выбора реактивов:
-
Хлорид железа(III) (FeCl₃):
-
Реагирует с гидроксидом калия, образуя бурый осадок гидроксида железа(III):
FeCl₃ + 3KOH → Fe(OH)₃↓ + 3KCl. -
С хлоридом кальция реакция не происходит (продукты растворимы).
-
-
Фосфат натрия (Na₃PO₄):
-
Взаимодействует с хлоридом кальция, образуя белый осадок фосфата кальция:
3CaCl₂ + 2Na₃PO₄ → Ca₃(PO₄)₂↓ + 6NaCl. -
С гидроксидом калия реакция не идёт (продукты растворимы).
-
-
Соляная кислота (HCl) не выбрана, так как не даёт видимых изменений (реакция нейтрализации с KOH протекает без осадка/газа).
Уравнения реакций для склянки №1 (KOH):
-
Молекулярное:
FeCl₃ + 3KOH → Fe(OH)₃↓ + 3KCl -
Полное ионное:
Fe³⁺ + 3Cl⁻ + 3K⁺ + 3OH⁻ → Fe(OH)₃↓ + 3K⁺ + 3Cl⁻ -
Сокращённое ионное:
Fe³⁺ + 3OH⁻ → Fe(OH)₃↓
Уравнения реакций для склянки №2 (CaCl₂):
-
Молекулярное:
3CaCl₂ + 2Na₃PO₄ → Ca₃(PO₄)₂↓ + 6NaCl -
Полное ионное:
3Ca²⁺ + 6Cl⁻ + 6Na⁺ + 2PO₄³⁻ → Ca₃(PO₄)₂↓ + 6Na⁺ + 6Cl⁻ -
Сокращённое ионное:
3Ca²⁺ + 2PO₄³⁻ → Ca₃(PO₄)₂↓
Примечание:
-
Гидроксид калия определён по реакции с FeCl₃ (бурый осадок).
-
Хлорид кальция идентифицирован по взаимодействию с Na₃PO₄ (белый осадок).
-
Соляная кислота исключена, так как не позволяет различить вещества.
Номер: 7D19A0
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами фосфата натрия и хлорида алюминия, а также растворы трёх реактивов: гидроксида натрия, хлорида магния и хлорида аммония.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | NaOH | Белый осадок | Нет изменений |
| 2 | MgCl₂ | Нет изменений | Белый осадок |
Вывод:
В склянке №1 находится хлорид алюминия (AlCl₃), в склянке №2 — фосфат натрия (Na₃PO₄).
Обоснование выбора реактивов:
-
Гидроксид натрия (NaOH):
-
Реагирует с хлоридом алюминия, образуя белый осадок гидроксида алюминия:
AlCl₃ + 3NaOH → Al(OH)₃↓ + 3NaCl. -
С фосфатом натрия реакция не происходит (продукты растворимы).
-
-
Хлорид магния (MgCl₂):
-
Взаимодействует с фосфатом натрия, образуя белый осадок фосфата магния:
3MgCl₂ + 2Na₃PO₄ → Mg₃(PO₄)₂↓ + 6NaCl. -
С хлоридом алюминия реакция не идёт (продукты растворимы).
-
-
Хлорид аммония (NH₄Cl) не выбран, так как не даёт различительных признаков.
Уравнения реакций для склянки №1 (AlCl₃):
-
Молекулярное:
AlCl₃ + 3NaOH → Al(OH)₃↓ + 3NaCl -
Полное ионное:
Al³⁺ + 3Cl⁻ + 3Na⁺ + 3OH⁻ → Al(OH)₃↓ + 3Na⁺ + 3Cl⁻ -
Сокращённое ионное:
Al³⁺ + 3OH⁻ → Al(OH)₃↓
Уравнения реакций для склянки №2 (Na₃PO₄):
-
Молекулярное:
3MgCl₂ + 2Na₃PO₄ → Mg₃(PO₄)₂↓ + 6NaCl -
Полное ионное:
3Mg²⁺ + 6Cl⁻ + 6Na⁺ + 2PO₄³⁻ → Mg₃(PO₄)₂↓ + 6Na⁺ + 6Cl⁻ -
Сокращённое ионное:
3Mg²⁺ + 2PO₄³⁻ → Mg₃(PO₄)₂↓
Примечание:
-
Хлорид алюминия определён по реакции с NaOH (белый осадок).
-
Фосфат натрия идентифицирован по взаимодействию с MgCl₂ (белый осадок).
-
Хлорид аммония исключён, так как не участвует в реакциях.
Номер: 7978A7
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами гидроксида натрия и сульфата аммония, а также растворы трёх реактивов: нитрата натрия, хлорида железа(III), хлорида бария.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | FeCl₃ | Бурый осадок | Нет изменений |
| 2 | BaCl₂ | Нет изменений | Белый осадок |
Вывод:
В склянке №1 находится гидроксид натрия (NaOH), в склянке №2 — сульфат аммония ((NH₄)₂SO₄).
Обоснование выбора реактивов:
-
Хлорид железа(III) (FeCl₃):
-
Реагирует с гидроксидом натрия, образуя бурый осадок гидроксида железа(III):
FeCl₃ + 3NaOH → Fe(OH)₃↓ + 3NaCl. -
С сульфатом аммония реакция не происходит (продукты растворимы).
-
-
Хлорид бария (BaCl₂):
-
Взаимодействует с сульфатом аммония, образуя белый осадок сульфата бария:
(NH₄)₂SO₄ + BaCl₂ → BaSO₄↓ + 2NH₄Cl. -
С гидроксидом натрия реакция не идёт (продукты растворимы).
-
-
Нитрат натрия (NaNO₃) не выбран, так как не даёт видимых изменений.
Уравнения реакций для склянки №1 (NaOH):
-
Молекулярное:
FeCl₃ + 3NaOH → Fe(OH)₃↓ + 3NaCl -
Полное ионное:
Fe³⁺ + 3Cl⁻ + 3Na⁺ + 3OH⁻ → Fe(OH)₃↓ + 3Na⁺ + 3Cl⁻ -
Сокращённое ионное:
Fe³⁺ + 3OH⁻ → Fe(OH)₃↓
Уравнения реакций для склянки №2 ((NH₄)₂SO₄):
-
Молекулярное:
(NH₄)₂SO₄ + BaCl₂ → BaSO₄↓ + 2NH₄Cl -
Полное ионное:
2NH₄⁺ + SO₄²⁻ + Ba²⁺ + 2Cl⁻ → BaSO₄↓ + 2NH₄⁺ + 2Cl⁻ -
Сокращённое ионное:
Ba²⁺ + SO₄²⁻ → BaSO₄↓
Примечание:
-
Гидроксид натрия определён по реакции с FeCl₃ (бурый осадок).
-
Сульфат аммония идентифицирован по взаимодействию с BaCl₂ (белый осадок).
-
Нитрат натрия исключён, так как не участвует в реакциях.
Номер: D579AC
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами фосфата натрия и сульфата цинка, а также растворы трёх реактивов: хлорида магния, соляной кислоты и аммиака.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | MgCl₂ | Белый осадок | Нет изменений |
| 2 | NH₃ (водн.) | Нет изменений | Белый осадок |
Вывод:
В склянке №1 находится фосфат натрия (Na₃PO₄), в склянке №2 — сульфат цинка (ZnSO₄).
Обоснование выбора реактивов:
-
Хлорид магния (MgCl₂):
-
Реагирует с фосфатом натрия, образуя белый осадок фосфата магния:
3MgCl₂ + 2Na₃PO₄ → Mg₃(PO₄)₂↓ + 6NaCl. -
С сульфатом цинка реакция не происходит (продукты растворимы).
-
-
Аммиак (NH₃):
-
Взаимодействует с сульфатом цинка, образуя белый осадок гидроксида цинка:
ZnSO₄ + 2NH₃ + 2H₂O → Zn(OH)₂↓ + (NH₄)₂SO₄. -
С фосфатом натрия реакция не идёт.
-
-
Соляная кислота (HCl) не выбрана, так как не даёт различительных признаков.
Уравнения реакций для склянки №1 (Na₃PO₄):
-
Молекулярное:
3MgCl₂ + 2Na₃PO₄ → Mg₃(PO₄)₂↓ + 6NaCl -
Полное ионное:
3Mg²⁺ + 6Cl⁻ + 6Na⁺ + 2PO₄³⁻ → Mg₃(PO₄)₂↓ + 6Na⁺ + 6Cl⁻ -
Сокращённое ионное:
3Mg²⁺ + 2PO₄³⁻ → Mg₃(PO₄)₂↓
Уравнения реакций для склянки №2 (ZnSO₄):
-
Молекулярное:
ZnSO₄ + 2NH₃ + 2H₂O → Zn(OH)₂↓ + (NH₄)₂SO₄ -
Полное ионное:
Zn²⁺ + SO₄²⁻ + 2NH₃ + 2H₂O → Zn(OH)₂↓ + 2NH₄⁺ + SO₄²⁻ -
Сокращённое ионное:
Zn²⁺ + 2OH⁻ → Zn(OH)₂↓
Примечание:
-
Фосфат натрия определён по реакции с MgCl₂ (белый осадок).
-
Сульфат цинка идентифицирован по взаимодействию с NH₃ (белый осадок).
-
Соляная кислота исключена, так как не позволяет различить вещества.
Номер: 59DBA2
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами фосфата калия и нитрата бария, а также растворы трёх реактивов: сульфата магния, серной кислоты и хлорида кальция.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | H₂SO₄ | Нет изменений | Белый осадок (BaSO₄) |
| 2 | CaCl₂ | Белый осадок (Ca₃(PO₄)₂) | Нет изменений |
Вывод:
В склянке №1 находится фосфат калия (K₃PO₄), в склянке №2 — нитрат бария (Ba(NO₃)₂).
Обоснование выбора реактивов:
-
Серная кислота (H₂SO₄):
-
Реагирует с нитратом бария, образуя белый осадок сульфата бария:
Ba(NO₃)₂ + H₂SO₄ → BaSO₄↓ + 2HNO₃. -
С фосфатом калия реакция не происходит (продукты растворимы).
-
-
Хлорид кальция (CaCl₂):
-
Взаимодействует с фосфатом калия, образуя белый осадок фосфата кальция:
3CaCl₂ + 2K₃PO₄ → Ca₃(PO₄)₂↓ + 6KCl. -
С нитратом бария реакция не идёт (продукты растворимы).
-
-
Сульфат магния (MgSO₄) не выбран, так как даёт осадок с обоими веществами.
Уравнения реакций для склянки №1 (K₃PO₄):
-
Молекулярное:
3CaCl₂ + 2K₃PO₄ → Ca₃(PO₄)₂↓ + 6KCl -
Полное ионное:
3Ca²⁺ + 6Cl⁻ + 6K⁺ + 2PO₄³⁻ → Ca₃(PO₄)₂↓ + 6K⁺ + 6Cl⁻ -
Сокращённое ионное:
3Ca²⁺ + 2PO₄³⁻ → Ca₃(PO₄)₂↓
Уравнения реакций для склянки №2 (Ba(NO₃)₂):
-
Молекулярное:
Ba(NO₃)₂ + H₂SO₄ → BaSO₄↓ + 2HNO₃ -
Полное ионное:
Ba²⁺ + 2NO₃⁻ + 2H⁺ + SO₄²⁻ → BaSO₄↓ + 2H⁺ + 2NO₃⁻ -
Сокращённое ионное:
Ba²⁺ + SO₄²⁻ → BaSO₄↓
Примечание:
-
Фосфат калия определён по реакции с CaCl₂ (белый осадок).
-
Нитрат бария идентифицирован по взаимодействию с H₂SO₄ (белый осадок).
-
Сульфат магния исключён, так как не позволяет различить вещества.
Номер: A026AC
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами серной кислоты и хлорида лития, а также растворы трёх реактивов: хлорида бария, гидроксида натрия и фосфата натрия.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | BaCl₂ | Белый осадок | Нет изменений |
| 2 | Na₃PO₄ | Нет изменений | Белый осадок |
Вывод:
В склянке №1 находится серная кислота (H₂SO₄), в склянке №2 — хлорид лития (LiCl).
Обоснование выбора реактивов:
-
Хлорид бария (BaCl₂):
-
Реагирует с серной кислотой, образуя белый осадок сульфата бария:
H₂SO₄ + BaCl₂ → BaSO₄↓ + 2HCl. -
С хлоридом лития реакция не происходит (продукты растворимы).
-
-
Фосфат натрия (Na₃PO₄):
-
Взаимодействует с хлоридом лития, образуя белый осадок фосфата лития:
3LiCl + Na₃PO₄ → Li₃PO₄↓ + 3NaCl. -
С серной кислотой реакция не идёт (продукты растворимы).
-
-
Гидроксид натрия (NaOH) не выбран, так как не даёт видимых изменений.
Уравнения реакций для склянки №1 (H₂SO₄):
-
Молекулярное:
H₂SO₄ + BaCl₂ → BaSO₄↓ + 2HCl -
Полное ионное:
2H⁺ + SO₄²⁻ + Ba²⁺ + 2Cl⁻ → BaSO₄↓ + 2H⁺ + 2Cl⁻ -
Сокращённое ионное:
Ba²⁺ + SO₄²⁻ → BaSO₄↓
Уравнения реакций для склянки №2 (LiCl):
-
Молекулярное:
3LiCl + Na₃PO₄ → Li₃PO₄↓ + 3NaCl -
Полное ионное:
3Li⁺ + 3Cl⁻ + 3Na⁺ + PO₄³⁻ → Li₃PO₄↓ + 3Na⁺ + 3Cl⁻ -
Сокращённое ионное:
3Li⁺ + PO₄³⁻ → Li₃PO₄↓
Примечание:
-
Серная кислота определена по реакции с BaCl₂ (белый осадок).
-
Хлорид лития идентифицирован по взаимодействию с Na₃PO₄ (белый осадок).
-
Гидроксид натрия исключён, так как не позволяет различить вещества.
Номер: 9307AE
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами гидроксида натрия и нитрата бария, а также растворы трёх реактивов: хлорида лития, хлорида железа(III) и серной кислоты.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | FeCl₃ | Бурый осадок | Нет изменений |
| 2 | H₂SO₄ | Нет изменений | Белый осадок |
Вывод:
В склянке №1 находится гидроксид натрия (NaOH), в склянке №2 — нитрат бария (Ba(NO₃)₂).
Обоснование выбора реактивов:
-
Хлорид железа(III) (FeCl₃):
-
Реагирует с гидроксидом натрия, образуя бурый осадок гидроксида железа(III):
FeCl₃ + 3NaOH → Fe(OH)₃↓ + 3NaCl. -
С нитратом бария реакция не происходит (продукты растворимы).
-
-
Серная кислота (H₂SO₄):
-
Взаимодействует с нитратом бария, образуя белый осадок сульфата бария:
Ba(NO₃)₂ + H₂SO₄ → BaSO₄↓ + 2HNO₃. -
С гидроксидом натрия реакция нейтрализации протекает без видимых изменений.
-
-
Хлорид лития (LiCl) не выбран, так как не даёт различительных признаков.
Уравнения реакций для склянки №1 (NaOH):
-
Молекулярное:
FeCl₃ + 3NaOH → Fe(OH)₃↓ + 3NaCl -
Полное ионное:
Fe³⁺ + 3Cl⁻ + 3Na⁺ + 3OH⁻ → Fe(OH)₃↓ + 3Na⁺ + 3Cl⁻ -
Сокращённое ионное:
Fe³⁺ + 3OH⁻ → Fe(OH)₃↓
Уравнения реакций для склянки №2 (Ba(NO₃)₂):
-
Молекулярное:
Ba(NO₃)₂ + H₂SO₄ → BaSO₄↓ + 2HNO₃ -
Полное ионное:
Ba²⁺ + 2NO₃⁻ + 2H⁺ + SO₄²⁻ → BaSO₄↓ + 2H⁺ + 2NO₃⁻ -
Сокращённое ионное:
Ba²⁺ + SO₄²⁻ → BaSO₄↓
Примечание:
-
Гидроксид натрия определён по реакции с FeCl₃ (бурый осадок).
-
Нитрат бария идентифицирован по взаимодействию с H₂SO₄ (белый осадок).
-
Хлорид лития исключён, так как не участвует в реакциях.
Номер: 3428A6
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами сульфата аммония и хлорида бария, а также три реактива: соляная кислота, растворы гидроксида калия и фосфата натрия (возможно использование лакмусовой бумаги).
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | KOH (нагрев) | Выделение газа с резким запахом (NH₃), лакмус синеет | Нет изменений |
| 2 | Na₃PO₄ | Нет изменений | Белый осадок (Ba₃(PO₄)₂) |
Вывод:
В склянке №1 находится сульфат аммония ((NH₄)₂SO₄), в склянке №2 — хлорид бария (BaCl₂).
Обоснование выбора реактивов:
-
Гидроксид калия (KOH):
-
При нагревании с сульфатом аммония выделяется аммиак (NH₃):
(NH₄)₂SO₄ + 2KOH → K₂SO₄ + 2NH₃↑ + 2H₂O. -
С хлоридом бария реакция не происходит (продукты растворимы).
-
-
Фосфат натрия (Na₃PO₄):
-
Взаимодействует с хлоридом бария, образуя белый осадок фосфата бария:
3BaCl₂ + 2Na₃PO₄ → Ba₃(PO₄)₂↓ + 6NaCl. -
С сульфатом аммония реакция не идёт (продукты растворимы).
-
-
Соляная кислота (HCl) не выбрана, так как не даёт различительных признаков.
Уравнения реакций для склянки №1 ((NH₄)₂SO₄):
-
Молекулярное:
(NH₄)₂SO₄ + 2KOH → K₂SO₄ + 2NH₃↑ + 2H₂O -
Полное ионное:
2NH₄⁺ + SO₄²⁻ + 2K⁺ + 2OH⁻ → 2K⁺ + SO₄²⁻ + 2NH₃↑ + 2H₂O -
Сокращённое ионное:
NH₄⁺ + OH⁻ → NH₃↑ + H₂O
Уравнения реакций для склянки №2 (BaCl₂):
-
Молекулярное:
3BaCl₂ + 2Na₃PO₄ → Ba₃(PO₄)₂↓ + 6NaCl -
Полное ионное:
3Ba²⁺ + 6Cl⁻ + 6Na⁺ + 2PO₄³⁻ → Ba₃(PO₄)₂↓ + 6Na⁺ + 6Cl⁻ -
Сокращённое ионное:
3Ba²⁺ + 2PO₄³⁻ → Ba₃(PO₄)₂↓
Примечание:
-
Сульфат аммония определён по выделению аммиака при реакции с KOH.
-
Хлорид бария идентифицирован по образованию белого осадка с Na₃PO₄.
-
Лакмусовая бумага может дополнительно подтвердить кислую среду в склянке №1 (покраснение).
Номер: 8AB1AF
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами карбоната натрия и хлорида бария, а также три реактива: соляная кислота, растворы сульфата натрия и пероксида водорода.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | HCl | Выделение газа (CO₂) | Нет изменений |
| 2 | Na₂SO₄ | Нет изменений | Белый осадок (BaSO₄) |
Вывод:
В склянке №1 находится карбонат натрия (Na₂CO₃), в склянке №2 — хлорид бария (BaCl₂).
Обоснование выбора реактивов:
-
Соляная кислота (HCl):
-
Реагирует с карбонатом натрия, выделяя углекислый газ:
Na₂CO₃ + 2HCl → 2NaCl + CO₂↑ + H₂O. -
С хлоридом бария реакция не происходит (продукты растворимы).
-
-
Сульфат натрия (Na₂SO₄):
-
Взаимодействует с хлоридом бария, образуя белый осадок сульфата бария:
BaCl₂ + Na₂SO₄ → BaSO₄↓ + 2NaCl. -
С карбонатом натрия реакция не идёт (продукты растворимы).
-
-
Пероксид водорода (H₂O₂) не выбран, так как не даёт различительных признаков.
Уравнения реакций для склянки №1 (Na₂CO₃):
-
Молекулярное:
Na₂CO₃ + 2HCl → 2NaCl + CO₂↑ + H₂O -
Полное ионное:
2Na⁺ + CO₃²⁻ + 2H⁺ + 2Cl⁻ → 2Na⁺ + 2Cl⁻ + CO₂↑ + H₂O -
Сокращённое ионное:
CO₃²⁻ + 2H⁺ → CO₂↑ + H₂O
Уравнения реакций для склянки №2 (BaCl₂):
-
Молекулярное:
BaCl₂ + Na₂SO₄ → BaSO₄↓ + 2NaCl -
Полное ионное:
Ba²⁺ + 2Cl⁻ + 2Na⁺ + SO₄²⁻ → BaSO₄↓ + 2Na⁺ + 2Cl⁻ -
Сокращённое ионное:
Ba²⁺ + SO₄²⁻ → BaSO₄↓
Примечание:
-
Карбонат натрия определён по реакции с HCl (выделение газа).
-
Хлорид бария идентифицирован по взаимодействию с Na₂SO₄ (белый осадок).
-
Пероксид водорода исключён, так как не участвует в реакциях.
Номер: 4324C4
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами серной кислоты и гидроксида калия, а также три реактива: медь, растворы хлорида бария и сульфата меди(II).
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | BaCl₂ | Белый осадок (BaSO₄) | Нет изменений |
| 2 | CuSO₄ | Нет изменений | Голубой осадок (Cu(OH)₂) |
Вывод:
В склянке №1 находится серная кислота (H₂SO₄), в склянке №2 — гидроксид калия (KOH).
Обоснование выбора реактивов:
-
Хлорид бария (BaCl₂):
-
Реагирует с серной кислотой, образуя белый осадок сульфата бария:
H₂SO₄ + BaCl₂ → BaSO₄↓ + 2HCl. -
С гидроксидом калия реакция не происходит (продукты растворимы).
-
-
Сульфат меди(II) (CuSO₄):
-
Взаимодействует с гидроксидом калия, образуя голубой осадок гидроксида меди(II):
CuSO₄ + 2KOH → Cu(OH)₂↓ + K₂SO₄. -
С серной кислотой реакция не идёт (одноимённые ионы).
-
-
Медь (Cu) не выбрана, так как реакция с разбавленной H₂SO₄ без нагревания не происходит, а с KOH не взаимодействует.
Уравнения реакций для склянки №1 (H₂SO₄):
-
Молекулярное:
H₂SO₄ + BaCl₂ → BaSO₄↓ + 2HCl -
Полное ионное:
2H⁺ + SO₄²⁻ + Ba²⁺ + 2Cl⁻ → BaSO₄↓ + 2H⁺ + 2Cl⁻ -
Сокращённое ионное:
Ba²⁺ + SO₄²⁻ → BaSO₄↓
Уравнения реакций для склянки №2 (KOH):
-
Молекулярное:
CuSO₄ + 2KOH → Cu(OH)₂↓ + K₂SO₄ -
Полное ионное:
Cu²⁺ + SO₄²⁻ + 2K⁺ + 2OH⁻ → Cu(OH)₂↓ + 2K⁺ + SO₄²⁻ -
Сокращённое ионное:
Cu²⁺ + 2OH⁻ → Cu(OH)₂↓
Примечание:
-
Серная кислота определена по реакции с BaCl₂ (белый осадок).
-
Гидроксид калия идентифицирован по взаимодействию с CuSO₄ (голубой осадок).
-
Медь исключена, так как не позволяет различить вещества.
Номер: BECEC0
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами нитрата бария и хлорида магния, а также растворы трёх реактивов: гидроксида натрия, сульфата алюминия и хлорида аммония.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | Al₂(SO₄)₃ | Белый осадок | Нет изменений |
| 2 | NaOH | Нет изменений | Белый осадок |
Вывод:
В склянке №1 находится нитрат бария (Ba(NO₃)₂), в склянке №2 — хлорид магния (MgCl₂).
Обоснование выбора реактивов:
-
Сульфат алюминия (Al₂(SO₄)₃):
-
Реагирует с нитратом бария, образуя белый осадок сульфата бария:
Ba(NO₃)₂ + Al₂(SO₄)₃ → 3BaSO₄↓ + 2Al(NO₃)₃. -
С хлоридом магния реакция не происходит (продукты растворимы).
-
-
Гидроксид натрия (NaOH):
-
Взаимодействует с хлоридом магния, образуя белый осадок гидроксида магния:
MgCl₂ + 2NaOH → Mg(OH)₂↓ + 2NaCl. -
С нитратом бария реакция не идёт (гидроксид бария растворим).
-
-
Хлорид аммония (NH₄Cl) не выбран, так как не даёт различительных признаков.
Уравнения реакций для склянки №1 (Ba(NO₃)₂):
-
Молекулярное:
3Ba(NO₃)₂ + Al₂(SO₄)₃ → 3BaSO₄↓ + 2Al(NO₃)₃ -
Полное ионное:
3Ba²⁺ + 6NO₃⁻ + 2Al³⁺ + 3SO₄²⁻ → 3BaSO₄↓ + 2Al³⁺ + 6NO₃⁻ -
Сокращённое ионное:
Ba²⁺ + SO₄²⁻ → BaSO₄↓
Уравнения реакций для склянки №2 (MgCl₂):
-
Молекулярное:
MgCl₂ + 2NaOH → Mg(OH)₂↓ + 2NaCl -
Полное ионное:
Mg²⁺ + 2Cl⁻ + 2Na⁺ + 2OH⁻ → Mg(OH)₂↓ + 2Na⁺ + 2Cl⁻ -
Сокращённое ионное:
Mg²⁺ + 2OH⁻ → Mg(OH)₂↓
Примечание:
-
Нитрат бария определён по реакции с Al₂(SO₄)₃ (белый осадок).
-
Хлорид магния идентифицирован по взаимодействию с NaOH (белый осадок).
-
Хлорид аммония исключён, так как не участвует в реакциях.
Номер: 2117C3
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами гидроксида натрия и серной кислоты, а также три реактива: растворы карбоната калия, нитрата натрия и хлорида железа(III).
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | K₂CO₃ | Выделение газа (CO₂) | Нет изменений |
| 2 | FeCl₃ | Бурый осадок (Fe(OH)₃) | Нет изменений |
Вывод:
В склянке №1 находится серная кислота (H₂SO₄), в склянке №2 — гидроксид натрия (NaOH).
Обоснование выбора реактивов:
-
Карбонат калия (K₂CO₃):
-
Реагирует с серной кислотой, выделяя углекислый газ:
H₂SO₄ + K₂CO₃ → K₂SO₄ + CO₂↑ + H₂O. -
С гидроксидом натрия реакция не происходит (продукты растворимы).
-
-
Хлорид железа(III) (FeCl₃):
-
Взаимодействует с гидроксидом натрия, образуя бурый осадок гидроксида железа(III):
FeCl₃ + 3NaOH → Fe(OH)₃↓ + 3NaCl. -
С серной кислотой реакция не идёт (продукты растворимы).
-
-
Нитрат натрия (NaNO₃) не выбран, так как не даёт видимых изменений.
Уравнения реакций для склянки №1 (H₂SO₄):
-
Молекулярное:
H₂SO₄ + K₂CO₃ → K₂SO₄ + CO₂↑ + H₂O -
Полное ионное:
2H⁺ + SO₄²⁻ + 2K⁺ + CO₃²⁻ → 2K⁺ + SO₄²⁻ + CO₂↑ + H₂O -
Сокращённое ионное:
2H⁺ + CO₃²⁻ → CO₂↑ + H₂O
Уравнения реакций для склянки №2 (NaOH):
-
Молекулярное:
FeCl₃ + 3NaOH → Fe(OH)₃↓ + 3NaCl -
Полное ионное:
Fe³⁺ + 3Cl⁻ + 3Na⁺ + 3OH⁻ → Fe(OH)₃↓ + 3Na⁺ + 3Cl⁻ -
Сокращённое ионное:
Fe³⁺ + 3OH⁻ → Fe(OH)₃↓
Примечание:
-
Серная кислота определена по реакции с K₂CO₃ (выделение газа).
-
Гидроксид натрия идентифицирован по взаимодействию с FeCl₃ (бурый осадок).
-
Нитрат натрия исключён, так как не позволяет различить вещества.
Номер: D7E2C0
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами гидроксида калия и хлорида бария, а также растворы трёх реактивов: сульфата натрия, нитрата калия и хлорида алюминия.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | Na₂SO₄ | Нет изменений | Белый осадок (BaSO₄) |
| 2 | AlCl₃ | Белый осадок (Al(OH)₃) | Нет изменений |
Вывод:
В склянке №1 находится гидроксид калия (KOH), в склянке №2 — хлорид бария (BaCl₂).
Обоснование выбора реактивов:
-
Сульфат натрия (Na₂SO₄):
-
Реагирует с хлоридом бария, образуя белый осадок сульфата бария:
BaCl₂ + Na₂SO₄ → BaSO₄↓ + 2NaCl. -
С гидроксидом калия реакция не происходит (продукты растворимы).
-
-
Хлорид алюминия (AlCl₃):
-
Взаимодействует с гидроксидом калия, образуя белый осадок гидроксида алюминия:
AlCl₃ + 3KOH → Al(OH)₃↓ + 3KCl. -
С хлоридом бария реакция не идёт (продукты растворимы).
-
-
Нитрат калия (KNO₃) не выбран, так как не даёт видимых изменений.
Уравнения реакций для склянки №1 (KOH):
-
Молекулярное:
AlCl₃ + 3KOH → Al(OH)₃↓ + 3KCl -
Полное ионное:
Al³⁺ + 3Cl⁻ + 3K⁺ + 3OH⁻ → Al(OH)₃↓ + 3K⁺ + 3Cl⁻ -
Сокращённое ионное:
Al³⁺ + 3OH⁻ → Al(OH)₃↓
Уравнения реакций для склянки №2 (BaCl₂):
-
Молекулярное:
BaCl₂ + Na₂SO₄ → BaSO₄↓ + 2NaCl -
Полное ионное:
Ba²⁺ + 2Cl⁻ + 2Na⁺ + SO₄²⁻ → BaSO₄↓ + 2Na⁺ + 2Cl⁻ -
Сокращённое ионное:
Ba²⁺ + SO₄²⁻ → BaSO₄↓
Примечание:
-
Гидроксид калия определён по реакции с AlCl₃ (белый осадок).
-
Хлорид бария идентифицирован по взаимодействию с Na₂SO₄ (белый осадок).
-
Нитрат калия исключён, так как не позволяет различить вещества.
Номер: 3382C3
Для проведения эксперимента выданы склянки № 1 и № 2 с соляной кислотой и раствором гидроксида натрия, а также растворы трёх реактивов: гидрокарбоната натрия, хлорида калия и сульфата магния.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | NaHCO₃ | Выделение газа (CO₂) | Нет изменений |
| 2 | MgSO₄ | Нет изменений | Белый осадок (Mg(OH)₂) |
Вывод:
В склянке №1 находится соляная кислота (HCl), в склянке №2 — гидроксид натрия (NaOH).
Обоснование выбора реактивов:
-
Гидрокарбонат натрия (NaHCO₃):
-
Реагирует с соляной кислотой, выделяя углекислый газ:
HCl + NaHCO₃ → NaCl + H₂O + CO₂↑. -
С гидроксидом натрия реакция не происходит (продукты растворимы).
-
-
Сульфат магния (MgSO₄):
-
Взаимодействует с гидроксидом натрия, образуя белый осадок гидроксида магния:
2NaOH + MgSO₄ → Na₂SO₄ + Mg(OH)₂↓. -
С соляной кислотой реакция не идёт (продукты растворимы).
-
-
Хлорид калия (KCl) не выбран, так как не даёт видимых изменений.
Уравнения реакций для склянки №1 (HCl):
-
Молекулярное:
HCl + NaHCO₃ → NaCl + H₂O + CO₂↑ -
Полное ионное:
H⁺ + Cl⁻ + Na⁺ + HCO₃⁻ → Na⁺ + Cl⁻ + H₂O + CO₂↑ -
Сокращённое ионное:
H⁺ + HCO₃⁻ → H₂O + CO₂↑
Уравнения реакций для склянки №2 (NaOH):
-
Молекулярное:
2NaOH + MgSO₄ → Na₂SO₄ + Mg(OH)₂↓ -
Полное ионное:
2Na⁺ + 2OH⁻ + Mg²⁺ + SO₄²⁻ → 2Na⁺ + SO₄²⁻ + Mg(OH)₂↓ -
Сокращённое ионное:
Mg²⁺ + 2OH⁻ → Mg(OH)₂↓
Примечание:
-
Соляная кислота определена по реакции с NaHCO₃ (выделение газа).
-
Гидроксид натрия идентифицирован по взаимодействию с MgSO₄ (белый осадок).
-
Хлорид калия исключён, так как не позволяет различить вещества.
Номер: B3B494
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами гидроксида натрия и хлорида кальция, а также три реактива: соляная кислота, растворы нитрата меди(II) и карбоната калия.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | Cu(NO₃)₂ | Голубой осадок | Нет изменений |
| 2 | K₂CO₃ | Нет изменений | Белый осадок |
Вывод:
В склянке №1 находится гидроксид натрия (NaOH), в склянке №2 — хлорид кальция (CaCl₂).
Обоснование выбора реактивов:
-
Нитрат меди(II) (Cu(NO₃)₂):
-
Реагирует с гидроксидом натрия, образуя голубой осадок гидроксида меди(II):
Cu(NO₃)₂ + 2NaOH → Cu(OH)₂↓ + 2NaNO₃. -
С хлоридом кальция реакция не происходит (продукты растворимы).
-
-
Карбонат калия (K₂CO₃):
-
Взаимодействует с хлоридом кальция, образуя белый осадок карбоната кальция:
CaCl₂ + K₂CO₃ → CaCO₃↓ + 2KCl. -
С гидроксидом натрия реакция не идёт (продукты растворимы).
-
-
Соляная кислота (HCl) не выбрана, так как не даёт различительных признаков.
Уравнения реакций для склянки №1 (NaOH):
-
Молекулярное:
Cu(NO₃)₂ + 2NaOH → Cu(OH)₂↓ + 2NaNO₃ -
Полное ионное:
Cu²⁺ + 2NO₃⁻ + 2Na⁺ + 2OH⁻ → Cu(OH)₂↓ + 2Na⁺ + 2NO₃⁻ -
Сокращённое ионное:
Cu²⁺ + 2OH⁻ → Cu(OH)₂↓
Уравнения реакций для склянки №2 (CaCl₂):
-
Молекулярное:
CaCl₂ + K₂CO₃ → CaCO₃↓ + 2KCl -
Полное ионное:
Ca²⁺ + 2Cl⁻ + 2K⁺ + CO₃²⁻ → CaCO₃↓ + 2K⁺ + 2Cl⁻ -
Сокращённое ионное:
Ca²⁺ + CO₃²⁻ → CaCO₃↓
Примечание:
-
Гидроксид натрия определён по реакции с Cu(NO₃)₂ (голубой осадок).
-
Хлорид кальция идентифицирован по взаимодействию с K₂CO₃ (белый осадок).
-
Соляная кислота исключена, так как не позволяет различить вещества.
Номер: C86290
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами фосфата натрия и хлорида магния, а также растворы трёх реактивов: сульфата цинка, соляной кислоты и аммиака.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | ZnSO₄ | Белый осадок | Нет изменений |
| 2 | NH₃ (водн.) | Нет изменений | Белый осадок |
Вывод:
В склянке №1 находится фосфат натрия (Na₃PO₄), в склянке №2 — хлорид магния (MgCl₂).
Обоснование выбора реактивов:
-
Сульфат цинка (ZnSO₄):
-
Реагирует с фосфатом натрия, образуя белый осадок фосфата цинка:
3ZnSO₄ + 2Na₃PO₄ → Zn₃(PO₄)₂↓ + 3Na₂SO₄. -
С хлоридом магния реакция не происходит (продукты растворимы).
-
-
Аммиак (NH₃):
-
Взаимодействует с хлоридом магния, образуя белый осадок гидроксида магния:
MgCl₂ + 2NH₃ + 2H₂O → Mg(OH)₂↓ + 2NH₄Cl. -
С фосфатом натрия реакция не идёт (фосфат аммония растворим).
-
-
Соляная кислота (HCl) не выбрана, так как не даёт видимых изменений.
Уравнения реакций для склянки №1 (Na₃PO₄):
-
Молекулярное:
3ZnSO₄ + 2Na₃PO₄ → Zn₃(PO₄)₂↓ + 3Na₂SO₄ -
Полное ионное:
3Zn²⁺ + 3SO₄²⁻ + 6Na⁺ + 2PO₄³⁻ → Zn₃(PO₄)₂↓ + 6Na⁺ + 3SO₄²⁻ -
Сокращённое ионное:
3Zn²⁺ + 2PO₄³⁻ → Zn₃(PO₄)₂↓
Уравнения реакций для склянки №2 (MgCl₂):
-
Молекулярное:
MgCl₂ + 2NH₃ + 2H₂O → Mg(OH)₂↓ + 2NH₄Cl -
Полное ионное:
Mg²⁺ + 2Cl⁻ + 2NH₃ + 2H₂O → Mg(OH)₂↓ + 2NH₄⁺ + 2Cl⁻ -
Сокращённое ионное:
Mg²⁺ + 2NH₃ + 2H₂O → Mg(OH)₂↓ + 2NH₄⁺
Примечание:
-
Фосфат натрия определён по реакции с ZnSO₄ (белый осадок).
-
Хлорид магния идентифицирован по взаимодействию с NH₃ (белый осадок).
-
Соляная кислота исключена, так как не позволяет различить вещества.
Номер: 4235EA
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами нитрата серебра и фосфата калия, а также три реактива: соляная кислота, растворы нитрата калия и нитрата бария.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | HCl | Белый творожистый осадок (AgCl) | Нет изменений |
| 2 | Ba(NO₃)₂ | Нет изменений | Белый осадок (Ba₃(PO₄)₂) |
Вывод:
В склянке №1 находится нитрат серебра (AgNO₃), в склянке №2 — фосфат калия (K₃PO₄).
Обоснование выбора реактивов:
-
Соляная кислота (HCl):
-
Реагирует с нитратом серебра, образуя белый творожистый осадок хлорида серебра:
AgNO₃ + HCl → AgCl↓ + HNO₃. -
С фосфатом калия реакция не происходит (продукты растворимы).
-
-
Нитрат бария (Ba(NO₃)₂):
-
Взаимодействует с фосфатом калия, образуя белый осадок фосфата бария:
3Ba(NO₃)₂ + 2K₃PO₄ → Ba₃(PO₄)₂↓ + 6KNO₃. -
С нитратом серебра реакция не идёт (продукты растворимы).
-
-
Нитрат калия (KNO₃) не выбран, так как не даёт видимых изменений.
Уравнения реакций для склянки №1 (AgNO₃):
-
Молекулярное:
AgNO₃ + HCl → AgCl↓ + HNO₃ -
Полное ионное:
Ag⁺ + NO₃⁻ + H⁺ + Cl⁻ → AgCl↓ + H⁺ + NO₃⁻ -
Сокращённое ионное:
Ag⁺ + Cl⁻ → AgCl↓
Уравнения реакций для склянки №2 (K₃PO₄):
-
Молекулярное:
3Ba(NO₃)₂ + 2K₃PO₄ → Ba₃(PO₄)₂↓ + 6KNO₃ -
Полное ионное:
3Ba²⁺ + 6NO₃⁻ + 6K⁺ + 2PO₄³⁻ → Ba₃(PO₄)₂↓ + 6K⁺ + 6NO₃⁻ -
Сокращённое ионное:
3Ba²⁺ + 2PO₄³⁻ → Ba₃(PO₄)₂↓
Примечание:
-
Нитрат серебра определён по реакции с HCl (белый осадок).
-
Фосфат калия идентифицирован по взаимодействию с Ba(NO₃)₂ (белый осадок).
-
Нитрат калия исключён, так как не участвует в реакциях.
Номер: F1B2EE
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами гидроксида калия и серной кислоты, а также растворы трёх реактивов: хлорида лития, нитрата бария и хлорида железа(III).
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | FeCl₃ | Бурый осадок | Нет изменений |
| 2 | Ba(NO₃)₂ | Нет изменений | Белый осадок |
Вывод:
В склянке №1 находится гидроксид калия (KOH), в склянке №2 — серная кислота (H₂SO₄).
Обоснование выбора реактивов:
-
Хлорид железа(III) (FeCl₃):
-
Реагирует с гидроксидом калия, образуя бурый осадок гидроксида железа(III):
FeCl₃ + 3KOH → Fe(OH)₃↓ + 3KCl. -
С серной кислотой реакция не происходит (продукты растворимы).
-
-
Нитрат бария (Ba(NO₃)₂):
-
Взаимодействует с серной кислотой, образуя белый осадок сульфата бария:
H₂SO₄ + Ba(NO₃)₂ → BaSO₄↓ + 2HNO₃. -
С гидроксидом калия реакция не идёт (продукты растворимы).
-
-
Хлорид лития (LiCl) не выбран, так как не даёт видимых изменений.
Уравнения реакций для склянки №1 (KOH):
-
Молекулярное:
FeCl₃ + 3KOH → Fe(OH)₃↓ + 3KCl -
Полное ионное:
Fe³⁺ + 3Cl⁻ + 3K⁺ + 3OH⁻ → Fe(OH)₃↓ + 3K⁺ + 3Cl⁻ -
Сокращённое ионное:
Fe³⁺ + 3OH⁻ → Fe(OH)₃↓
Уравнения реакций для склянки №2 (H₂SO₄):
-
Молекулярное:
H₂SO₄ + Ba(NO₃)₂ → BaSO₄↓ + 2HNO₃ -
Полное ионное:
2H⁺ + SO₄²⁻ + Ba²⁺ + 2NO₃⁻ → BaSO₄↓ + 2H⁺ + 2NO₃⁻ -
Сокращённое ионное:
Ba²⁺ + SO₄²⁻ → BaSO₄↓
Примечание:
-
Гидроксид калия определён по реакции с FeCl₃ (бурый осадок).
-
Серная кислота идентифицирована по взаимодействию с Ba(NO₃)₂ (белый осадок).
-
Хлорид лития исключён, так как не позволяет различить вещества.
Номер: 18A5EA
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами карбоната калия и хлорида бария, а также три реактива: соляная кислота, растворы сульфата натрия и нитрата натрия.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | HCl | Выделение газа (CO₂) | Нет изменений |
| 2 | Na₂SO₄ | Нет изменений | Белый осадок (BaSO₄) |
Вывод:
В склянке №1 находится карбонат калия (K₂CO₃), в склянке №2 — хлорид бария (BaCl₂).
Обоснование выбора реактивов:
-
Соляная кислота (HCl):
-
Реагирует с карбонатом калия, выделяя углекислый газ:
K₂CO₃ + 2HCl → 2KCl + H₂O + CO₂↑. -
С хлоридом бария реакция не происходит (продукты растворимы).
-
-
Сульфат натрия (Na₂SO₄):
-
Взаимодействует с хлоридом бария, образуя белый осадок сульфата бария:
BaCl₂ + Na₂SO₄ → BaSO₄↓ + 2NaCl. -
С карбонатом калия реакция не идёт (продукты растворимы).
-
-
Нитрат натрия (NaNO₃) не выбран, так как не даёт видимых изменений.
Уравнения реакций для склянки №1 (K₂CO₃):
-
Молекулярное:
K₂CO₃ + 2HCl → 2KCl + H₂O + CO₂↑ -
Полное ионное:
2K⁺ + CO₃²⁻ + 2H⁺ + 2Cl⁻ → 2K⁺ + 2Cl⁻ + H₂O + CO₂↑ -
Сокращённое ионное:
CO₃²⁻ + 2H⁺ → H₂O + CO₂↑
Уравнения реакций для склянки №2 (BaCl₂):
-
Молекулярное:
BaCl₂ + Na₂SO₄ → BaSO₄↓ + 2NaCl -
Полное ионное:
Ba²⁺ + 2Cl⁻ + 2Na⁺ + SO₄²⁻ → BaSO₄↓ + 2Na⁺ + 2Cl⁻ -
Сокращённое ионное:
Ba²⁺ + SO₄²⁻ → BaSO₄↓
Примечание:
-
Карбонат калия определён по реакции с HCl (выделение газа).
-
Хлорид бария идентифицирован по взаимодействию с Na₂SO₄ (белый осадок).
-
Нитрат натрия исключён, так как не участвует в реакциях.
Номер: 74D569
Для проведения эксперимента выданы склянки № 1 и № 2 с соляной кислотой и раствором гидроксида натрия, а также три реактива: растворы карбоната калия, хлорида бария и нитрата кальция.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | K₂CO₃ | Выделение газа (CO₂) | Нет изменений |
| 2 | Ca(NO₃)₂ | Нет изменений | Белый осадок (Ca(OH)₂) |
Вывод:
В склянке №1 находится соляная кислота (HCl), в склянке №2 — гидроксид натрия (NaOH).
Обоснование выбора реактивов:
-
Карбонат калия (K₂CO₃):
-
Реагирует с соляной кислотой, выделяя углекислый газ:
2HCl + K₂CO₃ → 2KCl + H₂O + CO₂↑. -
С гидроксидом натрия реакция не происходит (продукты растворимы).
-
-
Нитрат кальция (Ca(NO₃)₂):
-
Взаимодействует с гидроксидом натрия, образуя белый осадок гидроксида кальция:
Ca(NO₃)₂ + 2NaOH → Ca(OH)₂↓ + 2NaNO₃. -
С соляной кислотой реакция не идёт (продукты растворимы).
-
-
Хлорид бария (BaCl₂) не выбран, так как не даёт различительных признаков.
Уравнения реакций для склянки №1 (HCl):
-
Молекулярное:
2HCl + K₂CO₃ → 2KCl + H₂O + CO₂↑ -
Полное ионное:
2H⁺ + 2Cl⁻ + 2K⁺ + CO₃²⁻ → 2K⁺ + 2Cl⁻ + H₂O + CO₂↑ -
Сокращённое ионное:
2H⁺ + CO₃²⁻ → H₂O + CO₂↑
Уравнения реакций для склянки №2 (NaOH):
-
Молекулярное:
Ca(NO₃)₂ + 2NaOH → Ca(OH)₂↓ + 2NaNO₃ -
Полное ионное:
Ca²⁺ + 2NO₃⁻ + 2Na⁺ + 2OH⁻ → Ca(OH)₂↓ + 2Na⁺ + 2NO₃⁻ -
Сокращённое ионное:
Ca²⁺ + 2OH⁻ → Ca(OH)₂↓
Примечание:
-
Соляная кислота определена по реакции с K₂CO₃ (выделение газа).
-
Гидроксид натрия идентифицирован по взаимодействию с Ca(NO₃)₂ (белый осадок).
-
Хлорид бария исключён, так как не позволяет различить вещества.
Номер: BCE16E
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами серной кислоты и хлорида бария, а также три реактива: медь и растворы фосфата натрия и нитрата кальция.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | Na₃PO₄ | Нет изменений | Белый осадок |
| 2 | Ca(NO₃)₂ | Белый осадок | Нет изменений |
Вывод:
В склянке №1 находится серная кислота (H₂SO₄), в склянке №2 — хлорид бария (BaCl₂).
Обоснование выбора реактивов:
-
Фосфат натрия (Na₃PO₄):
-
Реагирует с хлоридом бария, образуя белый осадок фосфата бария:
3BaCl₂ + 2Na₃PO₄ → Ba₃(PO₄)₂↓ + 6NaCl. -
С серной кислотой реакция не происходит (продукты растворимы).
-
-
Нитрат кальция (Ca(NO₃)₂):
-
Взаимодействует с серной кислотой, образуя белый осадок сульфата кальция:
H₂SO₄ + Ca(NO₃)₂ → CaSO₄↓ + 2HNO₃. -
С хлоридом бария реакция не идёт (продукты растворимы).
-
-
Медь (Cu) не выбрана, так как не реагирует с разбавленной серной кислотой без нагревания.
Уравнения реакций для склянки №1 (H₂SO₄):
-
Молекулярное:
H₂SO₄ + Ca(NO₃)₂ → CaSO₄↓ + 2HNO₃ -
Полное ионное:
2H⁺ + SO₄²⁻ + Ca²⁺ + 2NO₃⁻ → CaSO₄↓ + 2H⁺ + 2NO₃⁻ -
Сокращённое ионное:
Ca²⁺ + SO₄²⁻ → CaSO₄↓
Уравнения реакций для склянки №2 (BaCl₂):
-
Молекулярное:
3BaCl₂ + 2Na₃PO₄ → Ba₃(PO₄)₂↓ + 6NaCl -
Полное ионное:
3Ba²⁺ + 6Cl⁻ + 6Na⁺ + 2PO₄³⁻ → Ba₃(PO₄)₂↓ + 6Na⁺ + 6Cl⁻ -
Сокращённое ионное:
3Ba²⁺ + 2PO₄³⁻ → Ba₃(PO₄)₂↓
Примечание:
-
Серная кислота определена по реакции с Ca(NO₃)₂ (белый осадок).
-
Хлорид бария идентифицирован по взаимодействию с Na₃PO₄ (белый осадок).
-
Медь исключена, так как не позволяет различить вещества.
Номер: 209B6F
Для проведения эксперимента выданы склянки № 1 и № 2 с соляной кислотой и раствором гидроксида натрия, а также растворы трёх реактивов: карбоната калия, сульфата калия и хлорида железа(III).
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | K₂CO₃ | Выделение газа (CO₂) | Нет изменений |
| 2 | FeCl₃ | Нет изменений | Бурый осадок (Fe(OH)₃) |
Вывод:
В склянке №1 находится соляная кислота (HCl), в склянке №2 — гидроксид натрия (NaOH).
Обоснование выбора реактивов:
-
Карбонат калия (K₂CO₃):
-
Реагирует с соляной кислотой, выделяя углекислый газ:
2HCl + K₂CO₃ → 2KCl + H₂O + CO₂↑. -
С гидроксидом натрия реакция не происходит (продукты растворимы).
-
-
Хлорид железа(III) (FeCl₃):
-
Взаимодействует с гидроксидом натрия, образуя бурый осадок гидроксида железа(III):
FeCl₃ + 3NaOH → Fe(OH)₃↓ + 3NaCl. -
С соляной кислотой реакция не идёт (продукты растворимы).
-
-
Сульфат калия (K₂SO₄) не выбран, так как не даёт различительных признаков.
Уравнения реакций для склянки №1 (HCl):
-
Молекулярное:
2HCl + K₂CO₃ → 2KCl + H₂O + CO₂↑ -
Полное ионное:
2H⁺ + 2Cl⁻ + 2K⁺ + CO₃²⁻ → 2K⁺ + 2Cl⁻ + H₂O + CO₂↑ -
Сокращённое ионное:
2H⁺ + CO₃²⁻ → H₂O + CO₂↑
Уравнения реакций для склянки №2 (NaOH):
-
Молекулярное:
FeCl₃ + 3NaOH → Fe(OH)₃↓ + 3NaCl -
Полное ионное:
Fe³⁺ + 3Cl⁻ + 3Na⁺ + 3OH⁻ → Fe(OH)₃↓ + 3Na⁺ + 3Cl⁻ -
Сокращённое ионное:
Fe³⁺ + 3OH⁻ → Fe(OH)₃↓
Примечание:
-
Соляная кислота определена по реакции с K₂CO₃ (выделение газа).
-
Гидроксид натрия идентифицирован по взаимодействию с FeCl₃ (бурый осадок).
-
Сульфат калия исключён, так как не участвует в реакциях.
Номер: 65CF6F
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами гидроксида натрия и сульфата магния, а также три реактива: соляная кислота, растворы хлорида меди(II) и хлорида бария.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | CuCl₂ | Голубой осадок | Нет изменений |
| 2 | BaCl₂ | Нет изменений | Белый осадок |
Вывод:
В склянке №1 находится гидроксид натрия (NaOH), в склянке №2 — сульфат магния (MgSO₄).
Обоснование выбора реактивов:
-
Хлорид меди(II) (CuCl₂):
-
Реагирует с гидроксидом натрия, образуя голубой осадок гидроксида меди(II):
2NaOH + CuCl₂ → Cu(OH)₂↓ + 2NaCl. -
С сульфатом магния реакция не происходит (продукты растворимы).
-
-
Хлорид бария (BaCl₂):
-
Взаимодействует с сульфатом магния, образуя белый осадок сульфата бария:
MgSO₄ + BaCl₂ → BaSO₄↓ + MgCl₂. -
С гидроксидом натрия реакция не идёт (продукты растворимы).
-
-
Соляная кислота (HCl) не выбрана, так как не даёт видимых изменений (реакция нейтрализации с NaOH протекает без осадка/газа).
Уравнения реакций для склянки №1 (NaOH):
-
Молекулярное:
2NaOH + CuCl₂ → Cu(OH)₂↓ + 2NaCl -
Полное ионное:
2Na⁺ + 2OH⁻ + Cu²⁺ + 2Cl⁻ → Cu(OH)₂↓ + 2Na⁺ + 2Cl⁻ -
Сокращённое ионное:
Cu²⁺ + 2OH⁻ → Cu(OH)₂↓
Уравнения реакций для склянки №2 (MgSO₄):
-
Молекулярное:
MgSO₄ + BaCl₂ → BaSO₄↓ + MgCl₂ -
Полное ионное:
Mg²⁺ + SO₄²⁻ + Ba²⁺ + 2Cl⁻ → BaSO₄↓ + Mg²⁺ + 2Cl⁻ -
Сокращённое ионное:
Ba²⁺ + SO₄²⁻ → BaSO₄↓
Примечание:
-
Гидроксид натрия определён по реакции с CuCl₂ (голубой осадок).
-
Сульфат магния идентифицирован по взаимодействию с BaCl₂ (белый осадок).
-
Соляная кислота исключена, так как не позволяет различить вещества.
Номер: 45FA33
Для проведения эксперимента выданы склянки № 1 и № 2 с соляной кислотой и раствором сульфата магния, а также три реактива: цинк, растворы хлорида бария и хлорида меди(II).
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1 — HCl) | Наблюдаемые признаки реакции (№2 — MgSO₄) |
|---|---|---|---|
| 1 | Zn (цинк) | Выделение газа (H₂), растворение цинка | Нет изменений |
| 2 | BaCl₂ | Нет изменений | Белый осадок (BaSO₄) |
Вывод:
В склянке №1 находится соляная кислота (HCl), в склянке №2 — сульфат магния (MgSO₄).
Обоснование выбора реактивов:
-
Цинк (Zn):
-
Реагирует с соляной кислотой, выделяя водород:
Zn + 2HCl → ZnCl₂ + H₂↑. -
С сульфатом магния реакция не идёт (магний активнее цинка).
-
-
Хлорид бария (BaCl₂):
-
Взаимодействует с сульфатом магния, образуя белый осадок сульфата бария:
MgSO₄ + BaCl₂ → BaSO₄↓ + MgCl₂. -
С соляной кислотой реакция не происходит (продукты растворимы).
-
-
Хлорид меди(II) (CuCl₂) не выбран, так как не даёт различительных признаков.
Уравнения реакций для склянки №1 (HCl):
-
Молекулярное:
Zn + 2HCl → ZnCl₂ + H₂↑ -
Полное ионное:
Zn + 2H⁺ + 2Cl⁻ → Zn²⁺ + 2Cl⁻ + H₂↑ -
Сокращённое ионное:
Zn + 2H⁺ → Zn²⁺ + H₂↑
Уравнения реакций для склянки №2 (MgSO₄):
-
Молекулярное:
MgSO₄ + BaCl₂ → BaSO₄↓ + MgCl₂ -
Полное ионное:
Mg²⁺ + SO₄²⁻ + Ba²⁺ + 2Cl⁻ → BaSO₄↓ + Mg²⁺ + 2Cl⁻ -
Сокращённое ионное:
Ba²⁺ + SO₄²⁻ → BaSO₄↓
Примечание:
-
Соляная кислота определена по реакции с Zn (выделение газа).
-
Сульфат магния идентифицирован по взаимодействию с BaCl₂ (белый осадок).
-
Хлорид меди(II) исключён, так как не позволяет различить вещества.
Номер: 4BBB81
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами гидроксида калия и хлорида кальция, а также растворы трёх реактивов: нитрата натрия, карбоната натрия и хлорида алюминия.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | Na₂CO₃ | Нет изменений | Белый осадок (CaCO₃) |
| 2 | AlCl₃ | Белый осадок (Al(OH)₃) | Нет изменений |
Вывод:
В склянке №1 находится гидроксид калия (KOH), в склянке №2 — хлорид кальция (CaCl₂).
Обоснование выбора реактивов:
-
Карбонат натрия (Na₂CO₃):
-
Реагирует с хлоридом кальция, образуя белый осадок карбоната кальция:
CaCl₂ + Na₂CO₃ → CaCO₃↓ + 2NaCl. -
С гидроксидом калия реакция не происходит (продукты растворимы).
-
-
Хлорид алюминия (AlCl₃):
-
Взаимодействует с гидроксидом калия, образуя белый осадок гидроксида алюминия:
AlCl₃ + 3KOH → Al(OH)₃↓ + 3KCl. -
С хлоридом кальция реакция не идёт (продукты растворимы).
-
-
Нитрат натрия (NaNO₃) не выбран, так как не даёт видимых изменений.
Уравнения реакций для склянки №1 (KOH):
-
Молекулярное:
AlCl₃ + 3KOH → Al(OH)₃↓ + 3KCl -
Полное ионное:
Al³⁺ + 3Cl⁻ + 3K⁺ + 3OH⁻ → Al(OH)₃↓ + 3K⁺ + 3Cl⁻ -
Сокращённое ионное:
Al³⁺ + 3OH⁻ → Al(OH)₃↓
Уравнения реакций для склянки №2 (CaCl₂):
-
Молекулярное:
CaCl₂ + Na₂CO₃ → CaCO₃↓ + 2NaCl -
Полное ионное:
Ca²⁺ + 2Cl⁻ + 2Na⁺ + CO₃²⁻ → CaCO₃↓ + 2Na⁺ + 2Cl⁻ -
Сокращённое ионное:
Ca²⁺ + CO₃²⁻ → CaCO₃↓
Примечание:
-
Гидроксид калия определён по реакции с AlCl₃ (белый осадок).
-
Хлорид кальция идентифицирован по взаимодействию с Na₂CO₃ (белый осадок).
-
Нитрат натрия исключён, так как не участвует в реакциях.
Номер: 23478E
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами хлорида магния и хлорида бария, а также растворы трёх реактивов: гидроксида калия, сульфата меди(II) и нитрата серебра.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | KOH | Белый осадок | Нет изменений |
| 2 | CuSO₄ | Нет изменений | Белый осадок |
Вывод:
В склянке №1 находится хлорид магния (MgCl₂), в склянке №2 — хлорид бария (BaCl₂).
Обоснование выбора реактивов:
-
Гидроксид калия (KOH):
-
Реагирует с хлоридом магния, образуя белый осадок гидроксида магния:
MgCl₂ + 2KOH → Mg(OH)₂↓ + 2KCl. -
С хлоридом бария реакция не происходит (Ba(OH)₂ растворим).
-
-
Сульфат меди(II) (CuSO₄):
-
Взаимодействует с хлоридом бария, образуя белый осадок сульфата бария:
BaCl₂ + CuSO₄ → BaSO₄↓ + CuCl₂. -
С хлоридом магния реакция не идёт (сульфат магния растворим).
-
-
Нитрат серебра (AgNO₃) не выбран, так как оба хлорида дают белый осадок AgCl.
Уравнения реакций для склянки №1 (MgCl₂):
-
Молекулярное:
MgCl₂ + 2KOH → Mg(OH)₂↓ + 2KCl -
Полное ионное:
Mg²⁺ + 2Cl⁻ + 2K⁺ + 2OH⁻ → Mg(OH)₂↓ + 2K⁺ + 2Cl⁻ -
Сокращённое ионное:
Mg²⁺ + 2OH⁻ → Mg(OH)₂↓
Уравнения реакций для склянки №2 (BaCl₂):
-
Молекулярное:
BaCl₂ + CuSO₄ → BaSO₄↓ + CuCl₂ -
Полное ионное:
Ba²⁺ + 2Cl⁻ + Cu²⁺ + SO₄²⁻ → BaSO₄↓ + Cu²⁺ + 2Cl⁻ -
Сокращённое ионное:
Ba²⁺ + SO₄²⁻ → BaSO₄↓
Примечание:
-
Хлорид магния определён по реакции с KOH (белый осадок).
-
Хлорид бария идентифицирован по взаимодействию с CuSO₄ (белый осадок).
-
Нитрат серебра исключён, так как не позволяет различить вещества.
Номер: D34487
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами гидроксида калия и сульфата алюминия, а также три реактива: соляная кислота, растворы хлорида железа(III) и фосфата натрия.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1 — KOH) | Наблюдаемые признаки реакции (№2 — Al₂(SO₄)₃) |
|---|---|---|---|
| 1 | FeCl₃ | Бурый осадок (Fe(OH)₃) | Нет изменений |
| 2 | Na₃PO₄ | Нет изменений | Белый осадок (AlPO₄) |
Вывод:
В склянке №1 находится гидроксид калия (KOH), в склянке №2 — сульфат алюминия (Al₂(SO₄)₃).
Обоснование выбора реактивов:
-
Хлорид железа(III) (FeCl₃):
-
Реагирует с гидроксидом калия, образуя бурый осадок гидроксида железа(III):
FeCl₃ + 3KOH → Fe(OH)₃↓ + 3KCl. -
С сульфатом алюминия реакция не происходит (продукты растворимы).
-
-
Фосфат натрия (Na₃PO₄):
-
Взаимодействует с сульфатом алюминия, образуя белый осадок фосфата алюминия:
Al₂(SO₄)₃ + 2Na₃PO₄ → 2AlPO₄↓ + 3Na₂SO₄. -
С гидроксидом калия реакция не идёт (продукты растворимы).
-
-
Соляная кислота (HCl) не выбрана, так как не даёт различительных признаков.
Уравнения реакций для склянки №1 (KOH):
-
Молекулярное:
FeCl₃ + 3KOH → Fe(OH)₃↓ + 3KCl -
Полное ионное:
Fe³⁺ + 3Cl⁻ + 3K⁺ + 3OH⁻ → Fe(OH)₃↓ + 3K⁺ + 3Cl⁻ -
Сокращённое ионное:
Fe³⁺ + 3OH⁻ → Fe(OH)₃↓
Уравнения реакций для склянки №2 (Al₂(SO₄)₃):
-
Молекулярное:
Al₂(SO₄)₃ + 2Na₃PO₄ → 2AlPO₄↓ + 3Na₂SO₄ -
Полное ионное:
2Al³⁺ + 3SO₄²⁻ + 6Na⁺ + 2PO₄³⁻ → 2AlPO₄↓ + 6Na⁺ + 3SO₄²⁻ -
Сокращённое ионное:
Al³⁺ + PO₄³⁻ → AlPO₄↓
Примечание:
-
Гидроксид калия определён по реакции с FeCl₃ (бурый осадок).
-
Сульфат алюминия идентифицирован по взаимодействию с Na₃PO₄ (белый осадок).
-
Соляная кислота исключена, так как не позволяет различить вещества.
Номер: ADAB8F
Для проведения эксперимента выданы склянки № 1 и № 2 с соляной кислотой и раствором гидроксида кальция, а также три реактива: оксид магния, растворы фосфата натрия и хлорида калия.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1 — HCl) | Наблюдаемые признаки реакции (№2 — Ca(OH)₂) |
|---|---|---|---|
| 1 | MgO | Растворение оксида, выделение тепла | Нет изменений |
| 2 | Na₃PO₄ | Нет изменений | Белый осадок (Ca₃(PO₄)₂) |
Вывод:
В склянке №1 находится соляная кислота (HCl), в склянке №2 — гидроксид кальция (Ca(OH)₂).
Обоснование выбора реактивов:
-
Оксид магния (MgO):
-
Реагирует с соляной кислотой, растворяясь с выделением тепла:
MgO + 2HCl → MgCl₂ + H₂O. -
С гидроксидом кальция реакция не происходит (оба вещества — основания).
-
-
Фосфат натрия (Na₃PO₄):
-
Взаимодействует с гидроксидом кальция, образуя белый осадок фосфата кальция:
3Ca(OH)₂ + 2Na₃PO₄ → Ca₃(PO₄)₂↓ + 6NaOH. -
С соляной кислотой реакция не даёт видимых изменений (продукты растворимы).
-
-
Хлорид калия (KCl) не выбран, так как не вызывает реакций с данными веществами.
Уравнения реакций для склянки №1 (HCl):
-
Молекулярное:
MgO + 2HCl → MgCl₂ + H₂O -
Полное ионное:
MgO + 2H⁺ + 2Cl⁻ → Mg²⁺ + 2Cl⁻ + H₂O -
Сокращённое ионное:
MgO + 2H⁺ → Mg²⁺ + H₂O
Уравнения реакций для склянки №2 (Ca(OH)₂):
-
Молекулярное:
3Ca(OH)₂ + 2Na₃PO₄ → Ca₃(PO₄)₂↓ + 6NaOH -
Полное ионное:
3Ca²⁺ + 6OH⁻ + 6Na⁺ + 2PO₄³⁻ → Ca₃(PO₄)₂↓ + 6Na⁺ + 6OH⁻ -
Сокращённое ионное:
3Ca²⁺ + 2PO₄³⁻ → Ca₃(PO₄)₂↓
Примечание:
-
Соляная кислота определена по реакции с MgO (растворение оксида).
-
Гидроксид кальция идентифицирован по взаимодействию с Na₃PO₄ (белый осадок).
-
Хлорид калия исключён, так как не участвует в реакциях.
Номер: 99A18C
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами гидроксида калия и серной кислоты, а также три реактива: оксид магния, растворы хлорида натрия и хлорида аммония (возможно использование лакмусовой бумаги).
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1 — H₂SO₄) | Наблюдаемые признаки реакции (№2 — KOH) |
|---|---|---|---|
| 1 | MgO | Оксид растворяется, выделяется тепло | Нет изменений |
| 2 | NH₄Cl | Нет изменений (лакмус краснеет) | Выделение газа с резким запахом (NH₃), лакмус синеет |
Вывод:
В склянке №1 находится серная кислота (H₂SO₄), в склянке №2 — гидроксид калия (KOH).
Обоснование выбора реактивов:
-
Оксид магния (MgO):
-
Реагирует с серной кислотой, растворяясь с выделением тепла:
MgO + H₂SO₄ → MgSO₄ + H₂O. -
С гидроксидом калия реакция не происходит (оба вещества — основание и щелочь).
-
-
Хлорид аммония (NH₄Cl):
-
Взаимодействует с гидроксидом калия, выделяя аммиак:
NH₄Cl + KOH → KCl + NH₃↑ + H₂O. -
С серной кислотой реакция нейтрализации (без газа):
2NH₄Cl + H₂SO₄ → (NH₄)₂SO₄ + 2HCl.
-
-
Хлорид натрия (NaCl) не выбран, так как не даёт различительных признаков.
Уравнения реакций для склянки №1 (H₂SO₄):
-
Молекулярное:
MgO + H₂SO₄ → MgSO₄ + H₂O -
Полное ионное:
MgO + 2H⁺ + SO₄²⁻ → Mg²⁺ + SO₄²⁻ + H₂O -
Сокращённое ионное:
MgO + 2H⁺ → Mg²⁺ + H₂O
Уравнения реакций для склянки №2 (KOH):
-
Молекулярное:
NH₄Cl + KOH → KCl + NH₃↑ + H₂O -
Полное ионное:
NH₄⁺ + Cl⁻ + K⁺ + OH⁻ → K⁺ + Cl⁻ + NH₃↑ + H₂O -
Сокращённое ионное:
NH₄⁺ + OH⁻ → NH₃↑ + H₂O
Примечание:
-
Серная кислота определена по растворению MgO.
-
Гидроксид калия идентифицирован по выделению аммиака с NH₄Cl.
-
Лакмусовая бумага подтверждает среду: в H₂SO₄ — красная, в KOH — синяя.
Номер: 3CCE84
Для проведения эксперимента выданы склянки № 1 и № 2 с растворами фосфата калия и нитрата бария, а также три реактива: растворы хлорида кальция, серной кислоты и нитрата калия.
Ответ:
Таблица для записи результатов эксперимента:
| № опыта | Реактив | Наблюдаемые признаки реакции (№1) | Наблюдаемые признаки реакции (№2) |
|---|---|---|---|
| 1 | CaCl₂ | Белый осадок | Нет изменений |
| 2 | H₂SO₄ | Нет изменений | Белый осадок |
Вывод:
В склянке №1 находится фосфат калия (K₃PO₄), в склянке №2 — нитрат бария (Ba(NO₃)₂).
Обоснование выбора реактивов:
-
Хлорид кальция (CaCl₂):
-
Реагирует с фосфатом калия, образуя белый осадок фосфата кальция:
3CaCl₂ + 2K₃PO₄ → Ca₃(PO₄)₂↓ + 6KCl. -
С нитратом бария реакция не происходит (продукты растворимы).
-
-
Серная кислота (H₂SO₄):
-
Взаимодействует с нитратом бария, образуя белый осадок сульфата бария:
Ba(NO₃)₂ + H₂SO₄ → BaSO₄↓ + 2HNO₃. -
С фосфатом калия реакция не даёт видимых изменений (продукты растворимы).
-
-
Нитрат калия (KNO₃) не выбран, так как не участвует в реакциях.
Уравнения реакций для склянки №1 (K₃PO₄):
-
Молекулярное:
3CaCl₂ + 2K₃PO₄ → Ca₃(PO₄)₂↓ + 6KCl -
Полное ионное:
3Ca²⁺ + 6Cl⁻ + 6K⁺ + 2PO₄³⁻ → Ca₃(PO₄)₂↓ + 6K⁺ + 6Cl⁻ -
Сокращённое ионное:
3Ca²⁺ + 2PO₄³⁻ → Ca₃(PO₄)₂↓
Уравнения реакций для склянки №2 (Ba(NO₃)₂):
-
Молекулярное:
Ba(NO₃)₂ + H₂SO₄ → BaSO₄↓ + 2HNO₃ -
Полное ионное:
Ba²⁺ + 2NO₃⁻ + 2H⁺ + SO₄²⁻ → BaSO₄↓ + 2H⁺ + 2NO₃⁻ -
Сокращённое ионное:
Ba²⁺ + SO₄²⁻ → BaSO₄↓
Примечание:
-
Фосфат калия определён по реакции с CaCl₂ (белый осадок).
-
Нитрат бария идентифицирован по взаимодействию с H₂SO₄ (белый осадок).
-
Нитрат калия исключён, так как не даёт различительных признаков.
Номер: 85D58F