Все задания из банка ФИПИ в КЭС Молекулярная физика к ЕГЭ по физике с ответами.
2.1 Молекулярная физика 2.1.1 Модели строения газов, жидкостей и твердых тел 2.1.2 Тепловое движение атомов и молекул вещества 2.1.3 Взаимодействие частиц вещества 2.1.4 Диффузия. Броуновское движение 2.1.5 Модель идеального газа в МКТ: молекулы газа движутся хаотически и не взаимодействуют друг с другом 2.1.6 Связь между давлением и средней кинетической энергией поступательного теплового движения молекул идеального газа (основное уравнение МКТ) 2.1.7 Абсолютная температура 2.1.8 Связь температуры газа со средней кинетической энергией поступательного теплового движения его молекул 2.1.9 Уравнение p=nkT 2.1.10 Модель идеального газа в термодинамике 2.1.11 Закон Дальтона для давления смеси разреженных газов 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν) 2.1.13 Насыщенные и ненасыщенные пары. Качественная зависимость плотности и давления насыщенного пара от температуры, их независимость от объёма насыщенного пара 2.1.14 Влажность воздуха 2.1.15 Изменение агрегатных состояний вещества: испарение и конденсация, кипение жидкости 2.1.16 Изменение агрегатных состояний вещества: плавление и кристаллизация 2.1.17 Преобразование энергии в фазовых переходах
Формулы которые потребуются для решения задач
Давление газа можно вычислить по формулам:
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура
R=8,31 – универсальная газовая постоянная,
`p = 2/3*n*E`
E - энергия молекул
p = nkT, где
р — давление,
n — число частиц в единице объёма,
k — Больцмана постоянная,
Т — абсолютная температура.
Внутренняя энергия:
`U = 3/2*ν*RT = (mV^2)/2`,
где
ν – количество вещества,
T - температура газа.
R - Универсальная газовая постоянная
Температура газа по уравнению Менделеева-Клапейрона
`T = (pV)/(νR)`
Запишем первое правило термодинамики:
Q = ΔU + A,
Изобарный процесс:
Работа `A = pΔV`
При изохорном процессе по закону Шарля:
`p_1/p_2 = T_1/T_2`
Температуру переводи в Кельвины +273 к Цельсия
Относительную влажность воздуха можно найти по формуле:
`φ = ρ_1/ρ_2*100%`
Формула перевода показания из Цельсия в Кельвины
T = t + 273, где
T - температура в Кельвинах,
t - исходная температура в Цельсиях
Связь кинетической энергии с температурой
E = 3/2kT,
где T – температура в Кельвинах.
Выбор ответов из предложенных вариантов (32)
Выберите один или несколько правильных ответов.
Относительная влажность воздуха в закрытом сосуде с поршнем равна 40%. Объём сосуда за счёт движения поршня медленно уменьшают при постоянной температуре. В конечном состоянии объём сосуда в 4 раза меньше начального. Выберите из предложенного перечня два утверждения, которые соответствуют результатам проведённых экспериментальных наблюдений, и укажите их номера.
1) При уменьшении объёма сосуда в 2,5 раза на стенках появляется роса.
2) Давление пара в сосуде всё время увеличивается.
3) В конечном и начальном состояниях масса пара в сосуде одинакова.
4) При уменьшении объёма в 2 раза относительная влажность воздуха в сосуде стала равна 80%.
5) В конечном состоянии весь пар в сосуде сконденсировался.
КЭС: 2.1.14 Влажность воздуха
Тип ответа: Выбор ответов из предложенных вариантов
Ответ:
14
При уменьшении объема влага никуда не денется, а значит ее значение пропорционально возрастет уменьшению объема. Получается 40%*2,5=100% При 100 процентной влажности образуется насыщенный пар, при котором начинается выделение росы.
Ну и по той же логике 80 процентов будет влажность при уменьшении объема в 2 раза.
Номер: 430072
Выберите один или несколько правильных ответов.
Выберите все верные утверждения о физических явлениях, величинах и закономерностях. Запишите цифры, под которыми они указаны.
1) Сила Архимеда, действующая на тело, полностью погружённое в жидкость, прямо пропорциональна объёму тела.
2) Теплопередача путём конвекции наблюдается в жидкостях и газах.
3) При последовательном соединении резисторов напряжения на всех резисторах одинаковы.
4) Вследствие интерференции электромагнитных волн происходит перераспределение энергии в пространстве: энергия концентрируется в максимумах и не поступает в минимумы интерференции.
5) Заряды атомных ядер изотопов химического элемента различны, но массы их одинаковы.
КЭС: 1.1 Кинематика
1.2 Динамика
1.3 Статика
1.4 Законы сохранения в механике
1.5 Механические колебания и волны
2.1 Молекулярная физика
2.2 Термодинамика
3.1 Электрическое поле
3.2 Законы постоянного тока
3.3 Магнитное поле
3.4 Электромагнитная индукция
3.5 Электромагнитные колебания и волны
3.6 Оптика
Тип ответа: Выбор ответов из предложенных вариантов
Ответ:
124
1) Да, если тело полностью погрузили, то выталкивающая сила пропорциональна массе жидкости в которую погрузили, в объеме этого тела.
2) Конвекция это перенос вещества, и он возможен в газе и жидкости, в твердых телах конвекции нет.
4) Да, волновые наложения как раз способны образовывать подобные "засветы" и "пятна".
Номер: AA8BDA
Выберите один или несколько правильных ответов.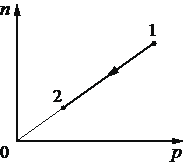
При переводе одноатомного идеального газа из состояния 1 в состояние 2 концентрация молекул n пропорциональна давлению р (см. рисунок). Масса газа в процессе остаётся постоянной.
Из приведённого ниже списка выберите два правильных утверждения, характеризующих процесс 1– 2, и укажите их номера.
1) Средняя кинетическая энергия теплового движения молекул газа остаётся неизменной.
2) Плотность газа уменьшается.
3) Абсолютная температура газа увеличивается.
4) Происходит изотермическое сжатие газа.
5) Среднеквадратическая скорость теплового движения молекул газа увеличивается.
КЭС: 2.1.8 Связь температуры газа со средней кинетической энергией поступательного теплового движения его молекул
Тип ответа: Выбор ответов из предложенных вариантов
Ответ:
12
1 - Процесс линейный и количество молекул пропорционально давлению. (По сути происходит выбирание молекул из объема, падает и их количество и давление так как молекул становится меньше)
2 - Снижение давления говорит о изменение плотности газа, - оно уменьшается.
Номер: 17D9A6
Выберите один или несколько правильных ответов.
При изучении процессов, происходящих с гелием, ученик занёс в таблицу результаты измерения температуры и давления одного и того же количества газа в различных равновесных состояниях. Какие два из утверждений, приведённых ниже, соответствуют результатам этих опытов? Газ считать идеальным.
|
№№ состояния |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
р, кПа |
100 |
90 |
75 |
50 |
55 |
75 |
100 |
|
t, °С |
27 |
27 |
27 |
27 |
57 |
177 |
327 |
1) Объём газа в состоянии 4 в 2 раза меньше объёма газа в состоянии 1.
2) В состояниях 4–7 объём газа был одинаковым.
3) Внутренняя энергия газа в состоянии 6 в 3 раза больше, чем в состоянии 5.
4) При переходе от состояния 2 к состоянию 3 в ходе изотермического процесса газ получал тепло.
5) При переходе от состояния 5 к состоянию 6 в ходе изохорного процесса газ совершал работу.
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Тип ответа: Выбор ответов из предложенных вариантов
Ответ:
24
1) p1v1=p4v4
100*v1=50*v4
100/50=v4/v1
v4/v1 = 2 (больше а два раза, а не меньше!)
То есть если падает давление, то объем занимаемый газом увеличивается, а не уменьшается. НЕТ.
Номер: E27EA7
Выберите один или несколько правильных ответов.
Сосуд разделён на две равные по объёму части пористой неподвижной перегородкой. В левой части сосуда содержится 8 г гелия, в правой − 1 моль аргона. Перегородка может пропускать молекулы гелия и является непроницаемой для молекул аргона. Температура газов одинакова и остаётся постоянной. Выберите два верных утверждения, описывающих состояние газов после установления равновесия в системе.
1) Давление в обеих частях сосуда одинаково.
2) Концентрация гелия и аргона в правой части сосуда одинакова.
3) Внутренняя энергия гелия в сосуде больше, чем внутренняя энергия аргона.
4) Внутренняя энергия гелия в сосуде в конечном состоянии больше, чем в начальном.
5) В правой части сосуда общее число молекул газов в 2 раза меньше, чем в левой части.
КЭС: 2.1.10 Модель идеального газа в термодинамике
Тип ответа: Выбор ответов из предложенных вариантов
Ответ:
23
2) Верно
Перегородка проницаема только для молекул гелия, поэтому в результате установления равновесия парциальное давление гелия в левой части будет равно парциальному давлению гелия в правой части.
Давление газа можно вычислить по формуле:
`p = (νRT)/V`
Парциальные давления гелия в левой и правой части одинаковы, одинаковы температуры и объёмы частей, следовательно, одинаковы и количества вещества гелия в левой и правой частях сосуда, то есть в левой и правой части сосуда будет содержаться по 1 моля гелия.
Найдём связь концентрации и количества вещества:
`n = N/V= (νN_A)/V`
То есть концентрации и количества вещества зависят прямо пропорционально друг от друга, так как справа количество вещества газов одинаково, то и концентрация одинакова.
3) Верно
Внутренняя энергия:
`U = 3/2*ν*RT`,
где
ν – количество вещества,
T – температура газа.
Количество гелия равно:
`ν = (8г)/(4 г/(моль)) = 2 моль`
Так как количество вещества слева больше, то и внутренняя энергия больше.
3) Да.
Номер: 84BDA5
Выберите один или несколько правильных ответов.
Относительная влажность воздуха в закрытом сосуде с поршнем равна 50%. Объём сосуда за счёт движения поршня медленно уменьшают при постоянной температуре. В конечном состоянии объём сосуда в 4 раза меньше начального. Выберите из предложенного перечня два утверждения, которые соответствуют результатам проведённых экспериментальных наблюдений, и укажите их номера.
1) Плотность пара в сосуде всё время увеличивается.
2) Давление пара сначала увеличивается, а затем остаётся постоянным.
3) В конечном состоянии весь пар в сосуде сконденсировался.
4) После уменьшения объёма в 3 раза относительная влажность воздуха в сосуде равна 150%.
5) В конечном состоянии масса пара в сосуде в 2 раза меньше начальной массы пара.
КЭС: 2.1.14 Влажность воздуха
Тип ответа: Выбор ответов из предложенных вариантов
Ответ:
2) Да. Вместе с уменьшением объема происходит повышение температуры и давления, но так как происходит и равномерное охлаждение, то внутренняя энергия остается постоянной, а значит и давление постоянно.
5) Да. При уменьшении объема получили насыщенный пар, пропорциональный объему. Насыщенный пар получился при уменьшении объема в два раза.
50%*2=100%, то есть при дальнейшем сжатии началась конденсация.
Так как объем сжался еще в два раза, относительно 100% влажности, то и объем пара в этом объеме сократился также, а остальное ушло в жидкость.
Номер: 406ECE
Выберите один или несколько правильных ответов.
Твёрдый образец медленно нагревается в плавильной печи так, что подводимая к нему тепловая мощность постоянна. В таблице приведены результаты измерений температуры образца с течением времени.
|
Время, мин. |
0 |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
|
Температура, °С |
305 |
314 |
323 |
327 |
327 |
327 |
329 |
334 |
Выберите из предложенного перечня два утверждения, которые соответствуют результатам проведённого экспериментального исследования, и укажите их номера.
1) Температура плавления вещества в данных условиях равна 329 °С.
2) Через 18 мин. после начала измерений образец частично расплавился.
3) Теплоёмкость вещества, из которого изготовлен образец, в жидком и твёрдом состояниях одинакова.
4) Через 30 мин. после начала измерений образец не расплавился.
5) Процесс плавления образца продолжался менее 20 мин.
КЭС: 2.1.16 Изменение агрегатных состояний вещества: плавление и кристаллизация
Тип ответа: Выбор ответов из предложенных вариантов
Ответ:
25
1) Нет, 327.
2) Да, начало процесса плавления началось на 15 минуте, закончилось к 30.
3) Нет, так как температура до и после плавления за одно и тоже время менялась по разному.
4) Нет, расплавился уже.
5) Само собой процесс плавления 30-15 меньше 20 мин.
Номер: D50CE4
Выберите один или несколько правильных ответов.
В понедельник и вторник температура воздуха была одинаковой. Парциальное давление водяного пара в атмосфере в понедельник было меньше, чем во вторник.
Из приведённого ниже списка выберите два правильных утверждения и укажите их номера.
1) Масса водяных паров, содержащихся с 1 м3 воздуха в понедельник была больше, чем во вторник
2) Относительная влажность воздуха в понедельник была меньше, чем во вторник
3) Концентрация молекул водяного пара в воздухе в понедельник и вторник была одинаковой
4) Давление насыщенных водяных паров в понедельник было больше, чем во вторник
5) Плотность водяных паров, содержащихся в воздухе в понедельник была меньше, чем во вторник
КЭС: 2.1.14 Влажность воздуха
Тип ответа: Выбор ответов из предложенных вариантов
Ответ:
25
1) Нет, так как давление было ниже, значит паров было меньше.
2) Да. Если давление пара в понедельник меньше, а температура одинаковая, то можно говорить о меньшем атмосферном давлении, а значит о снижении влажности
3) Нет, так как речь идет о разном давлении.
4) Нет, так как давление было ниже, значит паров было меньше.
5)Да. То есть опять же плотность водяных паров падает из за пониженного давления, что сходится с пунктом 5.
Номер: DE8B36
Выберите один или несколько правильных ответов.
При изучении процессов, происходящих с гелием, ученик занёс в таблицу результаты измерения температуры и давления одного и того же количества газа в различных равновесных состояниях. Какие два из утверждений, приведённых ниже, соответствуют результатам этих опытов? Газ считать идеальным.
|
№№ состояния |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
р, кПа |
100 |
90 |
75 |
50 |
55 |
75 |
100 |
|
t, °С |
27 |
27 |
27 |
27 |
57 |
177 |
327 |
1) Объём газа в состоянии 4 в 2 раза больше объёма газа в состоянии 1.
2) В состояниях 1–3 объём газа был одинаковым.
3) Внутренняя энергия газа в состоянии 6 в 3 раза больше, чем в состоянии 5.
4) При переходе от состояния 5 к состоянию 6 в ходе изохорного процесса газ отдавал тепло.
5) При переходе от состояния 2 к состоянию 3 в ходе изотермического процесса газ совершал положительную работу.
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Тип ответа: Выбор ответов из предложенных вариантов
Ответ:
1)
Да.
Процесс изотермический T = const.
p1V1=p4V4
100*V1=50*V4
100/50 = V4/V1
2V1=V4
2) Нет.
Внутренняя энергия:
`U = 3/2*ν*RT`,
где
ν – количество вещества,
T – температура газа.
R - Универсальная газовая постоянная.
То есть энергия могла измениться за счет температуры, но там разница не в 3 раза.
3) Нет. Изохорный процесс предполагает неизменный объем, так как давление повысилось, при неизменном объеме, то можно было сделать это только путем нагревания, придавая дополнительную энергию молекулам газа.
4) Да. Произошло снижение давления, значит газ должен был отдать тепло
Номер: B3ABFA
Выберите один или несколько правильных ответов.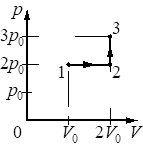
Идеальный газ переводят из состояния 1 в состояние 3 так, как показано на графике зависимости давления р газа от объёма V. Масса газа в процессе не изменяется. Из приведённого ниже списка выберите все верные утверждения относительно процессов, показанных
на графике.
1) Абсолютная температура газа максимальна в состоянии 1.
2) В процессе 1–2 абсолютная температура газа изобарно увеличилась в 2 раза.
3) В процессе 2–3 абсолютная температура газа изохорно увеличилась в 1,5 раза.
4) Плотность газа минимальна в состоянии 1.
5) В ходе процесса 1–2–3 среднеквадратичная скорость теплового движения молекул газа увеличилась в 6 раз.
КЭС: 2.1 Молекулярная физика
Тип ответа: Выбор ответов из предложенных вариантов
Ответ:
23
1) Нет. 1-2 Произошло изменение объема в два раза, но при этом давление не упало, значит газ подогревали. Так как на участке 2-3 происходил явный нагрев ибо давление поднимали без изменения объема.
2) Да. Произошло изменение объема в два раза, но при этом давление не упало, значит газ подогревали также как и менялся объем.
3) Да. Так как на участке 2-3 происходил явный нагрев ибо давление поднимали без изменения объема. судя по числам 3/2=1,5 давление увеличилось в 1,5 раза, значит температура также пропорциональная была увеличена.
4) В меньшем объеме при равном количестве вещества не может быть чтобы была минимальная плотность.
5) Нет. 1-2 Произошло изменение объема в два раза, но при этом давление не упало, значит газ подогревали. Так как на участке 2-3 происходил явный нагрев ибо давление поднимали без изменения объема.
Номер: 499909
Выберите один или несколько правильных ответов.
С одноатомным идеальным газом происходит циклический процесс 1−2−3−4−1, pV-диаграмма которого представлена на рисунке. Максимальная температура, достигаемая газом в этом процессе, составляет 400 К. Масса газа постоянна. На основании анализа этого циклического процесса выберите все верные утверждения.
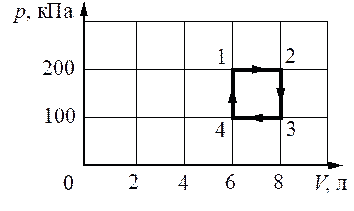
1) Работа, совершённая над газом при его изобарном сжатии, равна 100 Дж.
2) В процессе 2–3 газ получает положительное количество теплоты.
3) Работа газа за цикл равна 200 Дж.
4) Минимальная температура в циклическом процессе равна 200 К.
5) Количество теплоты, переданное газу при изохорном нагревании, равно 900 Дж.
КЭС: 2.1 Молекулярная физика
Тип ответа: Выбор ответов из предложенных вариантов
Ответ:
35
1) Нет. Изобарное сжатие 3-4, работу можно найти как площадь под графиком расширения:
`A_(34) = 100 ⋅ 10^3 ⋅ (8 − 6) ⋅ 10^(−3) = 200` Дж
2) Нет. Газ остывает.
3) Нет, Так как даже от 3 до 4 состояния уже потрачено 200 Дж
4) Нет.
Из уравнения Менделеева-Клапейрона минимальная температура будет в точке 4, при этом
`T_4 = (p_4V_4)/(νR)`
`T_2 = (p_2V_2)/(νR)`,
Тогда
`T4 = (p_4V_4)/(p_2V_2) * T2 = (100*10^3*6*10-3)/(200 ⋅ 10^3 ⋅ 8 ⋅ 10^(−3)) = 150` К
5) Да. Такой процесс наблюдается на участке 4-1. Запишем первый закон термодинамики для этого участка:
Q = ΔU + A,
Внутренняя энергия:
`U = 3/2*ν*RT`,
уравнения Менделеева-Клапейрона
`T = (pV)/(νR)`
Тогда
`U = 3/2*ν*R*(pV)/(νR)=(3pV)/2`
`ΔU_(12) = (3p_1V_1)/2-(3p_4V_4)/2=(3*200*6)/2-(3*100*6)/2 =900`Дж
Номер: D43001
Выберите один или несколько правильных ответов.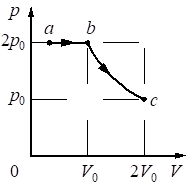
В цилиндрическом сосуде, закрытом подвижным поршнем, находится водяной пар и капля воды. С паром в сосуде при постоянной температуре происходит процесс a→b→c, pV-диаграмма которого представлена на рисунке.
Из приведённого ниже списка выберите все верные утверждения относительно этого процесса.
1) В процессе a → b масса капли воды уменьшается.
2) В процессе b → c от пара отводится положительное количество теплоты.
3) В состоянии a водяной пар является ненасыщенным.
4) В процессе a → b внутренняя энергия пара постоянна.
5) В процессе b → c плотность пара уменьшается.
КЭС: 2.1.13 Насыщенные и ненасыщенные пары. Качественная зависимость плотности и давления насыщенного пара от температуры, их независимость от объёма насыщенного пара
Тип ответа: Выбор ответов из предложенных вариантов
Ответ:
15
1) Да. Объем увеличиваем, влажность в объеме падает, значит для поддержания влажности должна переходить в пар. t = const
2) Нет. Объем увеличиваем, давление падает, падает и температура, то есть здесь поглощается тепло.
3) Нет. Так как давление не падает, если это происходит при изотермическом процессе, то может происходить только за счет пополнения пара водой. Значит пар был насыщен если давление постоянно.
4) Нет. Внутренняя энергия:
`U = 3/2*ν*RT`
Из формулы. Происходит изменение объема, значит происходит и изменение энергии
5) Да. Происходит увеличение объема, плотность пара становится ниже.
Номер: 2854B6
Выберите один или несколько правильных ответов.
В среду и четверг температура воздуха была одинаковой. Парциальное давление водяного пара в атмосфере в среду было больше, чем в четверг.
Из приведённого ниже списка выберите все верные утверждения.
1) Плотность водяных паров, содержащихся в воздухе, в среду была меньше, чем в четверг.
2) Относительная влажность воздуха в среду была меньше, чем в четверг.
3) Концентрация молекул водяного пара в воздухе в среду была больше, чем в четверг.
4) Давление насыщенных водяных паров в среду и четверг было одинаковым.
5) Масса водяных паров, содержащихся в 1 м3 воздуха, в среду была меньше, чем в четверг.
КЭС: 2.1.14 Влажность воздуха
Тип ответа: Выбор ответов из предложенных вариантов
Ответ:
1) Нет. Больше, так как давление больше.
2) Нет. Больше, так как давление больше.
3) Да. Так как давление выше, а температура одна и та же, то влажность тоже выше.
4) Да. Насыщенные пары при одинаковых температурах имеют одинаковое давление.
5) Нет. Больше, так как давление больше
Номер: 3DD9BD
Выберите один или несколько правильных ответов.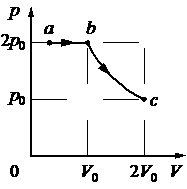
В цилиндрическом сосуде, закрытом подвижным поршнем, находится водяной пар и капля воды.
С паром в сосуде при постоянной температуре провели процесс a→b→c, pV-диаграмма которого представлена на рисунке. Из приведённого ниже списка выберите два правильных утверждения относительно проведённого процесса.
1) На участке b→c масса пара уменьшается.
2) На участке a→b к веществу в сосуде подводится положительное количество теплоты.
3) В точке c водяной пар является насыщенным.
4) На участке a→b внутренняя энергия капли уменьшается.
5) На участке b→c внутренняя энергия пара уменьшается.
КЭС: 2.1.13 Насыщенные и ненасыщенные пары. Качественная зависимость плотности и давления насыщенного пара от температуры, их независимость от объёма насыщенного пара
Тип ответа: Выбор ответов из предложенных вариантов
Ответ:
1) Нет. Масса пара увеличивается, так как давление остается тоже при увеличении объема.
2) Да. При увеличении объема не падает давление, значит в процессе происходит поглощение теплоты.
3) Нет. Происходит падения давления, нет прямой удержания как на участке a-b, значит нет насыщенного пара
4) Да. Масса пара увеличивается, так как давление остается тоже при увеличении объема. Масса капли уменьшается и энергия тоже.
5) Нет. С увеличением объема падает давление, значит идет снижения энергии пара.
Номер: AF151F
Выберите один или несколько правильных ответов.
В среду и четверг температура воздуха была одинаковой. Парциальное давление водяного пара в атмосфере в среду было меньше, чем в четверг.
Из приведённого ниже списка выберите два правильных утверждения по поводу этой ситуации.
1) Плотность водяных паров, содержащихся в воздухе, в среду и четверг была одинаковой.
2) Относительная влажность воздуха в среду была меньше, чем в четверг.
3) Концентрация молекул водяного пара в воздухе в среду была меньше, чем в четверг.
4) Давление насыщенных водяных паров в среду было больше, чем в четверг.
5) Масса водяных паров, содержащихся в 1 м3 воздуха, в среду была больше, чем в четверг.
КЭС: 2.1.14 Влажность воздуха
Тип ответа: Выбор ответов из предложенных вариантов
Ответ:
1) Нет. Давление разное, значит и плотность паров при одной Т разная.
2) Да. Давление разное, значит и плотность паров при одной Т разная. При большем давлении объем влаги в паре больше.
3) Да. Давление разное, значит и плотность паров при одной Т разная. При меньшем давлении объем влаги в паре меньше.
4) Нет. Давление разное, значит и плотность паров при одной Т разная. При меньшем давлении объем влаги в паре меньше.
5) Нет. Давление разное, значит и плотность паров при одной Т разная. При меньшем давлении объем влаги в паре меньше.
Номер: B3322A
Выберите один или несколько правильных ответов.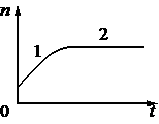
В стеклянную колбу налили немного воды и герметично закрыли её пробкой. Вода постепенно испарялась. На рисунке показан график изменения со временем t концентрации n молекул водяного пара внутри колбы. Температура в колбе в течение всего времени проведения опыта оставалась постоянной.
В конце опыта в колбе ещё оставалась вода. Из приведённого ниже списка выберите два правильных утверждения относительно описанного процесса.
1) На участке 1 плотность водяных паров уменьшалась.
2) На участке 2 давление водяных паров не менялось.
3) На участке 1 водяной пар ненасыщенный, а на участке 2 насыщенный.
4) На участке 1 давление водяных паров уменьшалось.
5) На участке 2 плотность водяных паров увеличивалась.
КЭС: 2.1.13 Насыщенные и ненасыщенные пары. Качественная зависимость плотности и давления насыщенного пара от температуры, их независимость от объёма насыщенного пара
Тип ответа: Выбор ответов из предложенных вариантов
Ответ:
23
Получилось так. Мы ограничили объем закрыв пробку, водяные пары начали выделяться в объем, до тех пор пока пар не стал насыщенный. Потом процесс выделения остановился. Сколько-то осталось в воде, сколько-то летает в виде 100 процентного насыщенного пара в этом закрытом объеме.
Номер: 4DBED7
Выберите один или несколько правильных ответов.
Герметичный теплоизолированный сосуд разделили неподвижной перегородкой, способной проводить тепло, на две равные части. В первую часть сосуда поместили некоторое количества аргона при температуре 328 К, а во вторую – такое же количество аргона при температуре 15 °С.
Считая, что теплоёмкость сосуда пренебрежимо мала, выберите два утверждения, которые верно отражают изменения, происходящие с аргоном при переходе к тепловому равновесию.
1) Температура газа во второй части сосуда повысилась.
2) Внутренняя энергия газа в первой части сосуда увеличилась.
3) При теплообмене газ в первой части сосуда отдавал теплоту, а газ во второй части сосуда её получал.
4) Через достаточно большой промежуток времени температура газов в обеих частях сосуда стала одинаковой и равной 25 °С.
5) В результате теплообмена газ в первой части сосуда совершил положительную работу.
КЭС: 2.1 Молекулярная физика
Тип ответа: Выбор ответов из предложенных вариантов
Ответ:
13
Первая часть с нагретым аргоном передавала тепловую энергию второй части. В итоге давление и энергия в первой части падали, во второй повышались до установления средней температуры между сторонами. 328 К ≈ 54,8 градуса.
(54,8+15)/2≈35ºС будет средняя Т
Ну и газ не совершал никакой работы, так как не было изменения давления! Была обычная теплопередача.
Номер: 0443DE
Выберите один или несколько правильных ответов.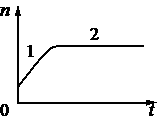
В сосуде под поршнем находятся только пары аммиака. Поршень медленно и равномерно опускают, уменьшая объём сосуда. Температура в сосуде поддерживается постоянной. На рисунке показан график изменения со временем t концентрации n молекул паров аммиака внутри сосуда. Из приведённого ниже списка выберите два правильных утверждения относительно описанного процесса.
1) На участке 1 плотность паров аммиака уменьшалась.
2) На участке 2 давление паров аммиака увеличивалось.
3) На участке 1 пар аммиака ненасыщенный, а на участке 2 насыщенный.
4) На участке 1 давление паров аммиака увеличивалось.
5) На участке 2 плотность паров аммиака уменьшалась.
КЭС: 2.1.13 Насыщенные и ненасыщенные пары. Качественная зависимость плотности и давления насыщенного пара от температуры, их независимость от объёма насыщенного пара
Тип ответа: Выбор ответов из предложенных вариантов
Ответ:
34
Получилось так. Мы уменьшаем объем, пары начали выделяться в объем за счет увеличения давления, до тех пор пока пар не стал насыщенный, а далее переходить в конденсат. Потом процесс выделения в пар остановился. Так как сколько-то летает в виде 100 процентного насыщенного пара все остальное при увеличении давления конденсируется.
Номер: 8A43D2
Выберите один или несколько правильных ответов.
В сосуде под поршнем при комнатной температуре долгое время находится вода и водяной пар. Масса воды равна массе пара. Объём сосуда медленно изотермически увеличивают в 3 раза.
Выберите два утверждения, которые верно отражают результаты этого опыта.
1) Масса пара в сосуде не изменяется.
2) В конечном состоянии давление пара в сосуде в 3 раза меньше первоначального.
3) Давление пара сначала было постоянным, а затем стало уменьшаться.
4) Плотность пара в начале и конце опыта одинакова.
5) Концентрация пара в сосуде в начале опыта больше, чем в конце опыта.
КЭС: 2.1.13 Насыщенные и ненасыщенные пары. Качественная зависимость плотности и давления насыщенного пара от температуры, их независимость от объёма насыщенного пара
Тип ответа: Выбор ответов из предложенных вариантов
Ответ:
35
1) Нет. Масса пара меняется, так как его становится больше в большем объеме при той же температуре.
2) Нет. Давление пара ниже, так как объем увеличился в три раза, а на пар был только один объем излишней воды, значит 1 объем пошел на снижение давления.
3) Да. Увеличивая объем мы понижаем давление пара, но после оно стабилизируется путем испарения жидкости из воды. Однако так как объем увеличился втрое, то давление пара стало меньше.
4) Нет. Так как объем более 2, то получилось, что через 2 объема пар был насыщенный при дальнейшем расширении объема стал становиться ненасыщенным.
Номер: 12DC5B
Выберите один или несколько правильных ответов.
Сосуд разделён на две равные по объёму части пористой неподвижной перегородкой. В левой части сосуда содержится 4 моль гелия, в правой – 40 г аргона. Перегородка может пропускать молекулы гелия и является непроницаемой для молекул аргона. Температура газов одинаковая и остаётся постоянной.
Выберите два верных утверждения, описывающих состояние газов после установления равновесия в системе.
1) Концентрация гелия в правой части сосуда в 2 раза меньше, чем аргона.
2) Отношение давления газов в правой части к давлению газа в левой части равно 1,5.
3) В правой части сосуда общее число молекул газов меньше, чем в левой части.
4) Внутренняя энергия гелия и аргона одинакова.
5) В результате установления равновесия давление в правой части увеличилось в 3 раза.
КЭС: 2.1.10 Модель идеального газа в термодинамике
Тип ответа: Выбор ответов из предложенных вариантов
Ответ:
25
2) Верно
Перегородка проницаема только для молекул гелия, поэтому в результате установления равновесия парциальное давление гелия в левой части будет равно парциальному давлению гелия в правой части.
Давление газа можно вычислить по формуле:
`p = (νRT)/V`
Парциальные давления гелия в левой и правой части одинаковы, одинаковы температуры и объёмы частей, следовательно, одинаковы и количества вещества гелия в левой и правой частях сосуда, то есть в левой и правой части сосуда будет содержаться по 1 моля гелия.
Найдём связь концентрации и количества вещества:
`n = N/V= (νN_A)/V`
То есть концентрации и количества вещества зависят прямо пропорционально друг от друга, так как справа количество вещества газов одинаково, то и концентрация одинакова.
5) Верно
Найдём отношение конечного давления в правой части сосуда к начальному давлению в правой части сосуда:
`(p_k)/(p_н)= (ν_(г.п.)+νNe)/(νNe) = (2 моль+1 моль)/(1 моль) =3`
Номер: C02CAB
Выберите один или несколько правильных ответов.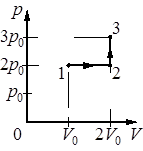
Идеальный газ переводят из состояния 1 в состояние 3 так, как показано на графике зависимости давления газа р от объёма V. Масса газа в процессе не изменяется. Из приведённого ниже списка выберите два правильных утверждения, характеризующих отражённые на графике процессы.
1) Абсолютная температура газа максимальна в состоянии 3.
2) В процессе 1–2 абсолютная температура газа изобарно увеличилась в 2 раза.
3) В процессе 2–3 абсолютная температура газа изохорно уменьшилась в 1,5 раза.
4) Плотность газа минимальна в состоянии 1.
5) В ходе процесса 1–2–3 среднеквадратичная скорость теплового движения молекул газа увеличивается в 3 раза.
КЭС: 2.1 Молекулярная физика
Тип ответа: Выбор ответов из предложенных вариантов
Ответ:
12
1) Да. Увеличивая объем мы не потеряли в давлении, значит газ нагревали между 1-2, потом еще и увеличили давление, значит газ еще стал обладать повышенной энергией, то есть нагрелся.
2) Да. Изобарно увеличилась в два раза, ведь давление осталось прежнее при увеличении объема только благодаря этому.
3) Нет. У нас наоборот произошло изохорное повышение температуры в 1,5 раза.
4) Нет. В точке один мы имеем меньший объем и давление 2р, при этом такое давление в точке 2 с большим объемом, значит там газ более разряженный.
5) Нет. Кинетическая энергия
`Eк = 3/2 kT`
Связь с энергией молекулы
`(m_0*v^2)/2 = 3/2 kT`
Отсюда
v2 ∼ T
v ∼ T
Температура в процессе 1-2-3 увеличилась в 3 раза, значит средняя квадратичная скорость увеличилась в √3 раз
Номер: DFF8CD
Выберите один или несколько правильных ответов.
На рисунке приведены графики двух изотермических процессов, проводимых с одной и той же массой одноатомного идеального газа.
Выберите два верных утверждения о процессах, происходящих с газом.
1) Процесс 1 идёт при более высокой температуре.
2) В процессе 1 внутренняя энергия газа увеличивается.
3) Оба процесса идут при одной и той же температуре.
4) Процесс 2 идёт при более высокой температуре.
5) В процессе 1 объём газа увеличивается.
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Тип ответа: Выбор ответов из предложенных вариантов
Ответ:
15
Что происходит. У нас идет увеличение объема и снижение давления для 1 и 2 процесса.
Так как 1 процесс смещен вправо, то он происходит при большей температуре. Но в итоге процессы идентичные, у обоих происходит потеря температуры, снижение внутренней энергии газа.
1) Да.
2) Нет.
3) Нет.
4) Нет.
5) Да.
Номер: 6A61CB
Выберите один или несколько правильных ответов.
Стальную кастрюлю, наполовину заполненную водой, поставили на плиту, закрыли лёгкой крышкой и стали нагревать воду до кипения. Атмосферное давление составляет 760 мм рт. ст.
Выберите все верные утверждения, описывающие характеристики воды, водяного пара и кастрюли при нагревании и кипении воды.
1) Относительная влажность воздуха под крышкой в процессе нагревания воды уменьшается.
2) Внутренняя энергия водяного пара в кастрюле в процессе нагревания воды увеличивается.
3) При нагревании воды выше 80 ºС, когда схлопываются образующиеся пузырьки, давление водяных паров постепенно уменьшается.
4) Температура дна кастрюли вблизи границы с водой при кипении немного превышает 100 ºС.
5) Плотность насыщенных водяных паров над поверхностью воды в процессе её нагревания до температуры кипения увеличивается.
КЭС: 2.1.15 Изменение агрегатных состояний вещества: испарение и конденсация, кипение жидкости
Тип ответа: Выбор ответов из предложенных вариантов
Ответ:
245
1) Нет. Она повышается.
2) Да, из-за повышения давления и плотности пара.
3) Нет.
4) Да. Нагрев идет сразу в воду и отводится от дна парами.
5) Да. Из-за повышения давления и плотности пара.
Номер: 055098
Выберите один или несколько правильных ответов.
Стальную кастрюлю, наполовину наполненную водой и закрытую лёгкой крышкой, поставили на огонь, воду в ней довели до кипения и кипятили в течение некоторого времени. Атмосферное давление в помещении составляло 760 мм рт. ст.
Выберите все верные утверждения, описывающие характеристики воды, водяного пара и кастрюли в процессе кипения.
1) Относительная влажность воздуха под крышкой в процессе кипения воды уменьшается.
2) Температура воды в кастрюле в процессе кипения увеличивается.
3) Парциальное давление водяных паров под крышкой увеличивается в ходе нагревания воды до температуры кипения.
4) Температура в толще дна кастрюли в ходе кипения не превышает 90 ºС.
5) Плотность насыщенных водяных паров над поверхностью воды при кипении остаётся постоянной.
КЭС: 2.1.15 Изменение агрегатных состояний вещества: испарение и конденсация, кипение жидкости
Тип ответа: Выбор ответов из предложенных вариантов
Ответ:
35
1) Нет. Увеличивается.
2) Нет. Остается постоянной. Лишняя энергия улетает вместе с паром.
3) Да, а потом остается постоянной.
4) Нет. Превышает.
5) Да. Пары поступают из воды.
Номер: B9A49E
Выберите один или несколько правильных ответов.
Объём сосуда, содержащего 1 моль неона, уменьшили вдвое и добавили в сосуд 1 моль гелия. Температура в сосуде поддерживается постоянной. Выберите из предложенного списка два утверждения, которые верно отражают результаты этого опыта.
1) Концентрации неона и гелия в сосуде одинаковы.
2) Внутренняя энергия неона уменьшилась.
3) Плотность газа в сосуде не изменилась.
4) Давление в сосуде увеличилось.
5) Парциальное давление неона не изменилось.
КЭС: 2.1.11 Закон Дальтона для давления смеси разреженных газов
Тип ответа: Выбор ответов из предложенных вариантов
Ответ:
14
1) Да. По одному молю.
2) Нет. Увеличилась.
3) Нет. Изменилась, так как изменили объем.
4) Да. Так как изменили объем.
5) Нет. Изменилось. Изменили объем, добавили другой газ.
Номер: 2CEC9C
Выберите один или несколько правильных ответов.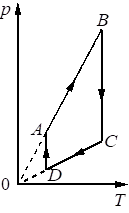
На рисунке в координатах р–Т, где р – давление газа, Т – абсолютная температура газа, показан график циклического процесса, проведённого с одноатомным идеальным газом. Количество вещества газа постоянно.
Из приведённого ниже списка выберите все верные утверждения, характеризующие процессы на графике.
В процессе СD работа газа равна нулю.
В процессе DA газ изотермически расширяется.
В процессе АВ газ получает положительное количество теплоты.
В процессе ВС внутренняя энергия газа остаётся неизменной.
Газ за цикл совершает работу, равную нулю.
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Тип ответа: Выбор ответов из предложенных вариантов
Ответ:
Верные утверждения:
В процессе СD работа газа равна нулю.
В процессе АВ газ получает положительное количество теплоты.
В процессе ВС внутренняя энергия газа остаётся неизменной.
Номер: C5CA95
Выберите один или несколько правильных ответов.
В жёстком герметичном сосуде объёмом 1 м3 при температуре 289 К длительное время находился влажный воздух и 10 г воды. Сосуд медленно нагрели до температуры 298 К. Пользуясь таблицей плотности насыщенных паров воды, выберите все верные утверждения о результатах этого опыта.
|
t, °С |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
|
rнп,×10–2 кг/м3 |
1,36 |
1,45 |
1,54 |
1,63 |
1,73 |
1,83 |
1,94 |
2,06 |
2,18 |
2,30 |
1) При температуре 23°С влажность воздуха в сосуде была равна 48,5%.
2) В течение всего опыта в сосуде находилась вода в жидком состоянии.
3) Так как объём сосуда не изменялся, давление влажного воздуха увеличивалось пропорционально его температуре.
4) В начальном состоянии при температуре 289К пар в сосуде был насыщенный.
5) Парциальное давление сухого воздуха в сосуде не изменялось.
КЭС: 2.1.14 Влажность воздуха
Тип ответа: Выбор ответов из предложенных вариантов
Ответ:
24
1) Неверно
Найдем, испарится ли вся вода в процессе. Пусть это не так, то масса водяного пара равна:
`m = ρ_(нп)V`,
где V – объём сосуда.
Тогда масса испаренной воды:
`Δm = Δ ρV = (2,06 − 1,36) * 10^(-2) (кг)/(м^3) ⋅ 1 м^3 = 7` г,
так как первоначально в сосуде было 10 г воды, то вся вода не испарилась, значит, пар остался насыщенным и относительная влажность равна 100%
2) Верно
Так как вся вода не испарилась в течении опыта, то пар все время является насыщенным.
3) Неверно
Пар в сосуде был насыщенным, следовательно, шел процесс испарения, поэтому давление влажного воздуха не было прямо пропорционально его температуре.
4) Верно
Так как вначале опыта в сосуда длительное время находилась вода и пар, то установилось равновесие и пар стал насыщенным
5) Неверно
Давление сухого воздуха изохорически увеличивалось с ростом температуры по закону Шарля
p/T = const
Номер: 6ECE95
Выберите один или несколько правильных ответов.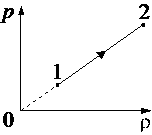
При переводе идеального газа из состояния 1 в состояние 2 давление р газа пропорционально его плотности ρ (см. рисунок). Масса газа в процессе остаётся постоянной.
Из приведённого ниже списка выберите два правильных утверждения, характеризующих
процесс 1– 2.
1) Средняя кинетическая энергия теплового движения молекул газа уменьшается.
2) Концентрация молекул газа уменьшается.
3) Абсолютная температура газа остаётся неизменной.
4) Происходит изотермическое сжатие газа.
5) Среднеквадратичная скорость теплового движения молекул газа увеличивается.
КЭС: 2.1.8 Связь температуры газа со средней кинетической энергией поступательного теплового движения его молекул
Тип ответа: Выбор ответов из предложенных вариантов
Ответ:
34
Повышая плотность мы линейно изменяем и давление. Это говорит о том, что нет второй составляющей которая меняла бы уже зависимость квадратично, а значит температуру не меняли, процесс изотермический.
Номер: 849B99
Выберите один или несколько правильных ответов.
С идеальным газом происходит циклический процесс 1−2−3−4−1, pV-диаграмма которого представлена на рисунке. Максимальная температура, достигаемая газом в этом процессе, составляет 400 К.
На основании анализа этого циклического процесса выберите два верных утверждения.
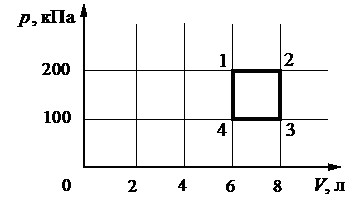
1) Работа газа при его изобарном расширении равна 200 Дж.
2) Количество вещества газа, участвующего в циклическом процессе, превышает 0,45 моля.
3) Работа, совершённая над газом при его изобарном сжатии, равна 200 Дж.
4) Минимальная температура в циклическом процессе равна 100 К.
5) На участке 4–1 газ отдаёт положительное количество теплоты.
КЭС: 2.1 Молекулярная физика
Тип ответа: Выбор ответов из предложенных вариантов
Ответ:
23
1) Нет. Изобарное расширение – это процесс 1-2, в котором работа газа была равна:
`A=pΔV=200*10^3* (8-6)=400`
2) Да. Максимальная температура в процессе достигается в точке 2, когда давление и объем максимальны. Для этого состояния запишем уравнение Менделеева-Клапейрона:
`p_2V_2=νRT_(max)`
откуда
`ν=(p_2V_2)/(RT_(max)) = 200*10^3*8*10^(-3))/(8,31*400)≈0,48` моль
3) Да. Вычислим работу при изобарном сжатии (процесс 3-4):
`A=pΔV=100*10^3* (8-6)=200` Дж
4) Нет. Минимальная температура достигается в точке 4, когда давление и объем минимальны. Запишем уравнение Менделеева-Клапейрона для этой точки:
`p_4V_4=νRT_4`
и найдем соотношение
`T_4/T_(max)=(p_4V_4)/(p_2V_2)=(100*10^3*6*10^-3)/(200*10^3*8*10^-3)=3/8`
То есть:
`T_3=3/8*400=150K`
5) Нет. Повысить давление при неизменном объеме можно за счет подачи Т.
Номер: 63FBEC
Выберите один или несколько правильных ответов.
Медную кастрюлю наполнили на 3/4 водой, закрыли лёгкой крышкой
и спустя несколько часов поставили на огонь. Воду в кастрюле довели до кипения и кипятили в течение некоторого времени. Атмосферное давление составляло 760 мм рт. ст.
Выберите все верные утверждения, описывающие характеристики воды, водяного пара и кастрюли.
1) Относительная влажность воздуха под крышкой в процессе нагревания воды увеличивалась.
2) В ходе кипения воды средняя потенциальная энергия взаимодействия молекул воды, переходящих из жидкости в пар, оставалась постоянной.
3) Давление водяных паров под крышкой оставалось постоянным в ходе процесса нагревания воды.
4) Температура медного дна кастрюли с водой при кипении немного превышала 100 ºС.
5) Плотность насыщенных водяных паров над поверхностью воды при нагревании до кипения увеличивалась.
КЭС: 2.1.15 Изменение агрегатных состояний вещества: испарение и конденсация, кипение жидкости
Тип ответа: Выбор ответов из предложенных вариантов
Ответ:
1) Нет. Так как после наполнения водой кастрюлю начали кипятить только через несколько часов, то первоначально относительная влажность воздуха в кастрюле была равна 100%. При этом так как в кастрюле при нагревании остается вода, то относительная влажность в кастрюле остаётся равной 100%, то есть не изменяется.
2) Нет. Потенциальная энергия взаимодействия молекул при переходе из жидкости в пар увеличивается.
3) Нет. Давление насыщенных паров в ходе увеличения температуры увеличивается. Давление водяных паров при 100% влажности равно давлению насыщенных паров, значит, давление водяных паров при нагреве увеличивается.
4) Да, так как температура огня выше ∘
100 C , при этом давление у дна кастрюли немного выше, чем атмосферное, так как у дна кастрюли дополнительно давит столб жидкости в кастрюле, значит, температура закипания воды у дна чуть больше 100, следовательно, температура дна кастрюли чуть выше 100∘C .
5) Да. Плотность насыщенных водяных паров над поверхностью воды при нагревании до кипения возрастает.
Номер: 1EEC69
Выберите один или несколько правильных ответов.
В начальный момент в сосуде под лёгким поршнем находится только жидкий эфир. На рисунке схематично представлен график зависимости температуры t эфира от времени τ его нагревания и последующего охлаждения.
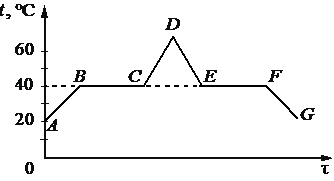
Из приведённого ниже списка выберите два утверждения, которые верно отражают результаты этого опыта.
1) Температура кипения эфира равна 40 °С.
2) В точке F в сосуде равные массы эфира находились в жидком и газообразном состояниях.
3) На участке EF внутренняя энергия эфира увеличивалась.
4) В точке С эфир закипел.
5) Время, за которое весь эфир выкипел, приблизительно равно времени, за которое он сконденсировался.
КЭС: 2.1.15 Изменение агрегатных состояний вещества: испарение и конденсация, кипение жидкости
Тип ответа: Выбор ответов из предложенных вариантов
Ответ:
15
1) Да. Полка на графике говорит о том, что эфир менял свое состояние, но не температуру.
2) Нет. Здесь он перешел в жидкое состояние.
3) Нет. Происходила конденсация.
4) Нет. Здесь он выкипел.
5) Да. Примерно ВС = EF.
Номер: 4C8A38
Выберите один или несколько правильных ответов.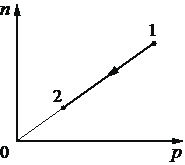
При переводе идеального газа из состояния 1 в состояние 2 концентрация молекул n пропорциональна давлению р (см. рисунок). Масса газа в процессе остаётся постоянной.
Из приведённого ниже списка выберите два правильных утверждения, характеризующих процесс 1–2.
1) Средняя кинетическая энергия теплового движения молекул газа уменьшается.
2) Плотность газа уменьшается.
3) Абсолютная температура газа остаётся неизменной.
4) Происходит изохорное нагревание газа.
5) Среднеквадратичная скорость теплового движения молекул газа увеличивается.
КЭС: 2.1.8 Связь температуры газа со средней кинетической энергией поступательного теплового движения его молекул
Тип ответа: Выбор ответов из предложенных вариантов
Ответ:
23
1) Нет.
2) Да. Видно из графика
3) Да. В изотермическом процессе температура остается постоянной.
4) Нет.
5) Нет.
Номер: 2F0D3E
Краткий ответ (140)
Впишите правильный ответ.
При исследовании зависимости давления в газе от температуры ученик измерял температуру в сосуде с газом с помощью термометра. Погрешность измерений температуры равна цене деления шкалы термометра. Чему равна температура газа по результатам этих измерений?

Ответ: ( ± ) oC
КЭС: 2.1.7 Абсолютная температура
Тип ответа: Краткий ответ
Ответ:
451
45±1º С
Ответ: 451
Номер: 474F4B
Впишите правильный ответ.
Один моль одноатомного идеального газа участвует в процессе 1–2–3, график которого изображён на рисунке в координатах p–T, где p – давление газа, T – абсолютная температура газа. Как изменяются объём газа V в ходе процесса 1–2 и плотность газа ρ в ходе процесса 2–3?
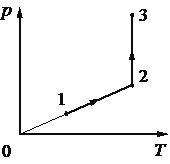
Для каждой величины определите соответствующий характер изменения:
1) увеличивается
2) уменьшается
3) не изменяется
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Объём газа в ходе процесса 1–2/ Плотность газа в ходе процесса 2– 3
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Тип ответа: Краткий ответ
Ответ:
31
Так как на участке 1-2 идет возрастание давления при увеличении Т, то объем газа меняется, далее 2-3 происходит увеличение давления, без изменения Т значит плотность растет. (идет изменение V)
Номер: F5A444
Впишите правильный ответ.
Горизонтальный цилиндрический сосуд с гладкими стенками разделён подвижным поршнем на две части. В одной части сосуда находится неон, в другой – аргон. Определите отношение средних кинетических энергий теплового движения молекул неона и аргона `E_н/E_а`, если поршень покоится, а отношение концентраций газов `n_н/n_а=1/3`.
КЭС: 2.1.14 Влажность воздуха
Тип ответа: Краткий ответ
Ответ:
3
Давление газа можно найти по формуле:
p = nkT
где
n — концентрация вещества,
k — постоянная Больцмана,
T — температура газа.
Связь кинетической энергии с температурой
`E_k = 3/2 kT`
`p = 2/3 nE`
Если поршень в равновесии, то кинетические энергии газов равны и для каждого из объемов и обратно пропорциональны частям этих объемов.
`n_н/n_а=(E_(ka))/(E_(kн))`
`1/3=(E_(ka))/(E_(kн))`
`E_(kн) = 3*E_(ka)`
Ответ: 3
Номер: 0A3E4F
Впишите правильный ответ.
Какую массу льда, находящегося при 0 °С, можно превратить в воду, если льду сообщить количество теплоты 0,33×105 Дж?
кг
КЭС: 2.1.16 Изменение агрегатных состояний вещества: плавление и кристаллизация
Тип ответа: Краткий ответ
Ответ:
0,1
Энергия для плавления (кристаллизации) льда:
Q=q*m,
где
m - масса льда в кг,
q - удельная теплота плавления льда в кДж/кг.
Удельная теплота плавления льда известна, она равна
330 кДж/кг. Тогда подставляем значения в формулу:
`m=Q/q`
`33000/330000 = 0,1 кг`
Ответ: 0,1 кг
Номер: 192F48
Впишите правильный ответ.
При увеличении абсолютной температуры средняя кинетическая энергия хаотического теплового движения молекул гелия увеличилась в 2 раза. Конечная температура газа равна 400 К. Какова начальная температура газа?
К
КЭС: 2.1.7 Абсолютная температура
Тип ответа: Краткий ответ
Ответ:
200
Кинетическая энергия молекул:
`E_k = 3/2 kT`
`(E_(k1))/(E_(k2)) = T_1/2T_1`
`E_(k1) = 0,5`
`400*0,5=200`К
Номер: 2A4D4B
Впишите правильный ответ.
В сосуде, разделённом перегородкой на две равные части, находится влажный воздух. Температура и давление воздуха в обеих частях сосуда одинаковы. Его относительная влажность в одной половине сосуда 20%, а в другой – 80%. Какой станет влажность воздуха в сосуде, если перегородку убрать?
%
КЭС: 2.1.14 Влажность воздуха
Тип ответа: Краткий ответ
Ответ:
50
Если давление и температура одинаковые, то воздух просто станет со среднестатистической влажностью.
`(80+20)/2=50%`
Номер: 2E704B
Впишите правильный ответ.
Относительная влажность воздуха увеличилась с 20% до 40% при неизменной температуре. Во сколько раз увеличилась при этом концентрация молекул воды в воздухе?
в
раз(а)
КЭС: 2.1.14 Влажность воздуха
Тип ответа: Краткий ответ
Ответ:
2
Подразумевается что влажность повысится для того же объема и в том же температурном диапазоне. Значит надо увеличить количество молекул в два раза.
Номер: DDF044
Впишите правильный ответ.
При уменьшении абсолютной температуры на 600 К средняя кинетическая энергия теплового движения молекул аргона уменьшилась в 4 раза. Какова конечная температура аргона?
К
КЭС: 2.1.8 Связь температуры газа со средней кинетической энергией поступательного теплового движения его молекул
Тип ответа: Краткий ответ
Ответ:
200
Кинетическая энергия молекул:
`E_(k1) = 3/2 kT_1`
`E_(k2) = 3/2 k(T_1-600)`
`(E_(k1))/(E_(k2)) = 4`
`T_1/(T_1-600)=4`
`T_1 = 4T_1-2400`
`T_1 =800`
`T_2=T_1-600=800-600=200K`
Номер: DC7C46
Впишите правильный ответ.
В сосуде неизменного объёма находится идеальный газ. Во сколько раз нужно увеличить количество газа в сосуде, чтобы после уменьшения абсолютной температуры газа в 2 раза его давление стало вдвое больше начального?
в
раз(а)
КЭС: 2.1.9 Уравнение p=nkT
Тип ответа: Краткий ответ
Ответ:
4
Давление газа можно вычислить по формуле:
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
`ν1 = (pV)/(RT)`
`ν2 = (2pV)/(RT/2) = (2*2pV)/(RT)=4(pV)/(RT)`
Видно что количество увеличилось в 4 раза.
Ответ: 4
Номер: AD774B
Впишите правильный ответ.
В сосуде неизменного объёма находится идеальный газ. Во сколько раз нужно уменьшить количество вещества газа в сосуде, чтобы после увеличения абсолютной температуры газа в 2 раза его давление стало вдвое меньше начального?
в
раз(а)
КЭС: 2.1.9 Уравнение p=nkT
Тип ответа: Краткий ответ
Ответ:
Давление газа можно вычислить по формуле:
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
Как видим из формулы, количество вещества и температура пропорциональны друг другу при влиянии на показание давления.
То есть если мы уменьшим количества вещества в два раза, то уменьшим и давление в два раза. При увеличении температуры в два раза мы увеличим давления в два раза, то есть получим тот же самый номинал, что был у нас до уменьшения количества. Нам же надо получить давление в два ниже при повышении Т в два раза, то есть изменение количество вещества должно быть в два раза выше нежели температуры. Если у нас температура увеличилась в 2 раза, то 2*2=4 в 4 раза должны уменьшить количество, чтобы снизить давление в два раза.
Номер: 0F98F4
Впишите правильный ответ.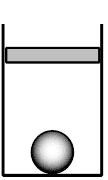
В цилиндрическом сосуде под поршнем находится газ. Поршень не закреплён и может перемещаться в сосуде без трения. На дне сосуда лежит стальной шарик (см. рисунок). Газ нагревают. Как изменятся в результате этого давление газа и действующая на шарик сила Архимеда? Атмосферное давление неизменно.
Для каждой величины определите соответствующий характер изменения:
1) увеличилось
2) уменьшилось
3) не изменилось
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Давление газа
Сила Архимеда
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Тип ответа: Краткий ответ
Ответ:
32
Так как крышка свободно перемещается, то давление будет постоянным, так как просто будет увеличиваться объем. А вот сила Архимеда будет падать, так как при увеличении объема меняется плотность газа, она становиться меньше.
Номер: 298FF1
Впишите правильный ответ.
Объём сосуда с идеальным газом уменьшили вдвое, выпустив половину газа и поддерживая температуру газа в сосуде постоянной. Как изменились при этом давление газа в сосуде и его внутренняя энергия?
Для каждой величины определите соответствующий характер изменения:
1) увеличилась
2) уменьшилась
3) не изменилась
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Давление газа в сосуде / Внутренняя энергия газа в сосуде
КЭС: 2.1 Молекулярная физика
Тип ответа: Краткий ответ
Ответ:
32
Давление газа можно вычислить по формуле:
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
То есть уменьшив количество вещества и объем мы не изменили давление. А вот за счет изменение количества вещества вдвое и согласно формуле:
Внутренняя энергия:
`U = 3/2*ν*RT`,
где
ν – количество вещества,
T - температура газа.
R - Универсальная газовая постоянная
Мы уменьшили энергию вдвое.
Номер: C427F7
Впишите правильный ответ.
Разреженный неон в количестве 5 моль изобарно расширяется. Во сколько раз увеличится объём газа при повышении его абсолютной температуры в 3 раза?
в
раз(а)
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Тип ответа: Краткий ответ
Ответ:
3
Изобарно, значит не меняем давление. А при увеличении объема и неизменном давлении сохранять давление получится только за счет повышения температуры.
Давление газа можно вычислить по формуле:
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
Отсюда видно, что увеличивая температуру в 3 раза, объем тоже можно увеличить в три раза.
Номер: 3845F2
Впишите правильный ответ.
Объём 1 моль водорода в сосуде при температуре T0 и давлении p0 равен 20 л. Каков объём 3 моль водорода при том же давлении и вдвое большей температуре?
л
КЭС: 2.1.10 Модель идеального газа в термодинамике
Тип ответа: Краткий ответ
Ответ:
120
Давление газа можно вычислить по формуле:
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
Мы увеличили количество вещества в 3 раза и температуру в 2, получается давление должно было возрасти 2*3=6 раз. Однако за счет изменения объема этого не произошло, то есть изменение объема должно быть в 6 раз.
20*6=120 литров
Ответ: 120
Номер: 8E16FE
Впишите правильный ответ.
В сосуде с подвижным поршнем находятся вода и её насыщенный пар. Объём пара медленно увеличили в 1,5 раза при постоянной температуре так, что в сосуде ещё осталась вода. Определите отношение числа молекул пара в сосуде в конце процесса к числу молекул пара в сосуде в начале процесса.
КЭС: 2.1.14 Влажность воздуха
Тип ответа: Краткий ответ
Ответ:
1,5
Увеличение объема при неизменной температуре возможно путем подачи тепла в систему, но при этом насыщенный пар остается во всем объеме на который увеличивается, причем в той же концентрации до тех пор пока жидкая вода позволяет выделять молекулы в объем газа. Это у нас и произошло. Увеличение объема и оставшаяся вода позволили увеличить количество пара прямо пропорционально объему в 1,5 раза.
Номер: 48DD07
Впишите правильный ответ.
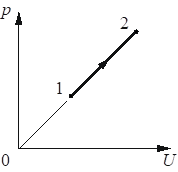
На рисунке показан процесс изменения состояния 1 моль одноатомного идеального газа (U – внутренняя энергия газа; p – давление газа). Как изменяются в ходе этого процесса абсолютная температура и объём газа?
Для каждой величины определите соответствующий характер изменения:
1) увеличивается
2) уменьшается
3) не изменяется
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Абсолютная температура газа /Объём газа
КЭС: 2.1 Молекулярная физика
Тип ответа: Краткий ответ
Ответ:
13
Видим на графике увеличение внутренней энергии и давления. Согласно формуле
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
такое может происходить лишь при увеличении температуры, но неизменном объеме.
Номер: 4F400B
Впишите правильный ответ.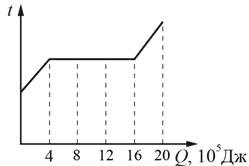
Вещество массой 6 кг находится в сосуде под поршнем. На рисунке показан график изменения температуры t вещества по мере поглощения им количества теплоты Q. Первоначально вещество было в жидком состоянии. Какова удельная теплота парообразования вещества?
кДж/кг
КЭС: 2.1.15 Изменение агрегатных состояний вещества: испарение и конденсация, кипение жидкости
Тип ответа: Краткий ответ
Ответ:
200
На графике видим процесс нагревания жидкого вещества, испарения и нагрева пара. На процесс парообразования 6 кг вещества было потрачено 16 - 4 = 12 *105 Дж
12*105 : 6 = 2*105 Дж = 200 кДж
Ответ: 200 кДж
Номер: FB590C
Впишите правильный ответ.
Сосуд, разделённый перегородкой на две равные части, заполнен воздухом. В одной части сосуда находится сухой воздух, а в другой – влажный, его относительная влажность 50%. Температура и давление воздуха в обеих частях сосуда одинаковы. Какой станет влажность воздуха в сосуде, если перегородку убрать?
%
КЭС: 2.1.14 Влажность воздуха
Тип ответа: Краткий ответ
Ответ:
25
Водяной пар равномерно распределится по объему. Раз объем для распространения увеличится в 2 раза, то влажность соизмеримо упадет в два раза.
50/2=25%
Ответ: 25
Номер: 7FF207
Впишите правильный ответ.
В сосуде содержится разреженный гелий под давлением 300 кПа. Концентрацию гелия увеличили в 2 раза, а среднюю кинетическую энергию поступательного теплового движения его молекул уменьшили в 3 раза. Определите установившееся давление газа.
кПа
КЭС:
2.1.9 Уравнение p=nkT
Тип ответа: Краткий ответ
Ответ:
200
Согласно формуле
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
Получается относительно первоначального давления 300*2/3=200кПа
Ответ: 200
Номер: 767F05
Впишите правильный ответ.
В воздухе класса при относительной влажности 30% парциальное давление водяного пара равно 900 Па. Определите давление насыщенного водяного пара при данной температуре.
Па
КЭС: 2.1.14 Влажность воздуха
Тип ответа: Краткий ответ
Ответ:
3000
Относительную влажность воздуха можно найти по формуле:
`φ = ρ_1/ρ_2*100%`
p1 - парциальное давление при 30 процентной влажности.
`30 = 900/p_2*100%`
`p_2=900/30*100=3000 Па`
Ответ: 3000
Номер: 7EFC03
Впишите правильный ответ.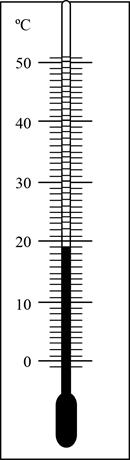
Запишите показания термометра с учётом абсолютной погрешности измерений. Абсолютная погрешность измерения температуры равна цене деления термометра.
Ответ: ( ± ) °С.
КЭС: 2.1 Молекулярная физика
Тип ответа: Краткий ответ
Ответ:
191
19 это показание, и 1 это погрешность
Номер: 1F660F
Впишите правильный ответ.
При увеличении абсолютной температуры средняя кинетическая энергия хаотического теплового движения молекул разреженного одноатомного газа увеличилась в 2,5 раза. Конечная температура газа равна 500 К. Какова начальная температура газа?
К
КЭС: 2.1.7 Абсолютная температура
Тип ответа: Краткий ответ
Ответ:
200
Внутренняя энергия:
`U = 3/2*ν*RT`,
где
ν – количество вещества,
T - температура газа.
R - Универсальная газовая постоянная
Как видим из формул энергия прямо пропорциональна температуре, то есть увеличение температуры тоже было в 2,5 раза. 500/2,5=200 К
Ответ: 200
Номер: 575105
Впишите правильный ответ.
1 моль одноатомного идеального газа участвует в процессе 1– 2– 3, график которого изображён на рисунке в координатах p– V, где p – давление газа, V – объём газа. Как изменяются концентрация молекул n газа в ходе процесса 1– 2 и абсолютная температура Т газа в ходе процесса 2– 3? Масса газа остаётся постоянной.
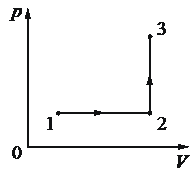
Для каждой величины определите соответствующий характер изменения:
1) увеличивается
2) уменьшается
3) не изменяется
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Концентрация молекул газа в ходе процесса 1– 2/ Абсолютная температура газа в ходе процесса 2– 3
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Тип ответа: Краткий ответ
Ответ:
21
В процессе 1-2 у нас увеличивается объем при неизменной массе, что возможно только при увеличении Т, то есть получается более разряженный газ, но с более высокой кинетической энергией молекул, тогда давление сохраняется, объем увеличивается, масса неизменна.
В процессе 2-3 у нас происходило увеличение давления без изменения объема. Раз мы ограничили изменение объема, то давление можно поднять за счет Т, увеличивая ее.
Номер: F0D87A
Впишите правильный ответ.
При температуре T0 и давлении p0 3 моль идеального газа занимают объём 6V0. Сколько моль газа будут занимать объём V0 при температуре 2T0 и давлении 2p0?
моль
КЭС: 2.1.10 Модель идеального газа в термодинамике
Тип ответа: Краткий ответ
Ответ:
0,5
Согласно формуле
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура, тогда
`ν = (pV)/(RT)`
При этом по условию объем уменьшили в 6 раз, температуру увеличили в 2 раза, давление в 2.
`ν_2 = (2pV)/(6R2T)=(pV)/(6RT)` то есть шестая часть от нашего первоначального значения количества вещества.
3/6=0,5 моль
Ответ: 0,5
Номер: 03BD78
Впишите правильный ответ.
В калориметр со льдом, имеющим температуру 0 °С, добавили воду при комнатной температуре. Как изменятся в результате установления теплового равновесия удельная теплоёмкость воды и масса льда в калориметре?
Для каждой величины определите соответствующий характер изменения:
1) увеличилось
2) уменьшилось
3) не изменилось
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Удельная теплоёмкость воды
Масса льда
КЭС: 2.1.16 Изменение агрегатных состояний вещества: плавление и кристаллизация
2.2.4 Количество теплоты. Удельная теплоемкость вещества
Тип ответа: Краткий ответ
Ответ:
32
Если условно систему считать обособленной, то теплоемкость воды не изменится, а вот часть льда растет, до тех пор пока вода не станет равна температуре 0 градусов и часть будет водой, часть льдом.
Номер: 70D177
Впишите правильный ответ.
В сосуде неизменного объёма находилась при комнатной температуре смесь двух идеальных газов, по 1 моль каждого. Половину содержимого сосуда выпустили, а затем добавили в сосуд 1 моль первого газа. Температура в сосуде поддерживалась неизменной. Как изменились в результате парциальное давление первого газа и суммарное давление смеси газов?
Для каждой величины определите соответствующий характер изменения:
1) увеличилось
2) уменьшилось
3) не изменилось
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Парциальное давление первого газа
Давление смеси газов
КЭС: 2.1.10 Модель идеального газа в термодинамике
Тип ответа: Краткий ответ
Ответ:
13
Парциальное давление первого газа увеличилось, так как его количество стало больше.
Суммарное давление смеси газов не изменилось, так как общий объем остался тем же.
Номер: 71D77C
Впишите правильный ответ.
Во сколько раз уменьшится абсолютная температура разреженного одноатомного газа, если среднеквадратичная скорость теплового движения его молекул уменьшится в 5 раз?
в
раз(-а)
КЭС: 2.1.8 Связь температуры газа со средней кинетической энергией поступательного теплового движения его молекул
Тип ответа: Краткий ответ
Ответ:
25
Внутренняя энергия:
`U = 3/2*ν*RT = (mV^2)/2`, где
ν – количество вещества,
T - температура газа.
R - Универсальная газовая постоянная
`3/2*ν*RT = (mV^2)/2`
`T = (2mV^2)/(2*3*v*R*T)`
`T = (mV^2)/(3*v*R*T)`
Итак, мы видим, что T пропорциональна квадрату скорости молекул V2
То есть при (T ˜ V2 ) то есть меняя скорость в 5 раз, температура изменится в 5*5 = 25 раз
Ответ: 25
Номер: 54C671
Впишите правильный ответ.
Ученику необходимо на опыте обнаружить зависимость объёма газа, находящегося в сосуде под подвижным поршнем, от массы газа. У него имеется пять различных сосудов с манометрами. Сосуды наполнены одним и тем же газом при различных температурах и давлениях (см. таблицу).
Какие два сосуда необходимо взять ученику, чтобы провести исследование?
|
№ |
Давление, кПа |
Температура газа |
Масса газа, г |
|
1 |
300 |
75 |
5 |
|
2 |
350 |
80 |
10 |
|
3 |
250 |
90 |
8 |
|
4 |
350 |
75 |
10 |
|
5 |
250 |
90 |
5 |
В ответ запишите номера выбранных сосудов.
Ответ:
КЭС: 2.1 Молекулярная физика
Тип ответа: Краткий ответ
Ответ:
35
Необходимо взять газ с одной температурой, с одним давлением, но разной массы, тогда объем будет зависеть как раз от нее.
Номер: 6F4E7E
Впишите правильный ответ.
При неизменной концентрации молекул разреженного одноатомного газа их средняя кинетическая энергия теплового движения уменьшилась в 16 раз.
Во сколько раз уменьшилось при этом давление газа?
в
раз(-а)
КЭС: 2.1.6 Связь между давлением и средней кинетической энергией поступательного теплового движения молекул идеального газа (основное уравнение МКТ)
Тип ответа: Краткий ответ
Ответ:
16
Давление разреженного газа пропорционально произведению концентрации молекул газа и средней кинетической энергии теплового движения, например, для одноатомного газа:
`p = 2/3*n*E`
При одновременном уменьшении средней кинетической энергии теплового движения в 16 раз давление разреженного газа уменьшится в 16 раз.
Номер: 625778
Впишите правильный ответ.
При абсолютной температуре T0 и давлении p0 идеальный газ в количестве 1 моль занимает объём V0. Сколько моль газа при температуре 2T0 и давлении p0 занимают объём 2V0?
моль
КЭС: 2.1.10 Модель идеального газа в термодинамике
Тип ответа: Краткий ответ
Ответ:
1
Давление газа можно вычислить по формуле:
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура, отсюда
`ν = (pV)/(RT)`
Увеличиваем объем в два раза и давление. Как видим эти показатели сокращаются,
`ν = (p2V)/(R2T)=(pV)/(RT)`
то есть при новых условиях надо то же самое количество вещества 1 моль.
Номер: 38447B
Впишите правильный ответ.
Один моль одноатомного идеального газа участвует в процессе 1– 2– 3, график которого изображён на рисунке в координатах p– T, где p – давление газа, T – абсолютная температура газа.
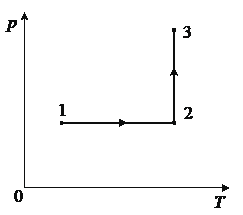
Как изменяются объём газа V в ходе процесса 1– 2 и плотность газа ρ в ходе процесса 2– 3? Масса газа остаётся постоянной.
Для каждой величины определите соответствующий характер изменения:
1) увеличивается
2) уменьшается
3) не изменяется
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Объём газа в ходе процесса 1– 2/ Плотность газа в ходе процесса 2– 3
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Тип ответа: Краткий ответ
Ответ:
11
В процессе 1-2 добавляем температуру без изменения количества вещества, давление не меняется, значит меняется объем, он увеличивается.
В процессе 2-3 увеличивается давление при неизменной температуре, значит меняется объем, он уменьшается, а с ним и и плотность, она увеличивается.
Номер: 2F8DB4
Впишите правильный ответ.
В сосуде неизменного объёма находится идеальный газ в количестве 1 моль. Во сколько раз увеличится давление газа на стенки сосуда, если добавить в сосуд ещё 3 моль того же газа, а абсолютную температуру газа уменьшить в 2 раза?
в
раз(а)
КЭС: 2.1.9 Уравнение p=nkT
Тип ответа: Краткий ответ
Ответ:
2
Давление газа можно вычислить по формуле:
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура, отсюда
`p_1 = (3v+νRT)/2V=(4vRT)/2V=2 * (νRT)/V`Как видимо у нас получился коэффициент 2 по сравнению с первоначальной формулой.
Ответ: 2
Номер: CA98BA
Впишите правильный ответ.
В сосуде под поршнем находится воздух с относительной влажностью 20%. Поршень сдвигают, уменьшая объём. Во сколько раз уменьшится объём сосуда к моменту, когда при неизменной температуре водяной пар в сосуде станет насыщенным?
в
раз(а)
КЭС: 2.1.14 Влажность воздуха
Тип ответа: Краткий ответ
Ответ:
5
Относительную влажность воздуха можно найти по формуле:
`φ = ρ_1/ρ_2*100%`
То есть нам надо получить 100 пар, а значит надо повысить давление в 100/20=5 раз.
Опять же давление газа можно вычислить по формуле:
`p = (νRT)/V`
То есть давление и объем обратно пропорциональны. Значит чтобы повысить давление в 5 раз, надо уменьшить объем в 5 раз.
Ответ: 5
Номер: 96F2BE
Впишите правильный ответ.
Парциальное давление водяного пара в комнате в 2,5 раза меньше давления насыщенного водяного пара при той же температуре. Определите относительную влажность воздуха в комнате.
%
КЭС: 2.1.14 Влажность воздуха
Тип ответа: Краткий ответ
Ответ:
40
Относительную влажность воздуха можно найти по формуле:
`φ = ρ_1/ρ_2*100%`
Получается, что давление должно в 2,5 раза ниже давления насыщенного пара, при этом влажность также пропорциональная давлению по формуле:
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура
100/2,5=40 %
Ответ: 40
Номер: 641CB6
Впишите правильный ответ.
Относительная влажность воздуха в закрытом сосуде под поршнем равна 40%. Какой будет относительная влажность воздуха в сосуде, если его объём за счёт движения поршня при неизменной температуре увеличить в 2 раза?
%
КЭС: 2.1.14 Влажность воздуха
Тип ответа: Краткий ответ
Ответ:
20
Относительную влажность воздуха можно найти по формуле:
`φ = ρ_1/ρ_2*100%`
Получается, что давление станет в 2 раза ниже, при этом влажность также пропорционально уменьшится
40/2=20 %
Ответ: 20
Номер: 33A3B0
Впишите правильный ответ.
В ходе эксперимента давление разреженного газа в сосуде снизилось в 5 раз, а средняя энергия теплового движения его молекул уменьшилась в 2 раза. Во сколько раз уменьшилась при этом концентрация молекул газа в сосуде?
в
раз(а)
КЭС: 2.1.6 Связь между давлением и средней кинетической энергией поступательного теплового движения молекул идеального газа (основное уравнение МКТ)
Тип ответа: Краткий ответ
Ответ:
2,5
Внутренняя энергия:
`U = 3/2*ν*RT = (mV^2)/2`, где
ν – количество вещества,
T - температура газа.
R - Универсальная газовая постоянная
Из этой формулы можно сделать вывод, что при снижении тепловой энергии в два раза, Т снизилась тоже в два раза.
Теперь посмотрим на формулу давления.
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура
При этом давление упало в 5 раз, где изменение температуры было в 2 раза. Запишем формулу с условием изменения Т.
`p_1 = (νR(T/2))/V`
Получается если у нас сосуд и объем постоянный, то изменение давления может происходить только за счет изменения концентрации ν.
Мы изменили температура в 2 раза, и она изменила давление в 2 раза, нам надо в 5, значит надо изменить концентрацию 5/2=2,5 раза. Получается так.
`p_(итог) = ((ν/(2,5))R(T/2))/V`
Концентрацию как видим надо уменьшить на 2,5
Ответ: 2,5
Номер: 3AB2B2
Впишите правильный ответ.
Концентрация молекул воды в воздухе уменьшилась в 4 раза при неизменной температуре. Во сколько раз уменьшилась относительная влажность воздуха?
в
раз(-а)
КЭС: 2.1.14 Влажность воздуха
Тип ответа: Краткий ответ
Ответ:
4
посмотрим на формулу давления.
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура
Условно объем газа в воздухе не изменился, температура тоже, значит концентрация прямо пропорционально изменила давление. То есть в 4 раза.
Номер: 88B2B0
Впишите правильный ответ.
1 моль идеального газа участвует в процессе 1–2–3, график которого изображён на рисунке в координатах p–V, где p – давление газа, V – объём газа. Как изменяются абсолютная температура газа Т в ходе процесса 1–2 и концентрация молекул газа n в ходе процесса 2–3? Масса газа остаётся постоянной.
Для каждой величины определите соответствующий характер изменения:
1) увеличивается
2) уменьшается
3) не изменяется
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Абсолютная температура
газа в ходе процесса 1–2
Концентрация молекул газа
в ходе процесса 2–3
КЭС:
2.1 Молекулярная физика
Тип ответа: Краткий ответ
Ответ:
23
В процессе 1-2 снижается объем но не повышается давление, значит температура снижается.
В процессе 2-3 снижается давление при неизменном давлении, значит или меняем концентрацию молекул или меняем температуру. Но так как масса остается постоянной а объем не меняется, то меняется явно температура. Само собой при неизменном объеме и массе концентрация тогда остается постоянной, неизменной.
Номер: 1ED71B
Впишите правильный ответ.
На какую величину, согласно показаниям манометра, давление воздуха в баллоне превышает атмосферное давление, если погрешность манометра равна 3 мм рт. ст.?

Ответ: ( ± ) мм рт. ст.
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Тип ответа: Краткий ответ
Ответ:
1963
196 - номинал
3 - погрешность
Номер: 665C1D
Впишите правильный ответ.
Чему равно атмосферное давление в момент измерения барометром (см. рис), если погрешность прямого измерения давления равна цене деления барометра?

Ответ: ( ± ) кПа.
КЭС: 2.1.2 Тепловое движение атомов и молекул вещества
Тип ответа: Краткий ответ
Ответ:
99,80,1
99,8 - показатель номинал
0,1 - погрешность равная цене деления прибора
Номер: 67811E
Впишите правильный ответ.
При увеличении абсолютной температуры средняя кинетическая энергия хаотического теплового движения молекул разреженного одноатомного газа увеличилась в 2 раза. Конечная температура газа равна 600 К. Какова была начальная температура газа?
К
КЭС: 2.1.10 Модель идеального газа в термодинамике
Тип ответа: Краткий ответ
Ответ:
300
Внутренняя энергия:
`U = 3/2*ν*RT = (mV^2)/2`,
где
ν – количество вещества,
T - температура газа.
R - Универсальная газовая постоянная
Из формулы видно, что увеличение энергии прямо пропорционально росту температуры.
Значит рост температуры был в 2 раза. Тогда 600/2=300 К
Ответ: 300
Номер: 8CBF1A
Впишите правильный ответ.
Во сколько раз увеличилось давление разреженного газа при увеличении концентрации его частиц в 3 раза и уменьшении абсолютной температуры газа в 2 раза?
в
раз(а)
КЭС: 2.1.9 Уравнение p=nkT
Тип ответа: Краткий ответ
Ответ:
1,5
Из формулы
p = nkT, где
р — давление,
n — число частиц в единице объёма,
k — Больцмана постоянная,
Т — абсолютная температура.
`p_1=3nkT/2=1,5nkT`
То есть в 1,5 раза.
Номер: 497121
Впишите правильный ответ.
Ученику необходимо на опыте обнаружить зависимость давления газа, находящегося в сосуде, от объёма газа. У него имеются пять различных сосудов с манометрами. Сосуды наполнены различными газами при различной температуре (см. таблицу). Массы газов одинаковы. Какие два сосуда необходимо взять ученику, чтобы провести данное исследование?
|
№№ сосуда |
Объём сосуда, л |
Температура газа |
Газ в сосуде |
|
1 |
6 |
320 |
аргон |
|
2 |
5 |
350 |
неон |
|
3 |
4 |
320 |
аргон |
|
4 |
4 |
270 |
аргон |
|
5 |
4 |
300 |
неон |
Запишите в ответе номера выбранных сосудов.
Ответ:
КЭС: 2.1.10 Модель идеального газа в термодинамике
Тип ответа: Краткий ответ
Ответ:
13
Берем сосуды с разным объемом, но с равными температурами и газами.
Номер: 16FF25
Впишите правильный ответ.
При увеличении абсолютной температуры на 600 К средняя кинетическая энергия теплового движения молекул гелия увеличилась в 4 раза. Какова начальная температура газа?
К
КЭС: 2.1.8 Связь температуры газа со средней кинетической энергией поступательного теплового движения его молекул
Тип ответа: Краткий ответ
Ответ:
200
Внутренняя энергия:
`U = 3/2*ν*RT = (mV^2)/2`, где
ν – количество вещества,
T - температура газа.
R - Универсальная газовая постоянная
Из этой формулы можно сделать вывод, что при увеличении тепловой энергии в 4 раза, повысим и энергию в 4 раза.
Получается:
`Т_1 = Т+600`
`Т_1 = 4T`, где Т1 конечная температура
То есть
4T=Т+600
3Т = 600
Т = 600/3=200 К
Ответ: 200
Номер: 1B362C
Впишите правильный ответ.
Температура воздуха в замкнутом сосуде равна 273 К. До какой температуры нужно нагреть воздух в сосуде при постоянном объёме, чтобы его давление утроилось?
К
КЭС: 2.1.10 Модель идеального газа в термодинамике
Тип ответа: Краткий ответ
Ответ:
819
p = nkT, где
р — давление,
n — число частиц в единице объёма,
k — Больцмана постоянная,
Т — абсолютная температура.
Как видим температура и давление прямо пропорциональны. То есть температуру надо увеличить в 3 раза.
273*3=819 К
Ответ: 819
Номер: 530821
Впишите правильный ответ.
Относительная влажность воздуха уменьшилась с 45% до 15% при неизменной температуре. Во сколько раз уменьшилась при этом концентрация водяных паров в воздухе?
в
раз(а)
КЭС: 2.1.14 Влажность воздуха
Тип ответа: Краткий ответ
Ответ:
3
p = nkT, где
р — давление,
n — число частиц в единице объёма,
k — Больцмана постоянная,
Т — абсолютная температура.
Из формулы видно, если не менять температуру, то надо менять концентрацию, причем прямо пропорционально, то есть также в 3 раза (45/15=3).
Ответ: 3
Номер: 8E4A29
Впишите правильный ответ.
Относительная влажность воздуха в цилиндре под поршнем равна 34%. Воздух изотермически сжали, уменьшив его объём в 3 раза. Какова относительная влажность воздуха в цилиндре после сжатия?
%
КЭС: 2.1.14 Влажность воздуха
Тип ответа: Краткий ответ
Ответ:
100
При сжатии воздуха происходит повышение давления и повышение влажности, при этом при достижении 100 процентной влажности возникает насыщенный пар, и начинается дальнейшая конденсация.
В нашем случае влажность меняется пропорционально давлению.
34*3=102 то есть должно быть 102 процента, но как мы знаем пар насыщенный при 100 процентах, больше не бывает, то есть 2 процента пошли в конденсат. В итоге у нас держится максимум 100%
Ответ: 100
Номер: 4E55D4
Впишите правильный ответ.
Относительная влажность воздуха в закрытом сосуде с поршнем равна 50%. Какова будет относительная влажность воздуха в сосуде, если объём сосуда при неизменной температуре уменьшить в 2 раза?
%
КЭС: 2.1.14 Влажность воздуха
Тип ответа: Краткий ответ
Ответ:
100
При сжатии воздуха происходит повышение давления и повышение влажности, при этом при достижении 100 процентной влажности возникает насыщенный пар, и начинается дальнейшая конденсация.
В нашем случае влажность меняется пропорционально давлению.
50*2=100 %. В итоге у нас держится максимум по влаге, то есть образовался насыщенный пар 100%
Ответ: 100
Номер: 5809D9
Впишите правильный ответ.
При температуре T0 и давлении p0 3 моль идеального газа занимают объём 2V0. Сколько моль газа будут занимать объём V0 при температуре 3T0 и давлении 2p0?
моль
КЭС: 2.1.10 Модель идеального газа в термодинамике
Тип ответа: Краткий ответ
Ответ:
1
Давление газа можно вычислить по формулам:
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
По условиям так:
Снижаем объем в два раза, значит можно снизить количество вещества в два раза.
3/2=1,5 моль
Повышаем температуру в 3 раза, значит можно еще снизить объем в 3 раза.
1,5/3=0,5 моль.
Повышаем давление в два раза, значит надо повысит количество в два раза. 0,5*2=1 моль
Ответ: 1
Номер: A0FBDF
Впишите правильный ответ.
Необходимо на опыте обнаружить зависимость объёма газа, находящегося в сосуде под подвижным поршнем, от давления. Имеются пять различных сосудов с манометрами. Сосуды наполнены одним и тем же газом при различных температурах и давлениях (см. таблицу). Какие два сосуда необходимо взять ученику, чтобы провести данное исследование?
|
№ сосуда |
Давление, кПа |
Температура газа |
Масса газа, г |
|
1 |
80 |
50 |
15 |
|
2 |
100 |
80 |
10 |
|
3 |
120 |
100 |
10 |
|
4 |
80 |
50 |
15 |
|
5 |
60 |
80 |
10 |
Запишите в таблицу номера выбранных сосудов.
Ответ:
КЭС: 2.1.10 Модель идеального газа в термодинамике
Тип ответа: Краткий ответ
Ответ:
25
Температуру берем неизменную, давление берем разное, так как надо изучить зависимость от давления.
Номер: 94D7DF
Впишите правильный ответ.
В паспорте барометра указано, что абсолютная погрешность прямого измерения давления равна 3 гПа.

Определите показания барометра.
Ответ: ( ± ) гПа.
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Тип ответа: Краткий ответ
Ответ:
10033
1003 - номинал
3 - погрешность
Номер: 9BB8D9
Впишите правильный ответ.
Относительная влажность воздуха в цилиндре под поршнем равна 73%. Воздух изотермически сжали, уменьшив его объём в два раза. Какова относительная влажность воздуха после сжатия?
%
КЭС: 2.1.14 Влажность воздуха
Тип ответа: Краткий ответ
Ответ:
100
При сжатии воздуха происходит повышение давления и повышение влажности, при этом при достижении 100 процентной влажности возникает насыщенный пар, и начинается дальнейшая конденсация.
В нашем случае влажность меняется пропорционально давлению.
73*2=146 то есть должно быть 146 процента, но как мы знаем пар насыщенный при 100 процентах, больше не бывает, то есть 46 процента пошли в конденсат. В итоге у нас держится максимум 100%
Ответ: 100
Номер: 3EF7DE
Впишите правильный ответ.
Ученику необходимо на опыте обнаружить зависимость давления газа, находящегося в сосуде, от молярной массы газа. У него имеются пять различных сосудов с манометрами. Сосуды наполнены различными газами одинаковой массы при различной температуре (см. таблицу). Какие два сосуда необходимо взять ученику, чтобы провести данное исследование?
|
№№ сосуда |
Объём сосуда, л |
Температура газа |
Газ в сосуде |
|
1 |
6 |
300 |
аргон |
|
2 |
5 |
350 |
неон |
|
3 |
4 |
320 |
аргон |
|
4 |
4 |
270 |
аргон |
|
5 |
4 |
320 |
неон |
Запишите номера выбранных сосудов.
Ответ:
КЭС: 2.1.10 Модель идеального газа в термодинамике
Тип ответа: Краткий ответ
Ответ:
35
В наших условиях нет зависимости от температуры, сразу можно выбрать два варианта с одной температурой 3 и 5, других вариантов нет.
Номер: 82B5DD
Впишите правильный ответ.
В результате изохорного перехода 1 моль идеального газа из начального состояния в конечное его давление уменьшилось в 3 раза, а температура оказалась равной 630 К. Какова начальная температура газа?
К
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Тип ответа: Краткий ответ
Ответ:
1890
Давление газа можно вычислить по формулам:
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
Как видим из формулы изменение температуры повлияло на изменение давления, так как объем остался прежний из-за того что процесс изохорный, без изменения давления то есть. В итоге температура изменилась прямо пропорционально давлению. Значит начальная была 630*3=1890 К
Ответ: 1890
Номер: 473250
Впишите правильный ответ.
В закрытом сосуде под поршнем находится водяной пар при температуре 100 °С под давлением 40 кПа. Каким станет давление пара, если, сохраняя его температуру неизменной, уменьшить объём пара в 3 раза?
кПа
КЭС: 2.1.13 Насыщенные и ненасыщенные пары. Качественная зависимость плотности и давления насыщенного пара от температуры, их независимость от объёма насыщенного пара
Тип ответа: Краткий ответ
Ответ:
100
Так как температура T=const (неизменная), то можно записать равенство:
`p_1V_1=p_2V_2`
Получаем
`p_1=40 кПа; V_2=V_1/3`
Тогда
`p_2=p_1 * V_1/V_2=p_1 * V_1/(V_1/3)=3p_1=3*40=120 кПа`
Однако, учитывая, что при температуре 100 °С давление насыщенного пара равно 100 кПа, то при достижении этой отметки давление дальше расти не будет, пар станет насыщенным и его часть будет конденсироваться (переходить в жидкое состояние).
Ответ: 100кПа
Номер: 480A51
Впишите правильный ответ.
Цилиндрический сосуд разделён лёгким подвижным теплоизолирующим поршнем на две части. В одной части сосуда находится аргон, в другой – неон. Концентрация молекул газов одинакова. Определите отношение средней кинетической энергии теплового движения молекул аргона
к средней кинетической энергии теплового движения молекул неона, когда поршень находится в равновесии.
КЭС: 2.1.6 Связь между давлением и средней кинетической энергией поступательного теплового движения молекул идеального газа (основное уравнение МКТ)
Тип ответа: Краткий ответ
Ответ:
1
Так как газы уравновешивают друг друга по давлению, значит количество вещества в половинах одинаковы, так как все показатели равнозначны, а из закона Авогадро следует, что при равных условиях в одном объеме содержание количества разных газов одинаковое. В итоге получается массовое количество вещества одинаковое, значит и энергии одинаковые. Значит соотношение равно 1/1=1
Номер: 2B4653
Впишите правильный ответ.
При увеличении абсолютной температуры средняя кинетическая энергия хаотического теплового движения молекул разреженного одноатомного газа увеличилась в 2 раза. Начальная температура газа 250 К. Какова конечная температура газа?
К
КЭС: 2.1.7 Абсолютная температура
Тип ответа: Краткий ответ
Ответ:
500
Давление газа можно вычислить по формулам:
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
Как видим из формулы изменение температуры повлияло на изменение давления, так как объем условно прежний прежний, то температура изменилась прямо пропорционально давлению. Значит конечная Т будет 250*2=500 К
Ответ: 500
Номер: D2BF5C
Впишите правильный ответ.
Ученику необходимо на опыте обнаружить зависимость объёма газа, находящегося в сосуде под подвижным поршнем, от температуры газа.
У него имеются пять различных сосудов с манометрами. Сосуды наполнены одним и тем же газом при различных температуре и давлении (см. таблицу).
Какие два сосуда необходимо взять ученику, чтобы провести данное исследование?
|
№№ сосуда |
Давление, кПа |
Температура газа в сосуде, °С |
Масса газа, г |
|
1 |
150 |
50 |
10 |
|
2 |
200 |
50 |
15 |
|
3 |
150 |
20 |
15 |
|
4 |
200 |
20 |
10 |
|
5 |
200 |
20 |
15 |
Запишите в таблицу номера выбранных сосудов.
Ответ:
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Тип ответа: Краткий ответ
Ответ:
25
То есть у нас идет процесс нагрева и изучения занимаемого объема от него, при этом масса должна быть одинаковая. Эту массу мы греем на разные Т, но получаем одно давление, то есть даем газу расшириться в свободных пределах.
Номер: 57A253
Впишите правильный ответ.
Абсолютная температура гелия увеличилась со 150 К до 600 К. Во сколько раз увеличилась средняя кинетическая энергия теплового движения его молекул?
в
раз(а)
КЭС: 2.1.8 Связь температуры газа со средней кинетической энергией поступательного теплового движения его молекул
Тип ответа: Краткий ответ
Ответ:
4
Внутренняя энергия:
`U = 3/2*ν*RT`,
где
ν – количество вещества,
T - температура газа.
R - Универсальная газовая постоянная
Как видим из формулы увеличение температуры прямо пропорционально увеличению энергии.
Значит 600/150=4 раза
Номер: A6655C
Впишите правильный ответ.
В результате охлаждения разреженного аргона его абсолютная температура уменьшилась в 4 раза. Во сколько раз уменьшилась при этом средняя кинетическая энергия теплового движения молекул аргона?
уменьшилась в
раз(-а)
КЭС: 2.1.8 Связь температуры газа со средней кинетической энергией поступательного теплового движения его молекул
Тип ответа: Краткий ответ
Ответ:
4
Внутренняя энергия:
`U = 3/2*ν*RT`,
где
ν – количество вещества,
T - температура газа.
R - Универсальная газовая постоянная
Как видим из формулы увеличение температуры прямо пропорционально увеличению энергии.
Значит уменьшилась также в 4 раза
Номер: A71656
Впишите правильный ответ.
Цилиндрический сосуд разделён неподвижной перегородкой на две части.
В одной части сосуда находится гелий, в другой – неон. Концентрации газов одинаковы. Средние кинетические энергии теплового движения молекул газов равны. Определите отношение давления гелия к давлению неона.
КЭС: 2.1.6 Связь между давлением и средней кинетической энергией поступательного теплового движения молекул идеального газа (основное уравнение МКТ)
Тип ответа: Краткий ответ
Ответ:
1
Так как газы уравновешивают друг друга по давлению, значит количество вещества в половинах одинаковы, так как все показатели равнозначны, а из закона Авогадро следует, что при равных условиях в одном объеме содержание количества разных газов одинаковое. В итоге получается массовое количество вещества одинаковое, значит и энергии одинаковые. Значит соотношение равно 1/1=1
Номер: 95F351
Впишите правильный ответ.
Давление разреженного газа в сосуде возросло в 4 раза, а средняя энергия поступательного теплового движения его молекул уменьшилась в 2 раза.
Во сколько раз увеличилась концентрация молекул газа в сосуде?
в
раз(а)
КЭС: 2.1.6 Связь между давлением и средней кинетической энергией поступательного теплового движения молекул идеального газа (основное уравнение МКТ)
Тип ответа: Краткий ответ
Ответ:
8
При падении тепловой энергии в два раза температура падает в 2 раза из формулы
`U = 3/2*ν*RT = (mV^2)/2`,
где
ν – количество вещества,
T - температура газа.
R - Универсальная газовая постоянная
При этом давление возросло в 4 раза, тогда согласно
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
получается, что
`4p = (νRT/2)/V`
надо привести к виду `p = (νRT)/V` за счет коэффициента к значению ν. Как видим это значение 8.
`4p = (8νRT/2)/V`
Ответ: 8
Номер: 66BE55
Впишите правильный ответ.
В закрытом сосуде под поршнем находится водяной пар при температуре
100 °С под давлением 40 кПа. Каким станет давление пара, если, сохраняя его температуру неизменной, уменьшить объём пара в 4 раза?
кПа
КЭС: 2.1.13 Насыщенные и ненасыщенные пары. Качественная зависимость плотности и давления насыщенного пара от температуры, их независимость от объёма насыщенного пара
Тип ответа: Краткий ответ
Ответ:
100
Так как температура T=const (неизменная), то можно записать равенство:
`p_1V_1=p_2V_2`
Получаем
`p_1=40 кПа; V_2=V_1/4`
Тогда
`p_2=p_1 * V_1/V_2=p_1 * V_1/(V_1/4)=4p_1=4*40=160 кПа`
Однако, учитывая, что при температуре 100 °С давление насыщенного пара равно 100 кПа, то при достижении этой отметки давление дальше расти не будет, пар станет насыщенным и его часть будет конденсироваться (переходить в жидкое состояние).
Ответ: 100кПа
Номер: 82225A
Впишите правильный ответ.
Один моль идеального газа участвует в процессе 1–2–3, график которого изображён на рисунке в координатах p–T, где p – давление газа, T – абсолютная температура газа.
Как изменяются объём газа V в ходе процесса 1–2 и концентрация молекул газа n в ходе процесса 2–3? Масса газа остаётся постоянной.
Для каждой величины определите соответствующий характер изменения:
1) увеличивается
2) уменьшается
3) не изменяется
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Объём газа в ходе процесса 1–2/ Концентрация молекул газа в ходе процесса 2–3
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Тип ответа: Краткий ответ
Ответ:
23
1-2 Температура падала, давление сохранялось, значит объем уменьшался.
2-3, температура падала, давление тоже, значит шел линейный процесс без изменения остальных параметров, то есть концентрация не изменялась, вместе с объемом.
Номер: 4EE1A0
Впишите правильный ответ.
Во сколько раз увеличится давление идеального газа, если его абсолютная температура будет увеличена в 2 раза и концентрация частиц будет увеличена в 2 раза?
в
раз(а)
КЭС: 2.1.9 Уравнение p=nkT
Тип ответа: Краткий ответ
Ответ:
4
Давление газа
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
получается, что увеличивая температуру и концентрацию в 2 раза, мы получаем увеличения давления на коэффициент 2*2=4 раза
Номер: 7D6DA1
Впишите правильный ответ.
В сосуде содержится разреженный аргон, абсолютная температура которого равна 150 К. Концентрацию аргона уменьшили в 2 раза, при этом его давление увеличилось в 3 раза. Определите абсолютную температуру газа в конечном равновесном состоянии.
К
КЭС:
2.1.9 Уравнение p=nkT
Тип ответа: Краткий ответ
Ответ:
900
Давление газа
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
получается, что уменьшая концентрацию мы уменьшили давление в 2 раза, однако оно поднялось в 3, то есть в итоге изменение Т которая как раз могла повлиять на давление произошло 2*3=6 раз.
150*6=900 К
Номер: 772AAE
Впишите правильный ответ.
Для плавления куска льда при температуре его плавления требуется количество теплоты, равное 3 кДж. Этот кусок льда внесли в тёплое помещение. Зависимость температуры льда от времени представлена на рисунке. Определите среднюю тепловую мощность, подводимую к куску льда в процессе плавления.
Вт
КЭС: 2.1.16 Изменение агрегатных состояний вещества: плавление и кристаллизация
Тип ответа: Краткий ответ
Ответ:
5
Получается 3 кДж потратили на плавление куска льда за 15-5=10 минут.
Мощность это работа совершенная за время. Нам надо выразить ее в Вт, а Вт это количество энергии в Джоулях потраченные в секунду. Тогда,
Р=A/t
10*60=600 секунд
P = 3000/600=5 Дж/с столько тратили каждую секунду и столько Вт была подводимая мощность.
Ответ: 5 Вт.
Номер: 5745AB
Впишите правильный ответ.
В сосуде под подвижным поршнем находятся вода и её насыщенный пар. Объём пара медленно увеличили в 3 раза при постоянной температуре так, что в сосуде ещё оставалась вода. Определите отношение концентрации молекул пара в конце процесса к концентрации молекул пара в начале процесса.
КЭС: 2.1.14 Влажность воздуха
Тип ответа: Краткий ответ
Ответ:
1
Получается у нас рос объем и сохранялось давление, так как газ был под свободным поршнем.
При этом концентрация пара оставалась та же, значит если взять равные объемы и сравнить их, то будет 1/1=1 одно и тоже количество концентрации пара в одном объеме.
Номер: 5EA5A3
Впишите правильный ответ.
Разреженный водород изотермически сжали. Масса газа постоянна. Давление газа на стенки сосуда увеличилось при этом в 5 раз. Во сколько раз уменьшился объём газа?
в
раз(-а)
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Тип ответа: Краткий ответ
Ответ:
5
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
Как видим из формулы если изменить давление в 5 раз при неизменной Т, то надо обратно пропорционально изменить объем в то же количество раз.
Номер: A11EAF
Впишите правильный ответ.
Запишите показания барометра с учётом абсолютной погрешности измерений. Верхняя шкала барометра проградуирована в кПа, нижняя – в мм рт. ст. Абсолютная погрешность прямого измерения барометра равна цене деления барометра.

Ответ: ( ± ) мм рт. ст.
КЭС: 2.1 Молекулярная физика
Тип ответа: Краткий ответ
Ответ:
7551
755 - номинал
1- погрешность
Номер: AF97AC
Впишите правильный ответ.
Ученику необходимо на опыте обнаружить зависимость объёма газа, находящегося в сосуде под подвижным поршнем, от температуры газа.
У него имеется пять различных сосудов с манометрами. Сосуды наполнены одним и тем же газом при различных температуре и давлении (см. таблицу).
Какие два сосуда необходимо взять ученику, чтобы провести данное исследование?
|
№№ сосуда |
Давление, кПа |
Температура газа |
Масса газа, г |
|
1 |
200 |
25 |
4 |
|
2 |
260 |
30 |
8 |
|
3 |
260 |
30 |
6 |
|
4 |
300 |
35 |
6 |
|
5 |
200 |
35 |
4 |
В ответ запишите номера выбранных сосудов.
Ответ:
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Тип ответа: Краткий ответ
Ответ:
15
Берем равные объемы, равное давление, так как все находится в сосуде с подвижным поршнем, но разные температуры.
Номер: A009A3
Впишите правильный ответ.
Концентрацию атомов аргона уменьшили в 6 раз. Давление газа при этом снизилось в 2 раза. Во сколько при этом раз увеличилась средняя кинетическая энергия теплового движения атомов аргона?
в
раз(а)
КЭС: 2.1.6 Связь между давлением и средней кинетической энергией поступательного теплового движения молекул идеального газа (основное уравнение МКТ)
Тип ответа: Краткий ответ
Ответ:
3
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
Как видим из формулы если изменить концентрацию в 6 раз, а давление изменится лишь в 2 раза, то необходимо будет компенсировать давление путем поднятия Т.
6/2=3 в 3 раза.
При этом тепловая энергия прямо пропорциональна давлению, это по формуле:
`p = 2/3*n*E`
E - энергия молекул
,а давление температуре
p = nkT, где
р — давление,
n — число частиц в единице объёма,
k — Больцмана постоянная,
Т — абсолютная температура.
Значит тепловая энергия изменится в 3 раза.
Номер: 63F2AD
Впишите правильный ответ.
С помощью барометра проводились измерения атмосферного давления. Верхняя шкала барометра проградуирована в килопаскалях, а нижняя шкала – в миллиметрах ртутного столба (см. рисунок). Погрешность измерений давления равна цене деления шкалы барометра. Чему равно атмосферное давление в миллиметрах ртутного столба по результатам этих измерений?

Ответ: ( ± ) мм рт. ст.
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Тип ответа: Краткий ответ
Ответ:
7451
745 - номинал
1 - погрешность
Номер: 35EAA7
Впишите правильный ответ.
При понижении абсолютной температуры средняя кинетическая энергия хаотического теплового движения молекул разреженного одноатомного газа уменьшилась в 3 раза. Начальная температура газа 600 К. Какова конечная температура газа?
К
КЭС: 2.1.7 Абсолютная температура
Тип ответа: Краткий ответ
Ответ:
200
Давление прямо пропорциональна энергии:
`p = 2/3*n*E`
E - энергия молекул
то есть давление снизилось также в 3 раза
Давление газа
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
Как видим снижение давления из-за температуры пропорционально самой температуре.
Значит 600/3=200 К была начальная температура.
Ответ: 200 К
Номер: 4BADC2
Впишите правильный ответ.
Концентрацию молекул идеального одноатомного газа уменьшили в 5 раз. Одновременно в 2 раза уменьшили абсолютную температуру газа. Во сколько раз в результате этого снизилось давление газа в сосуде?
в
раз(-а)
КЭС: 2.1.9 Уравнение p=nkT
Тип ответа: Краткий ответ
Ответ:
10
Давление газа
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
Как видим снижение давления из-за температуры и концентрации пропорционально самой температуре.
Значит 5*2=10 раз
Ответ: 10
Номер: F0E1C0
Впишите правильный ответ.
Ученику необходимо на опыте обнаружить зависимость давления газа, находящегося в сосуде, от массы газа. У него имеются пять различных сосудов с манометрами. Сосуды наполнены аргоном разной массы при различных температурах (см. таблицу). Какие два сосуда необходимо взять ученику, чтобы провести исследование?
|
№ сосуда |
Объём сосуда, л |
Температура газа |
Масса газа в сосуде, г |
|
1 |
6 |
320 |
10 |
|
2 |
4 |
350 |
6 |
|
3 |
6 |
320 |
8 |
|
4 |
4 |
340 |
6 |
|
5 |
5 |
300 |
10 |
Запишите в таблицу номера выбранных сосудов.
Ответ:
КЭС: 2.1 Молекулярная физика
Тип ответа: Краткий ответ
Ответ:
13
Так как надо проследить зависимость давления от массы, то берем разную температуру при равных объемах и температурах. Это 13.
Номер: 7CB1CE
Впишите правильный ответ.
В закрытом сосуде под поршнем находится влажный воздух при температуре 100 °С. Парциальное давление водяного пара в сосуде равно 60 кПа. Какова относительная влажность воздуха в сосуде?
%
КЭС: 2.1.13 Насыщенные и ненасыщенные пары. Качественная зависимость плотности и давления насыщенного пара от температуры, их независимость от объёма насыщенного пара
Тип ответа: Краткий ответ
Ответ:
60
Относительную влажность воздуха можно найти по формуле:
`φ = ρ_1/ρ_2*100%`
где p1 - парциальное давление газа; p2 - равновесное давление насыщенного пара. Так как при 100 °С происходит кипение воды, а значит, давление ее насыщенных паров равно атмосферному давлению (при нормальных условиях это значение 105 Па). Подставляем это значение и находим относительную влажность воздуха в сосуде:
`φ = (60*10^3)/(10^5)*100% = 60%`
Ответ: 60%
Номер: 707DC8
Впишите правильный ответ.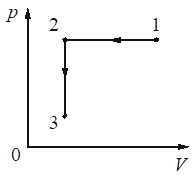
1 моль одноатомного идеального газа участвует в процессе 1–2–3, график которого изображён на рисунке в координатах p–V, где p – давление газа, V – объём газа. Как изменяются плотность ρ газа в ходе процесса 1–2 и абсолютная температура Т газа в ходе процесса 2–3? Масса газа остаётся постоянной.
Для каждой величины определите соответствующий характер изменения:
1) увеличивается
2) уменьшается
3) не изменяется
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Плотность газа в ходе процесса 1–2/ Абсолютная температура газа в ходе процесса 2–3
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Тип ответа: Краткий ответ
Ответ:
12
В процессе 12 происходит падение температуры с уменьшением объема, что позволяет сохранить давление.
В процессе 23 происходит падение температуры с сохранением объема, что снижает давление.
Номер: B635CA
Впишите правильный ответ.
Относительная влажность воздуха в сосуде, закрытом поршнем, равна 40%. Какой станет относительная влажность воздуха в сосуде, если его объём при неизменной температуре уменьшить в 2 раза?
%
КЭС: 2.1.14 Влажность воздуха
Тип ответа: Краткий ответ
Ответ:
80
Относительную влажность воздуха можно найти по формуле:
`φ = ρ_1/ρ_2*100%`
где p1 - парциальное давление газа;
p2 - равновесное давление насыщенного пара.
По закону Бойля-Мариотта, при постоянной температуре, зависимость давления газа от объема будет выглядеть так:
`p_ 0V_0 = p_1V_1`
Тогда, при изменении объема сосуда, новое давление будет равно:
`p_ 1 = (p_0V_0)/V_1=(p_0V_0)/(V_0/2)=2(p_0V_0)/V_0=2p_0`
Значит, давление увеличится в 2 раза. Тогда влажность воздуха равна:
`φ = 2p_0/p_н*100%=2φ=80%`
Ответ: 80 %
Номер: 8A8EC1
Впишите правильный ответ.
В сосуде неизменного объёма находится разреженный газ в количестве 3 моль. Во сколько раз уменьшится давление газа в сосуде, если выпустить из сосуда 2 моль газа, а абсолютную температуру оставшегося газа уменьшить в 2 раза?
в
раз(а)
КЭС: 2.1.9 Уравнение p=nkT
Тип ответа: Краткий ответ
Ответ:
6
Давление газа
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
Снизим количество вещества в 3 раза (3-2=1, а 3/1=3 ), а потом Т в 2 раза.
Значит у нас два показателя которые уменьшают давление, тогда 3*2=6 раз
Ответ: 6
Номер: 8BADC9
Впишите правильный ответ.
Концентрация молекул разреженного газа в сосуде была увеличена вдвое, а абсолютная температура газа была уменьшена в 4 раза. Во сколько раз при этом уменьшилось давление газа?
в
раз(а)
КЭС: 2.1.9 Уравнение p=nkT
Тип ответа: Краткий ответ
Ответ:
2
Давление газа
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
Увеличим количество вещества в 2 раза, а потом уменьшим Т в 2 раза.
Значит у нас два показателя, один из них увеличивает давление (это количество вещества), а второй уменьшает (снижение температуры).
Тогда 1 * 1/4 * 2 = 1/2, то есть уменьшение произойдет в два раза.
Ответ: 2
Номер: 87FFC6
Впишите правильный ответ.
Концентрация атомов гелия, находящегося в сосуде под подвижным поршнем, увеличилась в 6 раз. Давление газа при этом возросло в 2 раза. Во сколько раз уменьшилась при этом средняя энергия теплового движения атомов гелия?
в
раз(-а)
КЭС: 2.1.6 Связь между давлением и средней кинетической энергией поступательного теплового движения молекул идеального газа (основное уравнение МКТ)
Тип ответа: Краткий ответ
Ответ:
3
Давление газа
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
Как видим из формулы количество увеличилась в 6 раз, а итоговое давление в 2 раза, значит в 3 раза увеличился объем или снизилась Т. Собственно так как нас устоит любой из вариантов, то возьмем зависимость от Т (хотя от давления будет тоже самое), а здесь из формулы `U = 3/2*ν*RT`
мы видим что зависимость энергии от Т прямая. Значит именно в 3 раза и изменится энергия.
Ответ: 3
Номер: 4D0A9D
Впишите правильный ответ.
Ученику необходимо на опыте обнаружить зависимость давления газа, находящегося в сосуде, от объёма газа. У него имеются пять различных сосудов с манометрами. Сосуды наполнены различными газами при различных температурах (см. таблицу). Массы газов одинаковы. Какие два сосуда необходимо взять ученику, чтобы провести исследование?
|
№ сосуда |
Объём |
Температура газа |
Газ в сосуде |
|
1 |
8 |
300 |
неон |
|
2 |
10 |
180 |
аргон |
|
3 |
8 |
320 |
аргон |
|
4 |
12 |
300 |
неон |
|
5 |
6 |
280 |
аргон |
Запишите в ответе номера выбранных сосудов.
Ответ:
КЭС: 2.1 Молекулярная физика
Тип ответа: Краткий ответ
Ответ:
14
Берем один и тот же газ с одной температурой, но в разном объеме.
Номер: 4C039C
Впишите правильный ответ.
В результате охлаждения разреженного одноатомного газа его абсолютная температура уменьшилась в 4 раза. Во сколько раз уменьшилась при этом среднеквадратичная скорость теплового движения молекул газа?
в
раз(а)
КЭС: 2.1.8 Связь температуры газа со средней кинетической энергией поступательного теплового движения его молекул
Тип ответа: Краткий ответ
Ответ:
2
Внутренняя энергия:
`U = 3/2*ν*RT = (mV^2)/2`,
где
ν – количество вещества,
T - температура газа.
R - Универсальная газовая постоянная
Как видим из формулы, уменьшение температуры в 4 раза повлияет на уменьшение энергии в 4 раза. Однако скорость молекул можно уменьшить в 2 раза, чтобы также снизить энергию в 4 раза. Значит между температурой и скорость зависимость тоже квадратичная. То есть √4=2
Ответ: 2
Номер: 02219A
Впишите правильный ответ.
Вещество массой 0,5 кг находится в сосуде под поршнем. На рисунке показан график изменения температуры t вещества по мере поглощения им теплоты Q. Первоначально вещество было в жидком состоянии. Какова удельная теплота парообразования вещества?
кДж/кг
КЭС: 2.1.15 Изменение агрегатных состояний вещества: испарение и конденсация, кипение жидкости
Тип ответа: Краткий ответ
Ответ:
300
Для изменения состояния вещества ушло 2-0,5=1,5*105 Дж энергии. При этом на 1 кг ушло бы в 2 раза больше, так как речь идет о 0,5 кг, то есть 1,5*2=3*105 Дж=300 кДж.
Ответ: 300 кДж
Номер: 7DA290
Впишите правильный ответ.
Детский тёмно-зелёный воздушный шарик надули в тени под деревом, а затем вынесли на солнечный пляж. Как начали при этом изменяться объём воздуха в шарике и средняя кинетическая энергия молекул в шарике? Оболочка шарика тонкая, упругая и мягкая.
Для каждой величины определите соответствующий характер изменения:
1) увеличивается
2) уменьшается
3) не изменяется
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Объём воздуха в шарике/ Средняя кинетическая энергия молекул
КЭС: 2.1.10 Модель идеального газа в термодинамике
Тип ответа: Краткий ответ
Ответ:
11
На солнце шарик начал нагреваться, энергия молекул увеличиваться, а вместе с тем увеличиваться и объем шарика.
Номер: 72EF92
Впишите правильный ответ.
В сосуде неизменного объёма находится разреженный газ в количестве 3 моль. Во сколько раз изменится давление газа в сосуде, если выпустить из него 1 моль газа, а абсолютную температуру газа уменьшить в 2 раза?
в
раз(-а)
КЭС: 2.1.9 Уравнение p=nkT
Тип ответа: Краткий ответ
Ответ:
3
Давление газа
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
Как видим из формулы если количество уменьшилось на 1 моль, то он уменьшилось в 2/3 раза (так как 3/3=1). Температура уменьшена в 2 раза. В итоге получаем.
2/3 * 1/2 = 2/(3*2)=1/3 То есть третья часть от первоначального давления.
Ответ: 3
Номер: 199792
Впишите правильный ответ.
Из металлического баллона, в котором находилось 3 моль идеального газа под давлением 3⋅105 Па, медленно, без изменения температуры выпустили 0,6 моль газа. Определите давление газа в конечном состоянии.
кПа
КЭС: 2.1.10 Модель идеального газа в термодинамике
Тип ответа: Краткий ответ
Ответ:
240
Давление газа
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
Из формулы видно, что изменение количества вещества пропорциональны давлению.
3/0,6=5 часть
`p = 3⋅10^5 - (3 * 10^5)/5 = 2,4 * 10^5 Па = 240 кПа`
Номер: A1DD9C
Впишите правильный ответ.
Относительная влажность воздуха в закрытом сосуде равна 40%. Какой будет относительная влажность воздуха в сосуде, если при неизменной температуре уменьшить объём сосуда в 1,5 раза?
%
КЭС: 2.1.16 Изменение агрегатных состояний вещества: плавление и кристаллизация
Тип ответа: Краткий ответ
Ответ:
60
Относительную влажность воздуха можно найти по формуле:
`φ = ρ_1/ρ_2*100%`
То есть нам надо понять каким станет давление. А по формуле
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
Давление при уменьшении объема в 1,5 увеличиться в 1,5 раза.
По закону Бойля-Мариотта, при постоянной температуре, зависимость давления газа от объема будет выглядеть так:
`p_ 0V_0 = p_1V_1`
Тогда, при изменении объема сосуда, новое давление будет равно:
`p_ 1 = (p_0V_0)/V_1=(p_0V_0)/(V_0/(1,5))=2(p_0V_0)/V_0=1,5p_0`
Значит, давление увеличится в 1,5 раза. Тогда влажность воздуха равна:
`φ = 1,5p_0/p_н*100%=1,5φ=60%`
Ответ: 60%
Номер: 6AEE90
Впишите правильный ответ.
Идеальный газ в количестве 5 моль нагревается от t1 = 127 °С до t2 = 227 °С в сосуде постоянного объёма. Чему равно отношение давлений `p_1/p_2`
идеального газа?
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Тип ответа: Краткий ответ
Ответ:
0,8
При изохорном процессе по закону Шарля:
`p_1/p_2 = T_1/T_2`
Температуру переводи в Кельвины +273 к Цельсия
`p_1/p_2 = (127+273)/(227+273)=400/500=0,8`
Ответ: 0,8
Номер: 349197
Впишите правильный ответ.
Ученику необходимо на опыте обнаружить зависимость давления газа, находящегося в сосуде, от объёма сосуда. У него имеется пять различных сосудов с манометрами. Сосуды наполнены равными массами различных газов при различной температуре (см. таблицу). Какие два сосуда необходимо взять ученику, чтобы провести данное исследование?
|
№ сосуда |
Объём сосуда, л |
Температура газа в сосуде, К |
Газ в сосуде |
|
1 |
5 |
290 |
гелий |
|
2 |
3 |
290 |
гелий |
|
3 |
3 |
290 |
азот |
|
4 |
3 |
320 |
азот |
|
5 |
5 |
320 |
гелий |
Запишите в ответе номера выбранных сосудов.
Ответ:
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Тип ответа: Краткий ответ
Ответ:
12
Берем разные объемы сосуда для одного газа, но одинаковую Т.
Номер: F443ED
Впишите правильный ответ.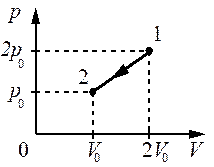
На pV-диаграмме представлен процесс перехода некоторого постоянного количества идеального газа из состояния 1 в состояние 2. Какова температура газа в состоянии 2, если в состоянии 1 она равна 1000 К?
К
КЭС: 2.1.10 Модель идеального газа в термодинамике
Тип ответа: Краткий ответ
Ответ:
250
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
Уменьшение объема в два раза должно было повлечь увеличение p в два раза. Но у нас давление снизилось в 2 раза. Получается температура снизилась 2*2=4 раза
1000/4=250 К
Ответ: 250 К
Номер: B0ADE8
Впишите правильный ответ.
Один моль одноатомного идеального газа участвует в процессе 1– 2– 3, график которого изображён на рисунке в координатах p– V, где p – давление газа, V – объём газа. Как изменяются абсолютная температура газа Т в ходе процесса 1– 2 и плотность газа ρ в ходе процесса 2– 3? Масса газа остаётся постоянной.
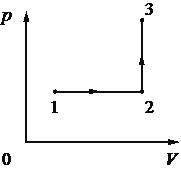
Для каждой величины определите соответствующий характер изменения:
1) увеличивается
2) уменьшается
3) не изменяется
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Абсолютная температура
газа в ходе процесса 1– 2
Плотность газа
в ходе процесса 2– 3
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Тип ответа: Краткий ответ
Ответ:
13
В процессе 12 объем увеличиваем, сохраняя давление, значит растет Т.
В процессе 23 объем сохраняем, но меняется давление, значит растет энергия молекул, но плотность не меняется, так как нет изменения объема.
Номер: 24F2EB
Впишите правильный ответ.
Чему равно давление насыщенных водяных паров при температуре 24 °С, если при относительной влажности воздуха 60% парциальное давление водяного пара при этой температуре равно 1,8 кПа?
кПа
КЭС: 2.1.14 Влажность воздуха
Тип ответа: Краткий ответ
Ответ:
3
Относительную влажность воздуха можно найти по формуле:
`φ = ρ_1/ρ_2*100%`
В нашем случае получается, что при влажности в 60 процентов имеем давление 1,8 кПа, само собой давление будет расти при увеличении влажности пропорционально. Температура для нас не интересный показатель, его не принимаем во внимание так как считаем что она постоянная. А вот рост давления зависит от влажности, причем нам надо узнать давление при влажности в 100 процентов.
То есть р = 1800/60=30 Па будет давать увеличение влажности на 1 процент. В нашем случае при насыщенном паре это 100 процентный пар.
30*100=3000 Па = 3 кПа
Ответ: 3 кПа
Номер: DF53E0
Впишите правильный ответ.
В воздухе школьного класса при относительной влажности 20% парциальное давление водяного пара равно 800 Па. Определите давление насыщенного водяного пара при данной температуре.
Па
КЭС: 2.1.14 Влажность воздуха
Тип ответа: Краткий ответ
Ответ:
4000
В нашем случае получается, что при влажности в 20 процентов имеем давление 0,8 кПа, само собой давление будет расти при увеличении влажности пропорционально. Температура для нас не интересный показатель, его не принимаем во внимание так как считаем что она постоянная. А вот рост давления зависит от влажности, причем нам надо узнать давление при влажности в 100 процентов.
То есть р = 800/20=40 Па будет давать увеличение влажности на 1 процент. В нашем случае при насыщенном паре это 100 процентный пар.
40*100=4000 Па
Ответ: 4000
Номер: 94F2EC
Впишите правильный ответ.
Относительная влажность воздуха в сосуде, закрытом поршнем, равна 24%. Какой станет относительная влажность воздуха в сосуде, если объём сосуда при неизменной температуре увеличить в 3 раза?
%
КЭС: 2.1.14 Влажность воздуха
Тип ответа: Краткий ответ
Ответ:
8
Влажность упадет прямо пропорционально объему, так как упадет давление. Это следует из формул:
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
и
Относительную влажность воздуха можно найти по формуле:
`φ = ρ_1/ρ_2*100%`
24/3=8%
Ответ: 8%
Номер: E51EE2
Впишите правильный ответ.
При увеличении абсолютной температуры средняя кинетическая энергия хаотического теплового движения молекул разреженного одноатомного газа увеличилась в 3 раза. Конечная температура газа 450 К. Какова начальная температура газа?
К
КЭС: 2.1.7 Абсолютная температура
Тип ответа: Краткий ответ
Ответ:
150
`U = 3/2*ν*RT`,
где
ν – количество вещества,
T - температура газа.
R - Универсальная газовая постоянная
Из формулы видно, что увеличение энергии прямо пропорционально температуре. Тогда 450/3=150 К
Ответ: 150 К
Номер: EBBFEA
Впишите правильный ответ.
Одноатомный идеальный газ в цилиндре переводится из состояния А в состояние В так, что его масса при этом не изменяется. Параметры, определяющие состояния газа, приведены в таблице.
|
|
р, 105 Па |
V, 10–3 м3 |
T, К |
|
состояние А |
|
4 |
300 |
|
состояние В |
4 |
2 |
600 |
Какое число следует внести в свободную клетку таблицы?
КЭС: 2.1.10 Модель идеального газа в термодинамике
Тип ответа: Краткий ответ
Ответ:
1
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
1 этап перехода из состояния А в И. Мы уменьшаем объем в два раза, получаем при той же температуре большее давление в два раза. Затем поднимаем температуру. Получаем давление еще в два раза выше. Итого 2*2 = 4 во столько раз у нас понялось давление.
4/4=1
Ответ: 1
Номер: 6F15E5
Впишите правильный ответ.
Необходимо на опыте обнаружить зависимость объёма газа, находящегося в сосуде под подвижным поршнем, от внешнего давления. Имеются пять различных сосудов с манометрами. Сосуды наполнены одним и тем же газом при различных температурах и давлениях (см. таблицу). Какие два сосуда необходимо взять ученику, чтобы провести данное исследование?
|
№ сосуда |
Давление, кПа |
Температура газа |
Масса газа, г |
|
1 |
60 |
80 |
10 |
|
2 |
100 |
100 |
10 |
|
3 |
80 |
60 |
5 |
|
4 |
90 |
80 |
15 |
|
5 |
100 |
60 |
5 |
Запишите в таблицу номера выбранных сосудов.
Ответ:
КЭС: 2.1.10 Модель идеального газа в термодинамике
Тип ответа: Краткий ответ
Ответ:
35
Берем равную температуру, равные объемы, но разное давление. В итоге Должны наблюдать разный объем, но он не приведен в таблице.
Номер: FF186D
Впишите правильный ответ.
В воздухе комнаты при относительной влажности 40% парциальное давление водяного пара равно 980 Па. Определите давление насыщенного водяного пара при данной температуре.
Па
КЭС: 2.1.14 Влажность воздуха
Тип ответа: Краткий ответ
Ответ:
2450
В нашем случае получается, что при влажности в 40 процентов имеем давление 0,98 кПа, само собой давление будет расти при увеличении влажности пропорционально. Температура для нас не интересный показатель, его не принимаем во внимание так как считаем что она постоянная. А вот рост давления зависит от влажности, причем нам надо узнать давление при влажности в 100 процентов.
То есть р = 980/40=24,5 Па будет давать увеличение влажности на 1 процент. В нашем случае при насыщенном паре это 100 процентный пар.
24,5*100=2450 Па
Ответ: 2450
Номер: FDEF65
Впишите правильный ответ.
В закрытом баллоне находится воздух при температуре 300 К и давлении 100 кПа. Баллон нагрели до 450 К. Определите давление воздуха в баллоне в результате нагревания.
кПа
КЭС: 2.1.10 Модель идеального газа в термодинамике
Тип ответа: Краткий ответ
Ответ:
150
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
Объем не меняется, количество вещества тоже, значит тогда изменение Т прямо пропорционально давлению.
450/300=1,5
1,5 * 100 = 150 кПа
Ответ: 150
Номер: 7F8167
Впишите правильный ответ.
Во сколько раз увеличится давление разреженного газа, если при увеличении концентрации молекул газа в 4,5 раза его абсолютная температура уменьшится в 1,5 раза?
в
раз(а)
КЭС: 2.1.9 Уравнение p=nkT
Тип ответа: Краткий ответ
Ответ:
3
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
`p_1 = (*4,5νRT)/(V/(1,5)) = 3 (νRT)/V`
То есть в 3 раза.
Ответ: 3
Номер: B1BE6D
Впишите правильный ответ.
На рисунке представлен график зависимости объёма идеального газа от его температуры в некотором процессе. В состоянии 1 давление газа было равно нормальному атмосферному давлению. Какое давление соответствует состоянию 2, если масса газа остаётся неизменной?
кПа
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Тип ответа: Краткий ответ
Ответ:
25
Давление газа можно вычислить по формулам:
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
При увеличении объема давления должно падать пропорционально объему.
100/4=25 кПа.
Ответ: 25
Номер: B86966
Впишите правильный ответ.
Ученику необходимо на опыте обнаружить зависимость давления газа, находящегося в сосуде, от массы газа. У него имеются пять различных сосудов с манометрами. Сосуды наполнены аргоном разной массы при различной температуре (см. таблицу). Какие два сосуда необходимо взять ученику, чтобы провести данное исследование?
|
№ сосуда |
Объём сосуда, л |
Температура газа |
Масса газа в сосуде, г |
|
1 |
6 |
320 |
5 |
|
2 |
5 |
350 |
8 |
|
3 |
4 |
320 |
10 |
|
4 |
4 |
270 |
8 |
|
5 |
4 |
320 |
5 |
Запишите в таблицу номера выбранных сосудов.
Ответ:
КЭС: 2.1.10 Модель идеального газа в термодинамике
Тип ответа: Краткий ответ
Ответ:
35
Берем одинаковый объем и одинаковую Т, но разную массу.
Номер: D0DD68
Впишите правильный ответ.
Относительная влажность воздуха в сосуде, закрытом поршнем, равна 30%. Какой станет относительная влажность воздуха в сосуде, если при неизменной температуре перемещением поршня уменьшить объём сосуда в 2 раза?
%
КЭС: 2.1.14 Влажность воздуха
Тип ответа: Краткий ответ
Ответ:
60
Относительную влажность воздуха можно найти по формуле:
`φ = ρ_1/ρ_2*100%`
Влажность воздуха изменится обратно пропорционально изменению давления. А давление меняется пропорционально объему. То есть уменьшая в 2 раза объем увеличиваем влажность в два раза.
30*2=60%
Ответ: 60%
Номер: 502F6F
Впишите правильный ответ.
Цилиндрический сосуд разделён лёгким подвижным поршнем на две части.
В одной части сосуда находится неон, в другой – аргон. Температуры газов одинаковы. Определите отношение концентрации молекул неона к концентрации молекул аргона в равновесном состоянии.
КЭС: 2.1.6 Связь между давлением и средней кинетической энергией поступательного теплового движения молекул идеального газа (основное уравнение МКТ)
Тип ответа: Краткий ответ
Ответ:
1
Так как газы уравновешивают друг друга по давлению, значит количество вещества в половинах одинаковы, так как все показатели равнозначны, а из закона Авогадро следует, что при равных условиях в одном объеме содержание количества разных газов одинаковое. В итоге получается массовое количество вещества одинаковое, значит и энергии одинаковые. Значит соотношение равно 1/1=1
Номер: 51DB62
Впишите правильный ответ.
Разреженный кислород в количестве 15 моль изотермически расширяется. Во сколько раз уменьшится давление газа на стенки сосуда при увеличении его объёма в 3 раза?
в
раз(а)
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Тип ответа: Краткий ответ
Ответ:
3
Давление газа можно вычислить по формулам:
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
Давление меняется обратно пропорционально объему. То есть также в 3 раза
Номер: C7526A
Впишите правильный ответ.
На фотографии изображён спиртовой термометр со шкалой Цельсия. Погрешность измерения температуры при помощи этого термометра равна половине цены деления. Определите абсолютную температуру спирта в колбе термометра.
Ответ: ( ± ) К.
КЭС: 2.1.7 Абсолютная температура
Тип ответа: Краткий ответ
Ответ:
2932,5
Цена деления термометра равна 5 °С. Тогда погрешность измерения температуры равна 5/2=2,5 К
T = 273+20=293 К
*2932,5 не подходит по ФИПИ. В чем дело, где ошибка??
Номер: E1896D
Впишите правильный ответ.
С помощью барометра проводились измерения атмосферного давления. Верхняя шкала барометра проградуирована в килопаскалях, а нижняя шкала – в миллиметрах ртутного столба (см. рисунок). Погрешность измерений давления равна цене деления шкалы барометра. Чему равно атмосферное давление в килопаскалях по результатам этих измерений?

Ответ: ( ± ) кПа.
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Тип ответа: Краткий ответ
Ответ:
99,30,1
99,3 - номинал
0,1 - погрешность
Номер: ECB765
Впишите правильный ответ.
Разреженный воздух в цилиндре переводится из состояния А в состояние В, причём его масса не изменяется. Параметры, определяющие состояния воздуха, приведены в таблице.
|
|
р, 105 Па |
V, 10–3 м3 |
T, К |
|
состояние А |
1,0 |
4 |
300 |
|
состояние В |
0,5 |
|
600 |
Какое число следует внести в свободную клетку таблицы?
КЭС: 2.1.10 Модель идеального газа в термодинамике
Тип ответа: Краткий ответ
Ответ:
16
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
Первоначально рассмотрим графу давления. Его снизили в два раза, значит объем должны увеличить в два раза.
Теперь посмотрим графу температура, ее увеличили в два раза, значит опять же объем должны увеличить в два раза.
В итоге получаем 4*2*2=16
Номер: 6AB76B
Впишите правильный ответ.
С идеальным газом происходит изохорный процесс, в котором в результате увеличения абсолютной температуры газа в 2 раза его давление возросло на 75 кПа. Масса газа постоянна. Каково было первоначальное давление газа?
кПа
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Тип ответа: Краткий ответ
Ответ:
75
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
Из формулы видно, что температура и давление пропорциональны. Значит рост давления был в два раза.
2х=75+х
х = 75 кПа
Ответ: 75
Номер: 67AF6A
Впишите правильный ответ.
Один моль одноатомного идеального газа участвует в процессе 1–2–3, график которого изображён на рисунке в координатах V–T, где V – объём газа, T – абсолютная температура газа. Как изменяются концентрация молекул газа n в ходе процесса 1–2 и давление газа p в ходе процесса 2–3? Масса газа остаётся постоянной.
Для каждой величины определите соответствующий характер изменения:
1) увеличивается
2) уменьшается
3) не изменяется
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Концентрация молекул газа
в ходе процесса 1–2
Давление газа
в ходе процесса 2–3
КЭС:
2.1 Молекулярная физика
Тип ответа: Краткий ответ
Ответ:
33
12 Концентрация не меняется, так как не меняется объем, увеличивается лишь энергия молекул.
23 Не изменится, так как рост объема и температуры происходит линейно.
Номер: 8B2869
Впишите правильный ответ.
В сосуде неизменного объёма находится идеальный газ. Как изменятся плотность газа и количество вещества газа в сосуде, если часть газа выпустить из сосуда?
Для каждой величины определите соответствующий характер её изменения:
1) увеличилось
2) уменьшилось
3) не изменилось
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Плотность газа/ Количество вещества газа
КЭС: 2.1.10 Модель идеального газа в термодинамике
Тип ответа: Краткий ответ
Ответ:
22
И плотность и количество вещества уменьшится.
Номер: 8E3266
Впишите правильный ответ.
На графике изображена зависимость объёма неизменной массы разреженного газа от температуры. Изменения происходят в направлении, указанном стрелкой. Какой из участков соответствует изотермическому сжатию газа?
участок
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Тип ответа: Краткий ответ
Ответ:
1
Изотермическое, значит температура не меняется.
Номер: 8E6063
Впишите правильный ответ.
При повышении абсолютной температуры средняя кинетическая энергия хаотического теплового движения молекул разреженного одноатомного газа увеличилась в 3 раза. Начальная температура газа 150 К. Какова конечная температура газа?
К
КЭС:
2.1.8 Связь температуры газа со средней кинетической энергией поступательного теплового движения его молекул
Тип ответа: Краткий ответ
Ответ:
450
Внутренняя энергия:
`U = 3/2*ν*RT `,
где
ν – количество вещества,
T - температура газа.
R - Универсальная газовая постоянная
Как видим энергия и температура величины прямо зависимые. Значит 150*3=450 К
Ответ: 450 К
Номер: 0A2D3E
Впишите правильный ответ.
Относительная влажность воздуха в сосуде, закрытом поршнем, равна 30%. Какой станет относительная влажность воздуха в сосуде, если его объём при неизменной температуре увеличить в 3 раза?
%
КЭС: 2.1.14 Влажность воздуха
Тип ответа: Краткий ответ
Ответ:
10
Водяной пар распределится в объеме. Так как объем в три раза больше, концентрация пара в три раза меньше. 30/3=10 %
Номер: 721035
Впишите правильный ответ.
В сосуде неизменного объёма при комнатной температуре находилась смесь неона и аргона, по 1 моль каждого. Половину содержимого сосуда выпустили, а затем добавили в сосуд 1 моль аргона. Как изменились в результате парциальное давление неона и давление смеси газов, если температура газов в сосуде поддерживалась неизменной?
Для каждой величины определите соответствующий характер изменения:
1) увеличилась
2) уменьшилась
3) не изменилась
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Парциальное давление неона/ Давление смеси газов в сосуде
КЭС: 2.1.10 Модель идеального газа в термодинамике
Тип ответа: Краткий ответ
Ответ:
23
Парциальное давление неона уменьшилось, так как этого газа стало меньше в объеме.
В целом давление газа не изменилось, так как общее количество осталось прежним.
Номер: 77F13C
Впишите правильный ответ.
Тонкая, упругая и мягкая оболочка герметичного воздушного шара наполнена воздухом. Как изменяются с высотой при быстром подъёме температура воздуха и концентрация молекул в шаре? Теплопроводностью оболочки шара пренебречь.
Для каждой величины определите соответствующий характер изменения:
1) увеличивается
2) уменьшается
3) не изменяется
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Температура воздуха/ Концентрация молекул
КЭС: 2.1.10 Модель идеального газа в термодинамике
Тип ответа: Краткий ответ
Ответ:
22
Речь идет о том, что на высоте ниже температура и ниже давление. Исходя из этого шарик должен расширяться и остывать.
Номер: 135B3C
Впишите правильный ответ.
Разреженный гелий в количестве 10 моль изохорно охлаждается. Во сколько раз уменьшится давление газа на стенки сосуда при понижении его абсолютной температуры в 4 раза?
в
раз(а)
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Тип ответа: Краткий ответ
Ответ:
4
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
Из формулы видно, что температура и давление пропорциональны.
Номер: 5B8A38
Впишите правильный ответ.
На рисунке показано изменение состояния идеального газа в количестве 4 моль. Какая температура соответствует состоянию 2?
К
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Тип ответа: Краткий ответ
Ответ:
405
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
Из формулы видно, что температура и давление пропорциональны.
270*1.5=405 К
Номер: CFC43F
Впишите правильный ответ.
При уменьшении абсолютной температуры средняя кинетическая энергия хаотического теплового движения молекул разреженного одноатомного газа уменьшилась в 2 раза. Конечная температура газа равна 250 К. Какова была начальная температура газа?
К
КЭС: 2.1.10 Модель идеального газа в термодинамике
Тип ответа: Краткий ответ
Ответ:
500
Внутренняя энергия:
`U = 3/2*ν*RT `,
где
ν – количество вещества,
T - температура газа.
R - Универсальная газовая постоянная
Как видим энергия и температура величины прямо зависимые. Значит 250*2=500 К
Ответ: 500 К
Номер: 9BE634
Впишите правильный ответ.
Во сколько раз должна уменьшиться абсолютная температура одноатомного идеального газа, чтобы среднеквадратичная скорость теплового движения его молекул уменьшилась в 3 раза?
в
раз(а)
КЭС: 2.1.8 Связь температуры газа со средней кинетической энергией поступательного теплового движения его молекул
Тип ответа: Краткий ответ
Ответ:
9
Внутренняя энергия:
`U = (mV^2)/2`,
где
ν – количество вещества,
T - температура газа.
R - Универсальная газовая постоянная
Как видим из формулы зависимость энергии и скорости квадратичные, то есть изменение скорости влияет на изменение энергии квадратично.
Тогда 3*3=9 раз будет изменение энергии при изменении скорости в 3 раза.
Номер: 918F36
Впишите правильный ответ.
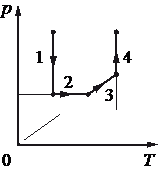
На рисунке приведён график зависимости давления 1 моль разреженного газа от температуры. Изменения происходят в направлении, указанном стрелкой.
Какой из участков соответствует изотермическому расширению газа?
участок
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Тип ответа: Краткий ответ
Ответ:
1
Так как температур не меняется, при это происходит падение давления, то есть увеличивается объем.
Номер: 6D9B38
Впишите правильный ответ.
Концентрация молекул разреженного газа уменьшилась в 3 раза, а средняя кинетическая энергия теплового поступательного движения молекул увеличилась в 6 раз. Во сколько раз повысилось давление газа?
в
раз(а)
КЭС: 2.1.6 Связь между давлением и средней кинетической энергией поступательного теплового движения молекул идеального газа (основное уравнение МКТ)
Тип ответа: Краткий ответ
Ответ:
2
`U = 3/2*ν*RT `,
где
ν – количество вещества,
T - температура газа.
R - Универсальная газовая постоянная
Первоначально энергия при уменьшении Т в 3 раза падает в 3 раза. Затем энергия увеличилась в 6 раз. Получается 1/3*6=2
Ответ: 2
Номер: 3C0734
Впишите правильный ответ.
В сосуде неизменного объёма находилась при комнатной температуре смесь двух идеальных газов, по 2 моль каждого. Половину содержимого сосуда выпустили, а затем добавили в сосуд 1 моль первого газа. Температура в сосуде поддерживалась неизменной. Как изменились в результате проведённых экспериментов парциальное давление первого газа и давление смеси газов?
Для каждой величины определите соответствующий характер изменения:
1) увеличилась
2) уменьшилась
3) не изменилась
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Парциальное давление первого газа / Давление смеси газов
КЭС:
2.1 Молекулярная физика
Тип ответа: Краткий ответ
Ответ:
32
Получается общее количество было 2+2 Из него половину выпустили. 4-2=2 моля осталось. Далее добавили 1 моль первого газа. 2+1=3 моля всего вещества.
То есть первого газа осталось столько же, а вот общее количество вещества уменьшилось.
Номер: 85E437
Впишите правильный ответ.
В закрытом сосуде под поршнем находится водяной пар при температуре 100 °С под давлением 60 кПа. Каким станет давление пара, если, сохраняя его температуру неизменной, уменьшить объём пара в 3 раза?
кПа
КЭС: 2.1.13 Насыщенные и ненасыщенные пары. Качественная зависимость плотности и давления насыщенного пара от температуры, их независимость от объёма насыщенного пара
Тип ответа: Краткий ответ
Ответ:
100
При 100 градусах Цельсия и давлении 100 кПа происходит конденсация воды. В нашем случае уменьшение объема в 3 раза даст давление 60*3=180 кПа, но с момента в 100 кПа будет происходить конденсация, значит это максимально возможное количество давление для пара. Так как молекулы воды из пара будут переходить в жидкость. Условно количество воды в паре будет снижаться за счет конденсации.
Номер: 8C933B
Впишите правильный ответ.
Чему равно атмосферное давление в момент измерения барометром (см. рис), если погрешность прямого измерения давления равна цене деления барометра?

Ответ: ( ± ) мм. рт. ст.
КЭС: 2.1.2 Тепловое движение атомов и молекул вещества
Тип ответа: Краткий ответ
Ответ:
7481
748 - номинал
1 - погрешность
Номер: 85E23D
Впишите правильный ответ.
Давление разреженного газа в сосуде возросло в 6 раз, а средняя энергия поступательного теплового движения его молекул возросла в 2 раза.
Во сколько раз увеличилась концентрация молекул газа в сосуде?
в
раз(а)
КЭС: 2.1.6 Связь между давлением и средней кинетической энергией поступательного теплового движения молекул идеального газа (основное уравнение МКТ)
Тип ответа: Краткий ответ
Ответ:
3
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
Мы изначально подняли температуру в 2 раза, так как энергия пропорциональна температуре, а ее увеличение произошло в 2 раза. В итоге и давление возросло в 2 раза. Однако по итого оно увеличилось в 6 раз. 6/2=3 то есть еще 3 раза мы должны были поднять давление за счет чего-то другого. Это и была концентрация молекул.
Номер: CCB480
Впишите правильный ответ.
В сосуде содержится гелий под давлением 160 кПа. Концентрацию гелия увеличили в 2 раза, а среднюю кинетическую энергию теплового движения его молекул уменьшили в 4 раза. Определите установившееся давление газа.
кПа
КЭС: 2.1.6 Связь между давлением и средней кинетической энергией поступательного теплового движения молекул идеального газа (основное уравнение МКТ)
Тип ответа: Краткий ответ
Ответ:
80
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
Мы изначально увеличили концентрацию в 2 раза, а значит увеличили и давление. При этом уменьшение энергии прямо пропорционально давлению. То есть получилось так: 160*2/4=80 кПа
Ответ: 80 кПа
Номер: 302781
Впишите правильный ответ.
Парциальное давление водяного пара в комнате в 2,5 раза меньше давления насыщенного водяного пара при той же температуре. Какова относительная влажность воздуха в комнате?
%
КЭС: 2.1.14 Влажность воздуха
Тип ответа: Краткий ответ
Ответ:
40
Насыщенный пар это 100 процентный пар, то есть у нас возникает соотношение.
100/2,5=40%
Ответ: 40%
Номер: 30DE81
Впишите правильный ответ.
В сосуде, объём которого можно изменять при помощи поршня, находится воздух с относительной влажностью 50%. Во сколько раз при неизменной температуре уменьшится объём сосуда к моменту, когда водяной пар станет насыщенным?
в
раз(а)
КЭС: 2.1.14 Влажность воздуха
Тип ответа: Краткий ответ
Ответ:
100
Объем обратно пропорционален влажности. То есть уменьшая объем в два раза мы повышаем влажность в два раза.
50*2=100 % насыщенный пар
Номер: 3A5182
Впишите правильный ответ.
В сосуде содержится аргон под давлением 150 кПа. Концентрацию аргона увеличили в 2 раза, а среднюю кинетическую энергию его молекул уменьшили в 3 раза. Определите установившееся давление газа.
кПа
КЭС: 2.1.9 Уравнение p=nkT
Тип ответа: Краткий ответ
Ответ:
100
Первоначально увеличивая давление получаем. p = 150*2=300 кПа.
Далее уменьшаем энергию, тем самым уменьшая давление. Так как энергия зависит от давления и прямо пропорциональна давлению из формулы.
`p = 2/3*n*E`
E - энергия молекул
p = nkT, где
р — давление,
n — число частиц в единице объёма,
k — Больцмана постоянная,
Т — абсолютная температура.
Получаем 300/3=100 кПа
Ответ: 100 кПа
Номер: 7ABC47
Впишите правильный ответ.
Даны следующие зависимости величин:
А) зависимость пути, пройденного телом при равномерном движении, от времени;
Б) зависимость объёма постоянной массы идеального газа от абсолютной температуры в изохорном процессе;
В) зависимость электроёмкости плоского конденсатора с расстоянием d между пластинами от площади пластин.
Установите соответствие между этими зависимостями и видами графиков, обозначенных цифрами 1–5. Для каждой зависимости А–В подберите соответствующий вид графика и запишите в таблицу выбранные цифры под соответствующими буквами. Цифры в ответе могут повторяться.
А Б В
Ответ:
КЭС: 1.1 Кинематика
1.2 Динамика
1.3 Статика
1.4 Законы сохранения в механике
1.5 Механические колебания и волны
2.1 Молекулярная физика
2.2 Термодинамика
3.1 Электрическое поле
3.2 Законы постоянного тока
3.3 Магнитное поле
3.4 Электромагнитная индукция
3.5 Электромагнитные колебания и волны
3.6 Оптика
Тип ответа: Краткий ответ
Ответ:
545
Номер: A89B4F
Впишите правильный ответ.
На рисунке показан график зависимости давления газа в запаянном сосуде от его температуры. Объём сосуда равен 0,25 м3. Какое приблизительно количество газообразного вещества содержится в этом сосуде? Ответ округлите до целых.
моль
КЭС: 2.1.10 Модель идеального газа в термодинамике
Тип ответа: Краткий ответ
Ответ:
2
Давление можно найти по формуле.
`p = (νT)/(RV)`
ν – количество вещества,
V - объем,
Т - температура, тогда
R=8,31 – универсальная газовая постоянная;
`ν = (pV)/T`
`v = (2,2*10^4*0.25)/(8.31*330) ≈ 2`
Номер: 79B504
Впишите правильный ответ.
Относительная влажность воздуха при температуре 100 о С равна 70%. Определите парциальное давление водяных паров, содержащихся в воздухе.
кПа
КЭС: 2.1.14 Влажность воздуха
Тип ответа: Краткий ответ
Ответ:
70
Относительную влажность воздуха можно найти по формуле:
`φ = ρ_1/ρ_2*100%`
р1 - парциальное давление
Так как при 100 °С происходит кипение воды и давление в этом случае равно 100 кПа, Подставляем это значение и находим парциальное давление:
`φ = ρ_1/ρ_2*100%`
`p_1 = φ*p_2*100% = 70*100*100 = 70 кПа`
Ответ: 70 кПа
Номер: 533B07
Впишите правильный ответ.
При изохорном нагревании идеального газа на 300 К его давление удвоилось. Какова была первоначальная абсолютная температура газа?
К
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Тип ответа: Краткий ответ
Ответ:
300
Увеличение температуры прямо пропорционально давлению. Произошло удвоение давления, значит и температуры тоже. Значит первоначальная Т
2Т = Т+300
Т = 300 К
Ответ: 300 К
Номер: 0BFF12
Впишите правильный ответ.
На рисунке представлен график зависимости давления некоторой постоянной массы кислорода от его объёма в адиабатном процессе.
В исходном состоянии (точка А) температура газа равна 300 К. Какую температуру будет иметь кислород при возрастании давления на 0,8⋅104 Па?
К
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Тип ответа: Краткий ответ
Ответ:
420
`p_aV_a = vRT_a`
`p_cV_c = vRT_c`
`T_c = T_a * (p_cV_c)/(p_aV_a) = 300 * (1.2*0.7)/(0.4*1.5) = 420 К`
Ответ: 420 К
Номер: 7C8A5D
Впишите правильный ответ.
Температура неона увеличилась с 27 оС до 177 оС. Во сколько раз увеличилась средняя кинетическая энергия его молекул?
раз(а)
КЭС: 2.1.8 Связь температуры газа со средней кинетической энергией поступательного теплового движения его молекул
Тип ответа: Краткий ответ
Ответ:
1.5
Связь кинетической энергии с температурой
E = 3/2kT,
где T – температура в Кельвинах.
Начальная температура T1 =27+273 = 300 К, конечная T2 =177+273 = 450 К.
Отношение температур равно 450/300=1.5
Ответ: 1,5
Номер: 4C6FA1
Впишите правильный ответ.
В закрытом сосуде под поршнем находится водяной пар при температуре 100 °С под давлением 20 кПа. Каким станет давление пара, если, сохраняя его температуру неизменной, уменьшить объём пара в 4 раза?
кПа
КЭС: 2.1.13 Насыщенные и ненасыщенные пары. Качественная зависимость плотности и давления насыщенного пара от температуры, их независимость от объёма насыщенного пара
Тип ответа: Краткий ответ
Ответ:
80
По закону Бойля-Мариотта, при постоянной температуре, зависимость давления газа от объема будет выглядеть так:
`p_ 0V_0 = p_1V_1`
Тогда, при изменении объема сосуда, новое давление будет равно:
`p_ 1 = (p_0V_0)/V_1=(p_0V_0)/(V_0/2)=2(p_0V_0)/V_0=4p_0`
Значит, давление увеличится в 4 раза. 20*4=80 кПа
Ответ: 80 (Почему то в ФИПИ ответ не 80? Почему!? 14.10.2024)
Номер: 890891
Впишите правильный ответ.
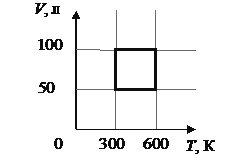
С идеальным газом постоянной массы происходит циклический процесс, VT-диаграмма которого представлена на рисунке. Наименьшее давление газа в этом процессе равно 6 кПа. Определите количество вещества этого газа. Ответ округлите до сотых.
моль
КЭС: 2.1.10 Модель идеального газа в термодинамике
Тип ответа: Краткий ответ
Ответ:
0,24
Наименьшее давление будет в точке "верхней правой квадрата"
V = 0.1 м3
T = 600 К
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура, тогда
R=8,31 – универсальная газовая постоянная;
`ν = (pV)/T`
`v = (6*10^3*0,1)/(8.31*300) = 600/(8.31*300) = 2/(8,31) ≈0,24`
Ответ: 0,24
Номер: 0771EE
Установление соответствия (13)
Установите соответствие и впишите ответ.
Одноатомный идеальный газ в количестве 0,04 моль, находящийся в сосуде под подвижным поршнем, изотермически расширяется при температуре 450 К. Масса газа в сосуде остаётся неизменной.
Установите соответствие между физическими величинами, характеризующими газ, и формулами, выражающими их зависимость от объёма V газа.
К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ
А) давление газа p(V)
Б) внутренняя энергия газа U(V)
ФОРМУЛЫ
1) `18·V`
2) `(149,58/V)`
3) `224,37`
4) `27`
А Б
КЭС: 2.1.10 Модель идеального газа в термодинамике
2.1.11 Закон Дальтона для давления смеси разреженных газов
Тип ответа: Установление соответствия
Ответ:
23
А)
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура
R=8,31 – универсальная газовая постоянная,
`p = (0,04*8,31*450)/V =149,58 `
Б)
`U = 3/2*ν*RT = (mV^2)/2`,
где
ν – количество вещества,
T - температура газа.
R - Универсальная газовая постоянная
`U = 3/2*0,04*8,31*450 = 224,37`
Номер: B5F219
Установите соответствие и впишите ответ.
Установите соответствие между графиками процессов, в которых участвует 1 моль одноатомного идеального газа, и физическими величинами (ΔU – изменение внутренней энергии; А – работа газа), которые их характеризуют.
К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
ГРАФИКИ ПРОЦЕССОВ
А)
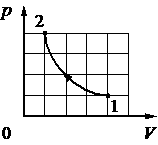
Б)

ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ
1) ΔU = 0; A > 0
2) ΔU = 0; A < 0
3) ΔU > 0; A > 0
4) ΔU > 0; A = 0
А Б
КЭС: 2.1.1 Модели строения газов, жидкостей и твердых тел
Тип ответа: Установление соответствия
Ответ:
24
А) Так как график нелинейный то однозначно происходит поглощение или выделение энергии. То есть работа какая-то была.
Б) График линейный значит работы газа не было, Это только 4
Номер: F56923
Установите соответствие и впишите ответ.
В цилиндре под поршнем находится идеальный одноатомный газ. Формулы А и Б позволяют рассчитать значения физических величин, характеризующих состояние газа. Использованы обозначения: p – давление; V – объём; Eк – средняя кинетическая энергия поступательного теплового движения частиц газа; ν – количество вещества, NA – постоянная Авогадро.
Установите соответствие между формулами и физическими величинами, значение которых можно рассчитать по этим формулам.
К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
ФОРМУЛЫ
А) `2/3 (νN_AE_к)/V`
Б) `3/2 (pV)/(N_AE_к)`
ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ
1) масса газа
2) количество вещества
3) давление
4) абсолютная температура
А Б
КЭС: 2.1.6 Связь между давлением и средней кинетической энергией поступательного теплового движения молекул идеального газа (основное уравнение МКТ)
Тип ответа: Установление соответствия
Ответ:
32
А)
`p = 2/3*n*E`
E - энергия молекул
p = nkT, где
р — давление,
n — число частиц в единице объёма,
k — Больцмана постоянная,
Т — абсолютная температура.
Б)
`p = 2/3*n*E` тогда
`n = 3/2*p/E`
Номер: 5644DE
Установите соответствие и впишите ответ.
Гелий массой 4,8 г при комнатной температуре помещают под тяжёлый подвижный поршень в открытый сверху сосуд и начинают охлаждать. Начальное давление гелия 200 кПа. Масса газа в сосуде остаётся неизменной. Трение между поршнем и стенками сосуда пренебрежимо мало.
Установите соответствие между физическими величинами, характеризующими гелий, и формулами, выражающими их зависимость от абсолютной температуры T газа в условиях данной задачи.
К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ
А) объём газа V(T)
Б) внутренняя энергия газа U(T)
ФОРМУЛЫ
1) `aT`, a=14,958 Дж/К
2) `b/T`, b=239,3 м3⋅К
3) `cT`, c=5,983⋅10−3 Дж/К
4) `dT`, d=4,986⋅10−5 м3/К
А Б
КЭС: 2.1.10 Модель идеального газа в термодинамике
2.1.11 Закон Дальтона для давления смеси разреженных газов
Тип ответа: Установление соответствия
Ответ:
41
Номер: 3CD6D3
Установите соответствие и впишите ответ.
На рисунках А и Б приведены графики двух процессов: 1–2 (гипербола) и 3–4, в каждом из которых участвует 1 моль разреженного гелия. Графики построены в координатах p–V и V–T, где p – давление, V – объём и T – абсолютная температура газа.
Установите соответствие между графиками и утверждениями, характеризующими изображённые на графиках процессы.
К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
ГРАФИКИ УТВЕРЖДЕНИЯ
А)
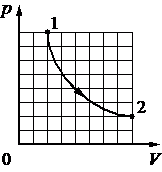
Б)
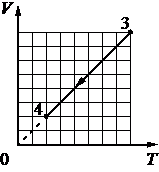
1) Над газом совершают положительную работу, при этом его внутренняя энергия увеличивается.
2) Над газом совершают положительную работу, при этом газ отдаёт положительное количество теплоты.
3) Газ получает положительное количество теплоты и совершает положительную работу.
4) Газ получает положительное количество теплоты, при этом его внутренняя энергия увеличивается.
А Б
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
2.2.7 Первый закон термодинамики
Тип ответа: Установление соответствия
Ответ:
32
Номер: 5EA4AD
Установите соответствие и впишите ответ.
На рисунке показан график изменения состояния постоянного количества одноатомного идеального газа, состоящий из четырёх участков. Установите соответствие между участками графика и значениями физических величин, характеризующих процессы на этих участках (DU – изменение внутренней энергии, А – работа газа).
Нет графика на ФИПИ
К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
УЧАСТКИ ГРАФИКА
А) переход 1– 2
Б) переход 2– 3
ЗНАЧЕНИЯ ФИЗИЧЕСКИХ ВЕЛИЧИН
1) ΔU > 0; A > 0
2) ΔU = 0; A > 0
3) ΔU < 0; A < 0
4) ΔU = 0; A < 0
А Б
КЭС: 2.1 Молекулярная физика
Тип ответа: Установление соответствия
Ответ:
14
Номер: 2405C2
Установите соответствие и впишите ответ.
Аргон в количестве ν моль помещают в открытый сверху сосуд под тяжёлый подвижный поршень и начинают охлаждать. Начальное давление газа – p0. Трением между поршнем и стенками сосуда пренебречь.
Установите соответствие между физическими величинами, характеризующими газ, и формулами, выражающими их зависимость от абсолютной температуры T газа (R – универсальная газовая постоянная).
К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ
А) объём газа V(T)
Б) внутренняя энергия газа U(T)
ФОРМУЛЫ
1) `(νRT)/p_0`
2) `(νRp_0)/T`
3) `3/2 νRT`
4) `3/2 (νRT)/p_0`
А Б
КЭС: 2.1.10 Модель идеального газа в термодинамике
2.1.11 Закон Дальтона для давления смеси разреженных газов
Тип ответа: Установление соответствия
Ответ:
13
Номер: 65ACC9
Установите соответствие и впишите ответ.
Аргон массой 160 г при комнатной температуре помещают в герметичный закрытый сосуд объёмом 20 л и начинают нагревать. Масса газа в сосуде остаётся неизменной.
Установите соответствие между физическими величинами, характеризующими аргон, и формулами, выражающими их зависимость от абсолютной температуры T газа в условиях данной задачи.
К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ
А) давление газа p(T)
Б) внутренняя энергия газа U(T)
ФОРМУЛЫ
1) `aT`, a=1662 Па/К
2) `bT`, b=49,86 Дж/К
3) `c/T`, c=80 Дж⋅К
4) `dT`, d=4,986 Па/К
А Б
КЭС: 2.1.10 Модель идеального газа в термодинамике
2.1.11 Закон Дальтона для давления смеси разреженных газов
Тип ответа: Установление соответствия
Ответ:
12
Номер: 8054C4
Установите соответствие и впишите ответ.
Установите соответствие между графиками процессов, в которых участвует 1 моль одноатомного идеального газа, и физическими величинами (ΔU – изменение внутренней энергии; А – работа газа), которые их характеризуют.
К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
ГРАФИКИ ПРОЦЕССОВ
А)
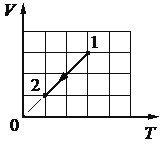
Б)
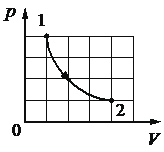
ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ
1) ΔU = 0; A = 0
2) ΔU = 0; A > 0
3) ΔU < 0; A = 0
4) ΔU < 0; A < 0
А Б
КЭС: 2.1.1 Модели строения газов, жидкостей и твердых тел
Тип ответа: Установление соответствия
Ответ:
42
Номер: 51A69B
Установите соответствие и впишите ответ.
На графиках А и Б приведены диаграммы p–V и p–T для процессов 1– 2 и 3– 4, проводимых с 1 моль аргона. На диаграммах p – давление, V – объём и T – абсолютная температура газа.
Установите соответствие между графиками и утверждениями, характеризующими изображённые на графиках процессы.
К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
ГРАФИКИ УТВЕРЖДЕНИЯ
А)
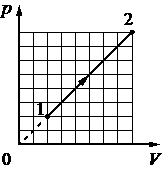
Б)
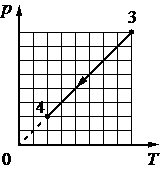
1) Газ отдаёт положительное количество теплоты, при этом его внутренняя энергия уменьшается.
2) Газ отдаёт положительное количество теплоты, при этом его внутренняя энергия не изменяется.
3) Газ получает положительное количество теплоты, при этом его внутренняя энергия не изменяется.
4) Газ получает положительное количество теплоты, при этом его внутренняя энергия увеличивается.
А Б
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Тип ответа: Установление соответствия
Ответ:
41
Номер: 5F3087
Установите соответствие и впишите ответ.
Одноатомный идеальный газ в количестве ν моль помещают в открытый сверху сосуд под лёгкий подвижный поршень и начинают нагревать. Начальный объём газа V0, давление p0. Масса газа в сосуде остаётся неизменной. Трением между поршнем и стенками сосуда пренебречь. R – универсальная газовая постоянная.
Установите соответствие между физическими величинами, характеризующими газ, и формулами, выражающими их зависимость от абсолютной температуры T газа в условиях данной задачи.
К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ
А) объём газа V(T)
Б) внутренняя энергия газа U(T)
ФОРМУЛЫ
1) `(νRT)/p_0`
2) `(νRT)/V_0`
3) `3/2 νRT`
4) `2/3 νRT`
А Б
КЭС: 2.1.10 Модель идеального газа в термодинамике
2.1.11 Закон Дальтона для давления смеси разреженных газов
Тип ответа: Установление соответствия
Ответ:
13
Номер: 53C38E
Установите соответствие и впишите ответ.
В цилиндре под поршнем находится идеальный одноатомный газ. Формулы А и Б позволяют рассчитать значения физических величин, характеризующих состояние газа. Обозначения: р – давление; Т – абсолютная температура; N – число атомов газа; k – постоянная Больцмана, V – объём газа.
Установите соответствие между формулами и физическими величинами, значение которых можно рассчитать по этим формулам.
К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
ФОРМУЛЫ
А) `p/(kT)`
Б) `(pV)/(Nk)`
ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ
1) абсолютная температура
2) концентрация молекул
3) давление
4) внутренняя энергия
А Б
КЭС: 2.1.9 Уравнение p=nkT
Тип ответа: Установление соответствия
Ответ:
21
А)
`p = (νRT)/V`
`ν = (pV)/(RT)`
ν – количество вещества,
V - объем,
Т - температура
R=8,31 – универсальная газовая постоянная,
V/R = k
Номер: CD1D80
Установите соответствие и впишите ответ.
Аргон помещают в открытый сверху сосуд под лёгкий подвижный поршень и начинают охлаждать. Давление воздуха, окружающего сосуд, равно 105 Па. Начальный объём газа 9 л, начальная температура 450 К. Масса газа в сосуде остаётся неизменной. Трением между поршнем и стенками сосуда пренебречь.
Установите соответствие между физическими величинами, характеризующими аргон, и формулами, выражающими их зависимость от абсолютной температуры T газа в условиях данной задачи.
К каждой позиции первого столбца подберите соответствующую позицию
из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ
А) объём газа V(T)
Б) внутренняя энергия газа U(T)
ФОРМУЛЫ
1) `aT`, a=2⋅10−5 м3К
2) `b/T`, b=4050 м3⋅К
3) `сT`, c=20 ДжК
4) `dT`, d=3 ДжК
А Б
КЭС: 2.1.10 Модель идеального газа в термодинамике
2.1.11 Закон Дальтона для давления смеси разреженных газов
Тип ответа: Установление соответствия
Ответ:
14
Номер: 8B2ED3
Развернутый ответ (37)
Дайте развернутый ответ.
На рТ-диаграмме показано, как изменялись давление и абсолютная температура некоторого постоянного количества одноатомного разреженного газа при его переходе из начального состояния 1 в состояние 4. Как при этом изменялись объём газа V и его внутренняя энергия U на каждом из трёх участков 1–2, 2–3, 3–4 (увеличивались, уменьшались или же оставались постоянными)? Ответ поясните, указав, какие физические явления и законы Вы использовали для объяснения.
КЭС: 2.1 Молекулярная физика
Тип ответа: Развернутый ответ
Решение:
В процессе 1-2
Давление газа можно вычислить по формулам:
`p = (νRT)/V`
ν – количество вещества,
V - объем,
Т - температура,
`V = (νRT)/p`
При этом мы видим, что пропорции давления и Т оставались линейно зависимыми.
`p_1/p_2=T_1/T_2` значит объем был постоянным. V = const
В процессе 2-3
По закону Гей Люссака
V/T = const
Как видим температура растет, а давление нет, значит увеличивается объем.
В процессе 3-4
Здесь ситуация следующая. Температура не растет, а растет давление. Значит изменяется объем, при этом плотность - концентрация молекул становиться выше, при росте давления, то есть объем уменьшается.
Номер: 1DAC06
Дайте развернутый ответ.
Горизонтальный сосуд разделён подвижным поршнем, который может свободно перемещаться без трения. Правая часть сосуда заполнена воздухом и герметично закрыта пробкой, левая часть сосуда открыта. Поршень соединён пружиной с левой стенкой сосуда. Первоначально поршень находится в равновесии, а пружина сжата. В недеформированном состоянии длина пружины больше, чем показанная на рисунке, но меньше, чем длина сосуда. Опишите, куда сместится поршень, если из правой части сосуда вынуть пробку. Температуру воздуха считать постоянной. Ответ поясните, указав какие физические явления и закономерности Вы использовали для объяснения.
КЭС: 2.1 Молекулярная физика
Тип ответа: Развернутый ответ
Решение:
1. Левая часть сосуда открыта, в ней находится атмосферный воздух. Первоначально пружина сжата, сила упругости направлена вправо. Поршень находится в равновесии, поэтому равнодействующая сил, действующих на него со стороны газов и пружины, равна нулю:
pатмS + Fупр = pS ,
где pатм – атмосферное давление,
p – давление газа в правой части сосуда,
F упр – сила упругости,
S – площадь поперечного сечения сосуда.
Таким образом, давление газа в правой части сосуда больше атмосферного: p > pатм .
2. Если вынуть пробку, то атмосферный воздух начнёт заполнять правую часть сосуда, и давление в ней упадет до атмосферного: p = pатм .
3. Равновесие нарушится, и поршень под действием силы упругости начнёт двигаться вправо. Поскольку трение между поршнем и сосудом отсутствует, то в дальнейшем поршень будет совершать свободные колебания, которые впоследствии затухнут из-за трения в воздухе.
Номер: 8AC878
Дайте развернутый ответ.
На графике представлена зависимость давления неизменной массы идеального газа от его плотности. Опишите, как изменяются в зависимости от плотности температура и объём газа в процессах 1−2 и 2−3.
КЭС: 2.1.1 Модели строения газов, жидкостей и твердых тел
2.1.2 Тепловое движение атомов и молекул вещества
2.1.3 Взаимодействие частиц вещества
2.1.4 Диффузия. Броуновское движение
2.1.5 Модель идеального газа в МКТ: молекулы газа движутся хаотически и не взаимодействуют друг с другом
2.1.6 Связь между давлением и средней кинетической энергией поступательного теплового движения молекул идеального газа (основное уравнение МКТ)
2.1.7 Абсолютная температура
2.1.8 Связь температуры газа со средней кинетической энергией поступательного теплового движения его молекул
2.1.9 Уравнение p=nkT
2.1.10 Модель идеального газа в термодинамике
2.1.11 Закон Дальтона для давления смеси разреженных газов
2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
2.1.13 Насыщенные и ненасыщенные пары. Качественная зависимость плотности и давления насыщенного пара от температуры, их независимость от объёма насыщенного пара
2.1.14 Влажность воздуха
2.1.15 Изменение агрегатных состояний вещества: испарение и конденсация, кипение жидкости
2.1.16 Изменение агрегатных состояний вещества: плавление и кристаллизация
2.1.17 Преобразование энергии в фазовых переходах
Решение:
1. Плотность находится по формуле:
`ρ = m/V` (1)
тогда уравнение Клайперона–Менделеева можно переписать в виде
`pV = m/μ RT ⇒ p= ρ/μ RT`, (2)
где m – масса газа,
V – его объем,
T – температура газа.
2.
Процесс 1–2.
Плотность уменьшается при постоянном, в соответствии с формулой (1) объем будет увеличиваться, а температура будет увеличиваться в соответствии с формулой (2).
Процесс 2–3.
Плотность уменьшается вместе с давлением, причем давление уменьшается пропорционально плотности p ∼ ρ , а это означает, что температура газа постоянна, а по формуле (1) объем увеличивается.
Номер: 43F9B1
Дайте развернутый ответ.
В одном сосуде под поршнем в объёме V0 при комнатной температуре находится только насыщенный водяной пар и вода, которая занимает малый объём. В другом сосуде под поршнем в объёме V0 при том же давлении p0 находится сухой воздух. Воздух и водяной пар изотермически сжимают так, что объём под поршнем уменьшается в 2 раза. Постройте графики этих двух процессов в переменных p– V. Опираясь на законы молекулярной физики, объясните построение графиков.
КЭС: 2.1 Молекулярная физика
Решение:
При изотермическом сжатии давление насыщенного водяного пара остаётся постоянным, так как давление насыщенного пара зависит только от температуры. Поэтому процесс изображается на pV-диаграмме горизонтальным отрезком (см. рисунок а). В этом процессе объёмом сконденсировавшейся воды можно пренебречь вследствие того, что плотность воды гораздо больше плотности пара.
При изотермическом сжатии сухого воздуха справедлив закон Бойля-Мариотта: давление обратно пропорционально объёму (pV = const). Графически такая зависимость представляет собой фрагмент гиперболы (см. рисунок б).
Номер: 2C751A
Дайте развернутый ответ.
На графике представлена зависимость объёма постоянного количества молей одноатомного идеального газа от средней кинетической энергии теплового движения молекул газа. Опишите, как изменяются температура и давление газа в процессах 1−2 и 2−3. Укажите, какие закономерности Вы использовали для объяснения.
КЭС: 2.1.1 Модели строения газов, жидкостей и твердых тел
2.1.2 Тепловое движение атомов и молекул вещества
2.1.3 Взаимодействие частиц вещества
2.1.4 Диффузия. Броуновское движение
2.1.5 Модель идеального газа в МКТ: молекулы газа движутся хаотически и не взаимодействуют друг с другом
2.1.6 Связь между давлением и средней кинетической энергией поступательного теплового движения молекул идеального газа (основное уравнение МКТ)
2.1.7 Абсолютная температура
2.1.8 Связь температуры газа со средней кинетической энергией поступательного теплового движения его молекул
2.1.9 Уравнение p=nkT
2.1.10 Модель идеального газа в термодинамике
2.1.11 Закон Дальтона для давления смеси разреженных газов
2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
2.1.13 Насыщенные и ненасыщенные пары. Качественная зависимость плотности и давления насыщенного пара от температуры, их независимость от объёма насыщенного пара
2.1.14 Влажность воздуха
2.1.15 Изменение агрегатных состояний вещества: испарение и конденсация, кипение жидкости
2.1.16 Изменение агрегатных состояний вещества: плавление и кристаллизация
2.1.17 Преобразование энергии в фазовых переходах
Решение:
Средняя кинетическая энергия теплового движения газа равна:
`E_k = 3/2 *kT`,
где T – температура газа.
Отсюда:
`T = (2Ek)/(3k)`. (1)
Запишем уравнение Менделеева-Клапейрона:
pV = νRT,
где
p – давление,
ν – количество вещества.
Тогда давление можно найти по формуле:
`p = (νRT)/V= (νR⋅2Ek)/(3kV)`. (2)
Проанализируем процессы:
1-2. Средняя кинетическая энергия теплового движения и объём изменяются прямо пропорционально (V = αEk ), при этом увеличиваются, значит, по формуле (1) температура газа увеличивается, а по формуле (2) давление не изменяется.
2-3. Средняя кинетическая энергия не изменяется, а объём уменьшается, значит, по формуле (1) температура не изменяется, а по формуле (2) давление увеличивается.
Номер: 641415
Дайте развернутый ответ.
На рис. 1 приведена зависимость внутренней энергии U 1 моль идеального одноатомного газа от его объёма V в процессе 1– 2– 3. Постройте график этого процесса в переменных p– V (p – давление газа). Точка, соответствующая состоянию 1, уже отмечена на рис. 2. Построение объясните, опираясь на законы молекулярной физики.
Рис. 1 Рис. 2
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Решение:
1. График процесса в переменных p-V имеет вид:
2. Внутренняя энергия идеального одноатомного газа пропорциональна его абсолютной температуре:
`U = 3/2 νRT` .
Значит, на участке 1-2 температура газа не меняется, происходит изотермическое расширение, давление в этом процессе в соответствии с законом Бойля - Мариотта (p1 V1 = p2 V2) уменьшается в 2 раза. В координатах p-V график является гиперболой.
3. На участке 2-3 внутренняя энергия, а также температура пропорциональны объёму, процесс при постоянном количестве вещества согласно уравнению Клапейрона - Менделеева (pV = νRT) является изобарным расширением, давление в нём не меняется, а объём в соответствии с графиком на рис. 1 увеличивается в 2 раза. В координатах p-V график является отрезком горизонтальной прямой
Номер: 98EA22
Дайте развернутый ответ.
После влажной уборки парциальное давление водяного пара в комнате возросло, при этом температура воздуха не изменилась. Как изменились относительная влажность воздуха и плотность водяных паров в комнате? Ответ поясните, указав, какие физические закономерности Вы использовали для объяснения.
КЭС: 2.1.14 Влажность воздуха
Решение:
Относительная влажность вычисляется по формуле:
`φ= p/p_н` где
p – парциальное давление паров,
pн – парциальное давление насыщенных паров.
Так как температура воздуха не изменяется, то не изменяется давление насыщенных паров, следовательно, с увеличением парциального давления паров относительная влажность увеличивается. Из уравнения Менделеева – Клапейрона получаем:
`pV = m/μ RT ⇒ ρ = (pμ)/(RT)` ,
где V – объём комнаты,
m – масса паров,
μ – молярная масса воды,
ρ – плотность водяных паров.
При увеличении парциального давления паров плотность водяных паров в комнате увеличивается.
Номер: A3959A
Дайте развернутый ответ.
На рис. 1 приведена зависимость концентрации n идеального одноатомного газа от его давления р в процессе 1–2–3. Количество вещества газа постоянно. Постройте график этого процесса в координатах p–V (V – объём газа). Точка, соответствующая состоянию 1, уже отмечена на рис. 2. Построение объясните, опираясь на законы молекулярной физики.
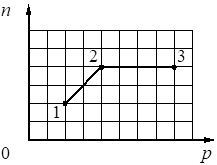
Рис. 1 Рис. 2
КЭС: 2.1 Молекулярная физика
Тип ответа: Развернутый ответ
Решение:
Решение.
1. График процесса в координатах p – V имеет следующий вид (см. рис.).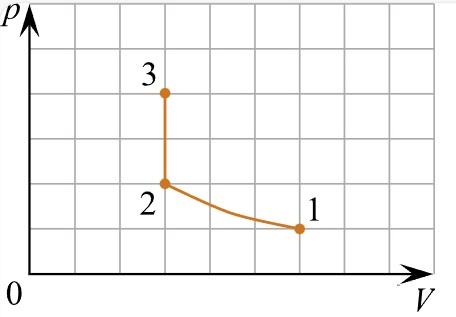
2. Концентрация газа обратно пропорциональна его объёму: где N — число молекул газа. На участке 1–2 давление прямо пропорционально концентрации газа (), а так как то T = const, то есть процесс изотермический. В этом случае при N = const выполняется закон Бойля-Мариотта: pV = const. Так как концентрация увеличивается в 2 раза, то объём газа в 2 раза уменьшается, а давление в 2 раза увеличивается. В координатах p – V график является гиперболой.
3. На участке 2–3 концентрация постоянна, значит, при N = const объем газа не меняется, процесс является изохорным нагреванием, в котором давление увеличивается в 2 раза. В координатах p – V. график представляет отрезок вертикальной прямой
Номер: D38EE5
Дайте развернутый ответ.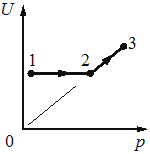
Постоянное количество одноатомного идеального газа участвует в процессе, который изображён на рисунке в переменных U–p, где U – внутренняя энергия газа, p – его давление. Опираясь на законы молекулярной физики и термодинамики, определите, получает ли газ положительное количество теплоты или отдаёт его в процессах 1–2 и 2–3. Ответ поясните.
КЭС: 2.1 Молекулярная физика
Решение:
Решение.
Из графика следует, что в процессе 1–2 внутренняя энергия газа не изменяется, а его давление увеличивается. Так как внутренняя энергия одноатомного идеального газа определяется формулой
`U = 3/2*ν*RT`,
то температура газа постоянного количества не изменяется. Данный процесс является изотермическим. Тогда по закону Бойля-Мариотта делаем вывод, что при увеличении давления его объем уменьшается. При сжатии газ совершает отрицательную работу. По первому закону термодинамики
Q = ΔU + A,
делаем вывод, что количество теплоты, передаваемое газу в данном процессе отрицательное.
В процессе 2–3 внутренняя энергия газа зависит от давления прямо пропорционально. Тогда из формулы
`U = 3/2*pV`
следует, что объем газа в данном процессе не изменяется. При этом давление увеличивается, температура вследствие увеличения внутренней энергии также увеличивается. При неизменном объеме газ работу не совершает. Следовательно, по первому закону термодинамики для изохорного процесса газ в данном процессе Q = ΔU получает положительное количество теплоты.
Ответ: в 1–2 — отдает, в 2–3 — получает.
Номер: D76E33
Дайте развернутый ответ.
В комнате при 20 °С относительная влажность воздуха составляет 40%. При умеренной физической нагрузке через лёгкие человека проходит 15 л воздуха за 1 мин. Выдыхаемый воздух имеет температуру 34 °С и относительную влажность 100%. Давление насыщенного водяного пара при 20 °С равно 2,34 кПа, а при 34 °С – 5,32 кПа. Какую массу воды теряет тело человека за 1 ч за счёт дыхания? Считать, что объём выдыхаемого воздуха равен объёму, который проходит через лёгкие человека. Влажность воздуха в комнате считать неизменной.
КЭС: 2.1 Молекулярная физика
Решение:
Решение.
1. Парциальное давление пара при температуре t = 20 °C равно
p=φp_(нп1)
Из уравнения Клапейрона — Менделеева
`pV=m_1/M * RT_1`
находим массу пара в первом состоянии
`m_1 = (φp_(нп1)VM)/(RT_1)`
Аналогично для пара во втором состоянии
`m_2 = (φp_(нп2)VM)/(RT_2)`
его масса равна
`m_2 = (p_(нп2)VM)/(RT_2)`
За время t=1 ч = 60 мин человек выдыхает объем водяного пара, равный
`V = (ΔV)/(Δt) * t`
где по условию задачи
`(ΔV)/(Δt) = 15 · 10^−3` м3/мин
Вычислим объем:
`V = 15 · 10^−3 · 60 = 0,9` м3.
3. За 1 час масса потерянной человеком воды равна:
`Δm = m_2-m_1 = (VM)/R ((p_(нп2))/T_2 - (φp_(нп1))/T_1)=(VM(p_(нп2)T_1-φp_(нп1)T_2))/(RT_1T_2)`
`Δm = (0.9*18*10^-3(5.32*293-2.34*0.4*307)*10^3)/(8.31*307*293)≈0.028кг = 28 г`
Ответ: 28 г.
Номер: BEDE43
Дайте развернутый ответ.
Сосуд разделён тонкой перегородкой на две части, отношение объёмов которых `V_2/V_1=3`.
В первой части сосуда находится воздух с относительной влажностью φ1=80%.
Какой была влажность воздуха во второй части сосуда, если после того, как перегородку убрали, в сосуде установилась относительная влажность 50%? Считать, что температура воздуха в частях сосуда одинакова и не изменилась после снятия перегородки.
КЭС: 2.1.1 Модели строения газов, жидкостей и твердых тел
2.1.2 Тепловое движение атомов и молекул вещества
2.1.3 Взаимодействие частиц вещества
2.1.4 Диффузия. Броуновское движение
2.1.5 Модель идеального газа в МКТ: молекулы газа движутся хаотически и не взаимодействуют друг с другом
2.1.6 Связь между давлением и средней кинетической энергией поступательного теплового движения молекул идеального газа (основное уравнение МКТ)
2.1.7 Абсолютная температура
2.1.8 Связь температуры газа со средней кинетической энергией поступательного теплового движения его молекул
2.1.9 Уравнение p=nkT
2.1.10 Модель идеального газа в термодинамике
2.1.11 Закон Дальтона для давления смеси разреженных газов
2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
2.1.13 Насыщенные и ненасыщенные пары. Качественная зависимость плотности и давления насыщенного пара от температуры, их независимость от объёма насыщенного пара
2.1.14 Влажность воздуха
2.1.15 Изменение агрегатных состояний вещества: испарение и конденсация, кипение жидкости
2.1.16 Изменение агрегатных состояний вещества: плавление и кристаллизация
2.1.17 Преобразование энергии в фазовых переходах
Решение:
Решение.
После снятия перегородки суммарная масса паров воды сохраняется прежней:
`ρ_1V_1+ρ_2V-2=ρ(V1+V2)`, (1)
где — плотности паров воды в объёмах V1 и V2 соответственно, ρ — плотность паров после устранения перегородки. Поделим все части уравнения (1) на плотность насыщенных паров воды при той же температуре:
`ρ_1/ρ_н V_1+ρ_2/ρ_н V-2=ρ/ρ_н (V1+V2)` , (2)
Согласно определению относительной влажности
`φ_1=ρ_1/ρ_н φ_2=ρ_2/ρ_н φ=ρ_1/ρ_н`
так что вместо (2) имеем:
`φ_1V_1+φ_2V_2=φ_1(V_1+V_2)`
Отсюда:
`φ_2 = ((φV_1+φV_2)-φ_1V_1)/V_2=(φ(1+V_2/V_1))/(V_2/V_1)=(0.5*(1+3)-0.8)/3=0.4` = 40%
Ответ:40%
Номер: 258D41
Дайте развернутый ответ.
Влажный воздух находится в вертикальном гладком цилиндрическом сосуде под невесомым поршнем с площадью S. На поршень медленно насыпают песок. На стенках сосуда появляется роса, если масса песка становится равной m. Температура влажного воздуха в сосуде поддерживается постоянной. Снаружи сосуда давление воздуха равно нормальному атмосферному давлению р0. Определите первоначальную относительную влажность воздуха в сосуде.
КЭС: 2.1 Молекулярная физика
Тип ответа: Развернутый ответ
Решение:
1) в начальном состоянии давление в сосуде под невесомым поршнем равно
атмосферному давлению р0;
2) если масса поршня вместе с песком становится равна m, то появляется роса, и, значит, относительная влажность воздуха становится равной 100 %,
то есть у нас прибавляется давление площадки с площадью S
p=F/S, где F = mg, тогда `p=(mg)/S`, а полное давление
`p=р_0+(mg)/S`
3) закон Бойля – Мариотта:
`p_oV_1=(р_0+(mg)/S)V_2`
для влажного воздуха;
`p_пV_1=р_(нас)V_2`
для водяного пара, где `V_1 и V_2` – соответственно начальный и конечный объемы сосуда
Относительную влажность воздуха можно найти по формуле:
`φ = p_0/p_н*100%`, то есть подставляем значения выше в формулу.
`φ = p_0/((р_0+(mg)/S))*100%`
Номер: 19CDFF
Дайте развернутый ответ.
В комнате при 20 °С относительная влажность воздуха составляет 40%.
В состоянии покоя через лёгкие человека проходит 5 л воздуха за 1 мин. Выдыхаемый воздух имеет температуру 34 °С и относительную влажность 100%. Давление насыщенного водяного пара при 20 °С равно 2,34 кПа, а при 34 °С – 5,32 кПа. Какое количество воды теряет тело человека за 1 ч за счёт дыхания? Считать, что выдыхаемый воздух имеет такой же объём, какой проходит через лёгкие человека. Влажность воздуха в комнате не изменяется.
КЭС: 2.1 Молекулярная физика
Решение:
Дано:
M = 18·10-3 кг/моль;
T1 = 20 °С = 293 К;
φ1 = 40% = 0,4;
pн1 = 2,34 кПа = 2,34·103 Па;
T2 = 34 °С = 307 К;
φ2 = 100 % = 1;
pн2 = 5,32 кПа = 5320 Па;
R = 8,31 Дж/(моль·К)
Решение:
1) Водяной пар в воздухе до момента конденсации является разреженным газом и описывается уравнением Менделеева-Клапейрона:
`pV=m/M RT`
где p - парциальное давление пара,
m - масса пара в рассматриваемом объёме V,
Т - абсолютная температура.
При комнатной температуре Т1 и парциальном давлении p1 в выделенном объёме V содержится
`m_1 =M(p_1V)/(RT_1)`
водяного пара, а в выдыхаемом воздухе при температуре T2 и парциальном давлении p2 содержится
`m_2 =M(p_2V)/(RT_2)`
2) Масса испарённой воды в этом объёме:
`m=m2-m1=M(p_2V)/(RT_2)-M(p_1V)/(RT_1)=(MV)/R*(p_2/T_2-p_1/T_1)`
`p_1=φ_1*p_(н1)=0,4*2,34*10^3` Па = 936 Па
`p_2=φ_2*p_(н2)=1*5320=5320`Па
3) За 1 мин через лёгкие проходит 5 л воздуха, а за 1 ч - 5*60=300 л, то есть V = 0,9 м3. Подставляя значения физических величин, получим количество потерянной за час воды:
`m=(18*10^-3*0.3)/(8.31)*(5320/307-936/293)=9.2*10^-3` кг
Ответ: m ≈ 9.2*10-3 кг
Номер: 830FF9
Дайте развернутый ответ.
В закрытом сосуде объёмом V = 10 л находится влажный воздух массой m = 18 г при температуре t = 80 oC и давлении р = 2·105 Па. Определите массу паров воды в сосуде.
КЭС: 2.1.13 Насыщенные и ненасыщенные пары. Качественная зависимость плотности и давления насыщенного пара от температуры, их независимость от объёма насыщенного пара
Решение:
1) Переведем все величины в СИ:
V = 10* 10-3 м3
m = 0,018 кг
T = 80 + 273 = 353 К
2) Под влажным воздухом подразумевается сухой воздух и водяной пар:
`m = m_(воз.) + m_(вп)`
`m_(воз.)`- масса сухого воздуха,
`m_(вп)` - масса водяных паров.
3) Давление p - суммарное давление сухого воздуха и водяного пара. Запишем закон Дальтона для системы газов:
`p=p_(возд)+p_(вп)`
`p_(возд) и p_(вп)` - давление сухого воздуха и давление водяного пара соответственно.
4) Запишем уравнение Менделеева-Клапейрона для каждого газа:
`p_(вп)V = m_(вп)/M_(вп) RT`
`p_(возд)V = m_(возд)/M_(возд) RT`
5) Сложим уравнения и выразим искомую массу пара:
`p_(вп)V + p_(возд)V = m_(вп)/M_(вп) RT + m_(возд)/M_(возд) RT`
`m_(воз.) = m - m_(вп)`
`(p_(вп)+p_(возд))V=m_(вп)/M_(вп) RT + (m - m_(вп))/М_(возд) *RT`
`pV=m_(вп)/M_(вп) RT + m/M_(возд) RT - m_(вп)/M_(возд) RT `
`pV-m/M_(возд) RT=m_(вп) RT(1/M_(вп) - 1/M_(возд))`
`m_(вп) = (pV-m/M_(возд) RT)/(RT(1/M_(вп) - 1/M_(возд))`
`m_(вп) = (2*10^5*10^-2-(0.018)/0.029*8.31*353)/(8.31*353(1/(0.018) - 1/(0.029))) ≈0.0029 = 2.9 г`
Ответ: 2,9 г
Номер: B01805
Дайте развернутый ответ.
В запаянной с одного конца трубке находится влажный воздух, отделённый от атмосферы столбиком ртути длиной l = 76 мм. Когда трубка лежит горизонтально, относительная влажность воздуха φ1 в ней равна 80%. Какой станет относительная влажность этого воздуха φ2 , если трубку поставить вертикально, открытым концом вниз? Атмосферное давление равно 760 мм рт. ст. Температуру считать постоянной.
КЭС: 2.1.1 Модели строения газов, жидкостей и твердых тел
2.1.2 Тепловое движение атомов и молекул вещества
2.1.3 Взаимодействие частиц вещества
2.1.4 Диффузия. Броуновское движение
2.1.5 Модель идеального газа в МКТ: молекулы газа движутся хаотически и не взаимодействуют друг с другом
2.1.6 Связь между давлением и средней кинетической энергией поступательного теплового движения молекул идеального газа (основное уравнение МКТ)
2.1.7 Абсолютная температура
2.1.8 Связь температуры газа со средней кинетической энергией поступательного теплового движения его молекул
2.1.9 Уравнение p=nkT
2.1.10 Модель идеального газа в термодинамике
2.1.11 Закон Дальтона для давления смеси разреженных газов
2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
2.1.13 Насыщенные и ненасыщенные пары. Качественная зависимость плотности и давления насыщенного пара от температуры, их независимость от объёма насыщенного пара
2.1.14 Влажность воздуха
2.1.15 Изменение агрегатных состояний вещества: испарение и конденсация, кипение жидкости
2.1.16 Изменение агрегатных состояний вещества: плавление и кристаллизация
2.1.17 Преобразование энергии в фазовых переходах
Решение:
Решение.
1. Относительная влажность воздуха в трубке в первом случае:
`φ_1=p_1/p_(н)`
где p1 — давление водяных паров в трубке,
pн — давление насыщенных водяных паров при той же температуре.
Для второго случая относительная влажность воздуха в трубке:
`φ_2=p_2/p_(н)`
где p2 — парциальное давление водяных паров в трубке.
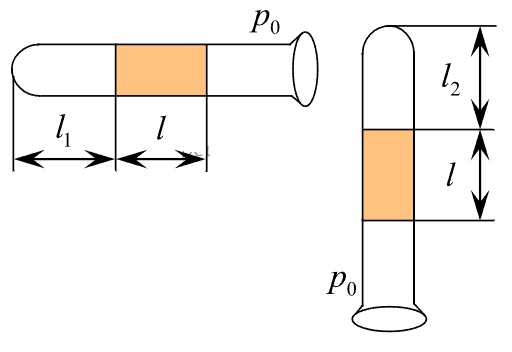
2. Давление влажного воздуха в первом случае равно атмосферному давлению:
`p_(1вл) = p_(0)`
а во втором случае
`p_(2вл) = p_(0)=ρgl`
где ρ — плотность ртути,
а l — длина столбика ртути.
Заметим, что где H = 760 мм.
3. Объем влажного воздуха при изменении положения трубки изменился так, как изменились длины столбиков воздуха, запертых ртутью. Считаем влажный воздух идеальным газом. Поэтому по закону Бойля — Мариотта можем записать:
`V_2/V_1=l_2/l_1=p_o/(p_0-ρgl)`
4. Из уравнения Клапейрона — Менделеева следует, что:
`p=(vRT)/V`
`p_(вл) =(v+v_(св))RT/V`
где
p — парциальное давление водяного пара,
`p_(вл)` — давление влажного воздуха,
ν — количество моль водяного пара в трубке,
`ν_(св)` — количество моль сухого воздуха в трубке. Отсюда следует, что:
`p/p_(вл) = v/(v+v_(св)) = const`
Поэтому
`p_1/p_2=p_(1вл)/p_(2вл)`
и для изотермического процесса для парциальных давлений водяного пара имеем:
`p_1/p_2=V_2/V_1=p_0/(p_0-p_ρgl)`
5. После объединения записанных выше уравнений получим выражение для относительной влажности воздуха во втором случае:
`φ_2=φ_1*(p_0-ρgl)/(p_0)=φ_1*(ρgH-ρgl)/(ρgH)=φ_1*(H-l)/(H)=80*(760-76)/760=72`%
Ответ:φ2=72`%
Номер: 060CB2
Дайте развернутый ответ.
В вертикальном цилиндрическом сосуде с площадью поперечного сечения S = 5 см2, под подвижным поршнем массой М = 1 кг с лежащим на нём грузом массой m = 0,5 кг находится воздух при комнатной температуре. Первоначально поршень находился на высоте h1 = 13 см от дна сосуда. На сколько изменится эта высота, если груз снять с поршня? Воздух считать идеальным газом, а его температуру – неизменной. Атмосферное давление равно 105 Па. Трение между стенками и поршнем не учитывать.
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Решение:
Дано:
v = const
T = const
po - атмосферное `10^5` Па
S = 5 см2
h1 = 13 см
m = 0,5 кг
М = 1 кг
Найти:
Δh-?
Решение:
p=F/S
`V_1=h_1*S`
`V_2=(h_1+Δh)*S`
Давление Менделеева - Клапейрона
`p1*V_1=vRT`, тогда
`p1*h_1*S=vRT`
и для состояния когда наша перегородка поднята
`p_2*V_2=vRT`, тогда
`p_2*(h_1+Δh)*S=vRT`
`p_1*h_1*S=p2*(h_1+Δh)*S`
Выразим одно давление через другое
`p_1 = (p2*(h_1+Δh)*S)/(h_1*S)=(p2*(h_1+Δh))/h_1` (1)
Выразим влияние физических сил на перегородку (давления с двух сторон и массы перегородки и груза).
`p_oS +(M+m)g = p_1S` - 1 состояние с грузом
отсюда р1 `p_1 = (p_oS +(M+m)g)/S` (2)
`p_oS +Mg = p_2S` - 2 состояние без груза
Выразим p2
`p_2 = (p_oS +Mg)/S`
Подставим p2 в 1 уравнение
`p_1 =(p2*(h_1+Δh))/h_1=(p_oS +Mg)/S *(h_1+Δh)/h_1` (3)
Собственно 2 и 3 уравнение можно приравнять так как там у нас фигурирует р1
`(p_oS +(M+m)g)/S = (p_oS +Mg)/S *(h_1+Δh)/h_1`
сократим S умножением в 2 частях
`(p_oS +(M+m)g) = ((p_oS +Mg)*(h_1+Δh))/h_1`
`(p_oS +(M+m)g)*h1 = (p_oS +Mg)*(h_1+Δh)`
`(p_oS +(M+m)g)*h1 = (p_oS +Mg)*(h_1+Δh)`
`(p_oS +Mg)*(h_1+Δh) - p_oSh1 -Mgh1-mgh1 = 0`
`(p_oS +Mg)*h_1+ (p_oS +Mg)Δh - p_oSh1 -Mgh1-mgh1 = 0`
`p_oSh_1 +Mg*h_1+ p_oSΔh +MgΔh - p_oSh1 -Mgh1-mgh1 = 0`
`p_oSΔh +MgΔh-mgh1 = 0`
`Δh(p_oS+Mg)=mgh1`
`Δh = (mgh1)/(p_oS+Mg)`
`Δh = (0.5*10*0.13)/(10^5 * 0.0005+1*10)=(0,65)/60≈0.0108` м = 1,1 см
Ответ: 1,1 см
Номер: BA06BC
Дайте развернутый ответ.
В горизонтально расположенной трубке постоянного сечения, запаянной с одного конца, помещён столбик ртути длиной 7,5 см, который отделяет воздух в трубке от атмосферы. Трубку расположили вертикально, запаянным концом вниз. На сколько градусов следует нагреть воздух в трубке, чтобы объём, занимаемый воздухом, стал прежним? Температура воздуха в лаборатории 300 К, а атмосферное давление составляет 750 мм рт. ст.
КЭС: 2.1.10 Модель идеального газа в термодинамике
Решение:
Дано:
T1=300 К
lртут.=7,5 см (75 мм в системе СИ)
p0=750 мм рт. ст.
ΔT=?
Решение:
Уравнение Клапейрона:
`(p1*v1)/T1=(p2*v2)/T2`
V воздуха в горизонтальной и вертикальной трубке
V1 = V2 (равны) T воздуха в трубке, расположенной вертикально
T2=T1 + ΔТ,
столбик ртути в горизонтальной трубке в равновесии, поэтому давление воздуха в трубке
p1 = p0 (равны)
Так как столбик ртути в вертикально расположенной трубке покоится, то давление воздуха `p_2 = p_0 + p_(ртут.)` Подставим значения макропараметров воздуха в уравнение Клапейрона:
`p_0*V_1/T_1=(p_0+p_(ртут.))*V_2/(T1+ΔT)`
Из этой формулы выражаем дельту T (изменение темепературы):
`ΔT=(p_0+T_1+p_(ртут.)* T_1-p_0*T_1)/p_0`
`ΔT=(p_(ртут.)*T_1)/p_0`
Подставляем наши значения в формулу:
`ΔT=(75*300)/750=30` К
Ответ: ΔT=30 К
Номер: E69926
Дайте развернутый ответ.
Закрытый сверху вертикальный цилиндрический сосуд, заполненный воздухом, разделён тяжёлым поршнем, способным скользить без трения, на две части. В начальном равновесном состоянии в верхней и нижней частях сосуда находилось по ν=1
моль воздуха, а отношение объёмов верхней
и нижней частей сосуда было равно 2. После того, как из нижней части сосуда удалили некоторое количество воздуха Δν
, через длительный промежуток времени установилось новое состояние равновесия с отношением объёмов верхней и нижней частей сосуда, равным 3. Температура воздуха T в обеих частях сосуда всё время поддерживалась одинаковой и постоянной. Определите, какое количество воздуха было удалено из сосуда.
КЭС: 2.1.1 Модели строения газов, жидкостей и твердых тел
2.1.2 Тепловое движение атомов и молекул вещества
2.1.3 Взаимодействие частиц вещества
2.1.4 Диффузия. Броуновское движение
2.1.5 Модель идеального газа в МКТ: молекулы газа движутся хаотически и не взаимодействуют друг с другом
2.1.6 Связь между давлением и средней кинетической энергией поступательного теплового движения молекул идеального газа (основное уравнение МКТ)
2.1.7 Абсолютная температура
2.1.8 Связь температуры газа со средней кинетической энергией поступательного теплового движения его молекул
2.1.9 Уравнение p=nkT
2.1.10 Модель идеального газа в термодинамике
2.1.11 Закон Дальтона для давления смеси разреженных газов
2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
2.1.13 Насыщенные и ненасыщенные пары. Качественная зависимость плотности и давления насыщенного пара от температуры, их независимость от объёма насыщенного пара
2.1.14 Влажность воздуха
2.1.15 Изменение агрегатных состояний вещества: испарение и конденсация, кипение жидкости
2.1.16 Изменение агрегатных состояний вещества: плавление и кристаллизация
2.1.17 Преобразование энергии в фазовых переходах
Решение:
1. Вначале на поршень действовали: сила давления газа в верхней части цилиндра
`F_1=p_2S`
направленная вниз, сила давления газа в нижней части цилиндра направленная вверх, сила тяжести поршня mg, направленная вниз. Поскольку поршень находится в равновесии, то Учитывая, что давление в верхней части меньше, чем в нижней, делаем вывод, что объем газа в верхней части больше, чем объем газа в нижней части цилиндра. Используя уравнение Клапейрона-Менделеева, выразим давления каждой части газа:
`p_1 = (3vRT)/(2V)`
и
`p_2 = (3vRTS)/(2V)`
где V — объем всего сосуда. Тогда сила тяжести, действующая на поршень,
`mg = (3vRTS)/(3V)`
2. Когда из нижней части цилиндра удалили часть газа, поршень опускался до тех пор, пока снова не наступило равновесие, то есть:
`mg = (4(v-Δv)RTS)/(V)-(4vRTS)/(3V)`
3. Учитывая выведенное в первом пункте, получаем:
`(3vRTS)/(2V)+(4vRTS)/(3V)=(4(v-Δv)RTS)/(V)`
`Δv=(7v)/24≈0.29` моль
Ответ: 0,29 моль
Номер: 05A6DD
Дайте развернутый ответ.
Сосуд разделён тонкой перегородкой на две части, отношение объёмов которых `V_2/V_1=3`.
В первой и второй частях сосуда находится воздух с относительной влажностью φ1=60 % и φ2=70 % соответственно. Какой будет относительная влажность воздуха в сосуде, если перегородку убрать? Считать, что температура воздуха в частях сосуда одинакова и не меняется до и после снятия перегородки.
КЭС: 2.1 Молекулярная физика
Тип ответа: Развернутый ответ
Решение:
Решение.
1. После снятия перегородки суммарная масса паров воды остаётся прежней:
`ρ_1V_1+ρ_2V-2=ρ(V1+V2)` (1)
где ρ1 и ρ2 плотность паров воды в объёмах V1 и V2 соответственно до снятия перегородки, ρ — плотность паров воды после устранения перегородки. Поделим все части уравнения (1) на плотность насыщенных паров воды при температуре воздуха в сосуде:
`ρ_1/ρ_н V_1+ρ_2/ρ_н V-2=ρ/ρ_н (V1+V2)` (2)
2. Согласно определению относительной влажности воздуха
`φ_1=ρ_1/ρ_н φ_2=ρ_2/ρ_н φ=ρ_1/ρ_н`
так что вместо (2) имеем:
`φ_1V_1+φ_2V_2=φ_1(V_1+V_2)`
Отсюда:
`φ = (φ_1V_1+φ_2V_2)/(V_1+V_2)=(φ_1 + φ_2 (V_2/V_1))/(1+(V_2/V_1))=(0.6+0.7*3)/(1+3)=0.675` = 67,5%
Ответ: 67,5%.
Номер: 7CF1D3
Дайте развернутый ответ.
Для того чтобы совершить воздушный полёт, отважный мальчик решил использовать воздушные шары объёмом 10 л, наполненные гелием. Сколько воздушных шаров потребуется, чтобы поднять в воздух мальчика массой 40 кг при нормальном атмосферном давлении? Температура окружающего воздуха 28 °C. Массой оболочек шаров и их упругостью, а также силой Архимеда, действующей на мальчика, пренебречь.
КЭС: 2.1.1 Модели строения газов, жидкостей и твердых тел
2.1.2 Тепловое движение атомов и молекул вещества
2.1.3 Взаимодействие частиц вещества
2.1.4 Диффузия. Броуновское движение
2.1.5 Модель идеального газа в МКТ: молекулы газа движутся хаотически и не взаимодействуют друг с другом
2.1.6 Связь между давлением и средней кинетической энергией поступательного теплового движения молекул идеального газа (основное уравнение МКТ)
2.1.7 Абсолютная температура
2.1.8 Связь температуры газа со средней кинетической энергией поступательного теплового движения его молекул
2.1.9 Уравнение p=nkT
2.1.10 Модель идеального газа в термодинамике
2.1.11 Закон Дальтона для давления смеси разреженных газов
2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
2.1.13 Насыщенные и ненасыщенные пары. Качественная зависимость плотности и давления насыщенного пара от температуры, их независимость от объёма насыщенного пара
2.1.14 Влажность воздуха
2.1.15 Изменение агрегатных состояний вещества: испарение и конденсация, кипение жидкости
2.1.16 Изменение агрегатных состояний вещества: плавление и кристаллизация
2.1.17 Преобразование энергии в фазовых переходах
Решение:
Дано:
T = 301 K
`V_0 = 10 л = 0,01 м^3`
`p = 10^5` Па
m=40 кг
`M_1 = 0.029` кг/моль
`M_2 = 0.004` кг/моль
Найти: N
Решение:
На мальчика действуют силы: сила Архимеда
`F_a=ρ_(He)(nV)g`
сила тяжести, действующая на человека, mg и сила тяжести, действующая на шарики,
`m_(He)*g=ρ_(He)g(nV)`
Мальчик будет подниматься за счет силы Архимеда, действующей на шары:
`mg+m_(He)*g=F_a`
`mg+ρ_(He)(nV)*g=gρ_(возд)(nV)`
откуда количество шариков:
` n = m/(V(ρ_(возд)-ρ_(He)))`
где `ρ_(возд)` — плотность воздуха, `ρ_(He)`— плотность гелия.
`p=ρ/M*RT`
`ρ=(pM)/(RT)`
Из уравнения Менделеева — Клапейрона можем найти плотность газа при данной температуре и давлении:
`n = m/(V(ρ_(возд)-ρ_(He))) = (mRT)/(Vp_0(M_(возд)-M_(He))) = (40*8.31*301)/(10*10^-3*10^5*(0.029-0.004)) ≈ 4002`
Ответ:4002
Номер: 158BDB
Дайте развернутый ответ.
В открытой пробирке, вращающейся в горизонтальной плоскости с угловой скоростью 10 с– 1 вокруг вертикальной оси, проходящей через край пробирки, находится столбик ртути длиной h = 1 см, центр которого отстоит от оси вращения на расстояние r = 20 см. До какой температуры T2 надо нагреть пробирку, чтобы при увеличении угловой скорости в 4 раза столбик ртути не сместился? Начальная температура t1=0 оС, а внешнее атмосферное давление p0=105
Па.
КЭС: 2.1.1 Модели строения газов, жидкостей и твердых тел
2.1.2 Тепловое движение атомов и молекул вещества
2.1.3 Взаимодействие частиц вещества
2.1.4 Диффузия. Броуновское движение
2.1.5 Модель идеального газа в МКТ: молекулы газа движутся хаотически и не взаимодействуют друг с другом
2.1.6 Связь между давлением и средней кинетической энергией поступательного теплового движения молекул идеального газа (основное уравнение МКТ)
2.1.7 Абсолютная температура
2.1.8 Связь температуры газа со средней кинетической энергией поступательного теплового движения его молекул
2.1.9 Уравнение p=nkT
2.1.10 Модель идеального газа в термодинамике
2.1.11 Закон Дальтона для давления смеси разреженных газов
2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
2.1.13 Насыщенные и ненасыщенные пары. Качественная зависимость плотности и давления насыщенного пара от температуры, их независимость от объёма насыщенного пара
2.1.14 Влажность воздуха
2.1.15 Изменение агрегатных состояний вещества: испарение и конденсация, кипение жидкости
2.1.16 Изменение агрегатных состояний вещества: плавление и кристаллизация
2.1.17 Преобразование энергии в фазовых переходах
Решение:
Дано:
ω ⇒ 4ω
r = 20 см
t1 = 0 C
h = 1 см
p0 = 105 Па
Решение:
m=ρSh (1)
`mω^2r=p_1S-p_0S` (2)
`m(4ω)^2r=p_2S-p_0S` (3)
`P_1/T_1 = P_2/T_2` (4)
`16(p_1-p_0)S = (p_2-p_0)S` (из 2 и 3) сокращаем S
`16p_1-16p_0 = p_2-p_0`
`p_2=16p_1-15p_0` (5)
(из 1 и 2)
`ρShω^2r=(p_1-p_0)S` сокращаем S
`p_1 = p_0+ρhω^2r`
`p_2 = 16p_0+16ρhω^2r-15p_0=p_0+16ρhω^2r`
`T_2=T_1*p_2/p_1 = T_1*(p_0+16ρhω^2r)/(p_0+ρhω^2r) = 273 * (10^5+16*13600*10^-2*10^2*0.2)/(10^5+13600*10^-2*10^2*0.2)≈381,4`К
Ответ: 381,4 К
Номер: C0CDD7
Дайте развернутый ответ.
В вертикальном цилиндре, закрытом лёгким поршнем, находится бензол (С6H6) при температуре кипения t=80 oC. При сообщении бензолу количества теплоты Q часть его превращается в пар, который при изобарном расширении совершает работу А. Удельная теплота парообразования бензола L=396⋅103 Дж/кг, его молярная масса M = 78⋅10−3 кг/моль. Какая часть подведённого к бензолу количества теплоты переходит в работу? Объёмом жидкого бензола пренебречь.
КЭС: 2.1 Молекулярная физика
Решение:
Первый закон термодинамики:
Q = ΔU + A
При кипении бензола происходит его изобарное расширение.
Работа пара: A = pΔV
Уравнение Клайперона-Менделеева:
`pΔV = (Δm)/M RT`
Молярная масса бензола: `M = 78*10^-3` кг/моль
Температура кипения бензола: T=80+273=353 К
Отсюда: `A = (ΔmRT)/M`
Количество теплоты, необходимое для испарения бензола: Q = ΔmL
Отсюда:
`η = A/Q = (RT)/(ML) = (8.31*353)/(78*10^-3*396*10^3) ≈ 0,095`
Ответ: 0,095
Номер: A0D359
Дайте развернутый ответ.
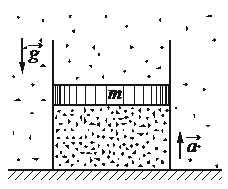
В вертикальном цилиндрическом сосуде
с гладкими стенками под подвижным поршнем массой 10 кг и площадью поперечного сечения 50 см2 находится разреженный газ (см. рисунок). При движении сосуда по вертикали с ускорением, направленных вверх и равным по модулю 1 м/с2, высота столба газа под поршнем постоянна и на 5% меньше, чем в покоящемся сосуде. Считая температуру газа под поршнем неизменной, а наружное давление постоянным, определите внешнее давление. Масса газа под поршнем постоянна.
КЭС: 2.1.1 Модели строения газов, жидкостей и твердых тел
2.1.2 Тепловое движение атомов и молекул вещества
2.1.3 Взаимодействие частиц вещества
2.1.4 Диффузия. Броуновское движение
2.1.5 Модель идеального газа в МКТ: молекулы газа движутся хаотически и не взаимодействуют друг с другом
2.1.6 Связь между давлением и средней кинетической энергией поступательного теплового движения молекул идеального газа (основное уравнение МКТ)
2.1.7 Абсолютная температура
2.1.8 Связь температуры газа со средней кинетической энергией поступательного теплового движения его молекул
2.1.9 Уравнение p=nkT
2.1.10 Модель идеального газа в термодинамике
2.1.11 Закон Дальтона для давления смеси разреженных газов
2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
2.1.13 Насыщенные и ненасыщенные пары. Качественная зависимость плотности и давления насыщенного пара от температуры, их независимость от объёма насыщенного пара
2.1.14 Влажность воздуха
2.1.15 Изменение агрегатных состояний вещества: испарение и конденсация, кипение жидкости
2.1.16 Изменение агрегатных состояний вещества: плавление и кристаллизация
2.1.17 Преобразование энергии в фазовых переходах
Решение:
В первому случае:
`p_1 = p_н+p_(п1)=p_н+(mg)/s`
Во втором случае:
`p_2 = p_н+p_(п2)=p_н+(mg+ma)/s`
Объемы до и после движения сосудов:
`V_2/V_1 = h_2/h_1=0.95`
Уравнение Клайперона-Менделеева:
pV = vRT
Отсюда:
`p_1V_1=p_2V_2`
`p_1 = 0.95p_2`
`p_н + (mg)/S = 0.95(p_н+((mg+ma)*0.95)/S-(mg)/S)`
`p_н - 0.95p_н = ((mg+ma)*0.95)/S-(mg)/S)`
`0.05p_н = m/S(0.95a-0.05g)`
`p_н = 10/(0.05*5*10^-3)(0.95*1-0.05*10)=1.8*10^4` Па
Ответ: 1,8 ∗ 104 Па
Номер: A40A56
Дайте развернутый ответ.
Воздушный шар, оболочка которого имеет массу М = 145 кг и объём V = 230 м3, наполняется при нормальном атмосферном давлении горячим воздухом, нагретым до температуры t = 265 °С. Определите максимальную температуру t0 окружающего воздуха, при которой шар начнёт подниматься. Оболочка шара нерастяжима и имеет в нижней части небольшое отверстие.
КЭС: 2.1.1 Модели строения газов, жидкостей и твердых тел
2.1.2 Тепловое движение атомов и молекул вещества
2.1.3 Взаимодействие частиц вещества
2.1.4 Диффузия. Броуновское движение
2.1.5 Модель идеального газа в МКТ: молекулы газа движутся хаотически и не взаимодействуют друг с другом
2.1.6 Связь между давлением и средней кинетической энергией поступательного теплового движения молекул идеального газа (основное уравнение МКТ)
2.1.7 Абсолютная температура
2.1.8 Связь температуры газа со средней кинетической энергией поступательного теплового движения его молекул
2.1.9 Уравнение p=nkT
2.1.10 Модель идеального газа в термодинамике
2.1.11 Закон Дальтона для давления смеси разреженных газов
2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
2.1.13 Насыщенные и ненасыщенные пары. Качественная зависимость плотности и давления насыщенного пара от температуры, их независимость от объёма насыщенного пара
2.1.14 Влажность воздуха
2.1.15 Изменение агрегатных состояний вещества: испарение и конденсация, кипение жидкости
2.1.16 Изменение агрегатных состояний вещества: плавление и кристаллизация
2.1.17 Преобразование энергии в фазовых переходах
Решение:
Условие подъема шара:
`F_a≥Mg+mg`
Отсюда:
`ρ_0gV≥Mg+ρgV`
`ρ_0V≥M+ρV`
ρ_0 - плотность окружающего воздуха
ρ – плотность воздуха внутри оболочки
Уравнение Клайперона-Менделеева:
`pV = m/M_r*RT`
`p = (M_(rp))/(RT)`
`p_0 = (M_(rp))/(RT_0)`
Отсюда:
`(M_(rp))/(RT_0) V ≥ M + (M_(rp))/(RT) V`
`(M_(rp))/(RT_(мин)) V = (M_(rp))/(RT_0) V - M`
`T_(мин) = T_0 * (M_(rp) V)/(pM_rV - MRT_0) ≈538 K = 265 C `
Ответ: 265 C
Номер: 5A6DA8
Дайте развернутый ответ.
Два баллона объёмами 10 и 20 л содержат 2 моль кислорода и 1 моль азота соответственно при температуре 28 °C. Какое давление установится в баллонах, если их соединить между собой? Температуру газов считать неизменной.
КЭС: 2.1.10 Модель идеального газа в термодинамике
Решение:
Решение
В конечном состоянии в баллонах с суммарным объемом будет находиться смеси двух газов при температуре 28 °C. Тогда согласно уравнению Менделеева — Клапейрона давление смеси будет:
pV=vRT
`p=(vRT)/V = (3*8.31*301)/(30*10^-3)≈250*10^3` Па = 250 кПа
Ответ: 250 кПа.
Номер: 86A1AA
Дайте развернутый ответ.
Для того чтобы совершить воздушный полёт, бесстрашный изобретатель, масса которого 60 кг, решил использовать 5000 воздушных шаров, наполненных гелием. До какого объёма необходимо надувать гелием каждый шар, чтобы изобретатель смог подняться в воздух при нормальном атмосферном давлении? Температура окружающего воздуха равна 27 °C. Массой оболочек шаров и их упругостью, а также силой Архимеда, действующей на изобретателя, пренебречь.
КЭС: 2.1.1 Модели строения газов, жидкостей и твердых тел
2.1.2 Тепловое движение атомов и молекул вещества
2.1.3 Взаимодействие частиц вещества
2.1.4 Диффузия. Броуновское движение
2.1.5 Модель идеального газа в МКТ: молекулы газа движутся хаотически и не взаимодействуют друг с другом
2.1.6 Связь между давлением и средней кинетической энергией поступательного теплового движения молекул идеального газа (основное уравнение МКТ)
2.1.7 Абсолютная температура
2.1.8 Связь температуры газа со средней кинетической энергией поступательного теплового движения его молекул
2.1.9 Уравнение p=nkT
2.1.10 Модель идеального газа в термодинамике
2.1.11 Закон Дальтона для давления смеси разреженных газов
2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
2.1.13 Насыщенные и ненасыщенные пары. Качественная зависимость плотности и давления насыщенного пара от температуры, их независимость от объёма насыщенного пара
2.1.14 Влажность воздуха
2.1.15 Изменение агрегатных состояний вещества: испарение и конденсация, кипение жидкости
2.1.16 Изменение агрегатных состояний вещества: плавление и кристаллизация
2.1.17 Преобразование энергии в фазовых переходах
Решение:
Для того чтобы шарики подняли в воздух изобретателя, необходимо, чтобы сила Архимеда, действующая на шарики, превышала силу тяжести, действующую на изобретателя и гелий в шариках:
`F_a≥Mg+m_g`,
где
`F_a=ρ_вNV_0g=m_в*g`;
N — количество шариков;
`V_0` — объём одного шарика;
`m_в` — соответственно плотность и масса вытесненного шариками атмосферного воздуха;
`m_г`— масса гелия в шариках.
Для атмосферного воздуха и гелия справедливо уравнение Менделеева-Клапейрона:
`p_0NV_0=m_в/μ_в RT`
и
`p_0NV_0=m_г/μ_г RT`
где
`р_0` — атмосферное давление;
`μ_в` и `μ_г`— молярные массы соответственно воздуха и гелия.
Выражая массы газов, окончательно получим:
`V_0≥(MRT)/(Nр_0(μ_в-μ_г))`
`V_0≥(60*8.31*300)/(5000*10^5(0.029-0.004)) ≈ 12`
Ответ: 12 л
Номер: 2118C2
Дайте развернутый ответ.
Закрытый вертикальный цилиндрический сосуд, заполненный идеальным газом, разделён на две части тяжёлым поршнем, способным скользить без трения. В начальном равновесном состоянии в верхней и нижней частях сосуда находилось по ν=1 моль газа, а отношение объёмов верхней и нижней частей сосуда было равно 2. После того как из верхней части сосуда полностью откачали газ, через длительный промежуток времени установилось новое состояние равновесия. Найдите отношение объёмов верхней и нижней частей сосуда после откачки газа. Температура газа T в обеих частях сосуда всё время поддерживалась одинаковой и постоянной.
КЭС: 2.1 Молекулярная физика
Решение:
Найдем как выражаются начальные объёмы через объём цилиндра:
V = V1+ V2.
`V_1/V_2 =2 ⇒ V = 3V_2 ⇒ V_2 = V/3⇒ V1 =(2V)/3`
Изобразим силы, действующие на поршень в двух случаях.
Запишем второй закон Ньютона:
`F_1+ mg+F_2` = ma, где
`F_1 = p_1S` – сила давления газа сверху,
`F_2 = p_2S` – сила давления газа снизу,
a – ускорение поршня.
Спроецируем второй закон Ньютона в вертикальную ось:
`p_1S+ mg − p_2S = ma`
При покоящемся поршне a= 0 , тогда
`p_2 = (mg)/S +p_1`. (1)
Запишем уравнение Менделеева-Клапейрона для газа в верхней и нижней частях сосуда в начальном равновесном состоянии:
`p_1V_1 = νRT p_2V_2 =νRT`, где
p1 и p2 – давление в верхней и нижней частях сосуда,
V1 и V2 – объёмы верхней и нижней частей сосуда.
Тогда
`p_1V_1 =p_2V_2 ⇒ p2 = 2p_1 ⇒ p_1 =(mg)/S`
Рассмотрим второй случай:
`F′_2 = mg ⇒ p′_2S = mg ⇒ p′_2 =(mg)/S = p_2/2`
Т.к. T = const , то по закону Бойля-Мариотта:
`p′_2V′_2 = p_2V_2`
Следовательно:
`V′_2 = (2p_2V_2)/p_2= 2V_2 = (2V)/3`
Тогда из `V =V′_1 + V′_2` следует, что
`V_1 = V/3`.
Значит
`(V′_1)/(V′_2) = 1/2 = 0,5`
Ответ:0,5
Номер: 0EEB94
Дайте развернутый ответ.
В запаянной с одного конца стеклянной трубке, расположенной горизонтально, находится столбик воздуха длиной l1=30,7 см, запертый столбиком ртути (рисунок 1). Если трубку закрепить вертикально отверстием вниз, то длина воздушного столбика над ртутью будет равна l2=43,2 см (рисунок 2). Какова длина l ртутного столбика? Атмосферное давление 747 мм рт. ст. Температуру воздуха в трубке считать постоянной.
КЭС: 2.1.1 Модели строения газов, жидкостей и твердых тел
2.1.2 Тепловое движение атомов и молекул вещества
2.1.3 Взаимодействие частиц вещества
2.1.4 Диффузия. Броуновское движение
2.1.5 Модель идеального газа в МКТ: молекулы газа движутся хаотически и не взаимодействуют друг с другом
2.1.6 Связь между давлением и средней кинетической энергией поступательного теплового движения молекул идеального газа (основное уравнение МКТ)
2.1.7 Абсолютная температура
2.1.8 Связь температуры газа со средней кинетической энергией поступательного теплового движения его молекул
2.1.9 Уравнение p=nkT
2.1.10 Модель идеального газа в термодинамике
2.1.11 Закон Дальтона для давления смеси разреженных газов
2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
2.1.13 Насыщенные и ненасыщенные пары. Качественная зависимость плотности и давления насыщенного пара от температуры, их независимость от объёма насыщенного пара
2.1.14 Влажность воздуха
2.1.15 Изменение агрегатных состояний вещества: испарение и конденсация, кипение жидкости
2.1.16 Изменение агрегатных состояний вещества: плавление и кристаллизация
2.1.17 Преобразование энергии в фазовых переходах
Решение:
Решение.
1. Когда трубка расположена горизонтально, объём воздуха и его давление равны, соответственно: `V_1=l_1S`, где S — площадь сечения трубки; `p_1 = p_(атм)`, что вытекает из условия равновесия столбика ртути.
2. Когда трубка расположена вертикально отверстием вниз, объём закрытой части трубки и давление воздуха в ней равны, соответственно:
`V_2=l_2S; p_2=p_(атм)+ρgl`,
где ρ — плотность ртути (13600 кг/м3).
3. Так как T = const, получаем: `p_1V_1=p_2V_2*p_(атм)l_1S`. , откуда (с учетом того, что 747 мм рт. ст. = 100 000 Па):
`l=(p_(атм)(l_2-l_1))/(ρgl_2)=(10^5*(0,432-0,307))/(10*0,238*13600)=125/323,68≈0,38`
Ответ: 38 см
Номер: 0F5292
Дайте развернутый ответ.
Гелий в количестве ν=3 моль изобарно сжимают, совершая работу A1=2,4 кДж. При этом температура гелия уменьшается в 4 раза: `T_2=T_1/4`. Затем газ адиабатически расширяется, при этом его температура изменяется до значения `T_3=T_1/8`. Найдите работу газа А2 при адиабатном расширении. Количество вещества в процессах остаётся неизменным.
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Решение:
Решение:
1. При изобарном сжатии (давление неизменно) над гелием совершается работа, модуль которой
`A_1=|pΔV|`, где
p – давление гелия в этом процессе,
ΔV - изменение его объёма.
2. В соответствии с уравнением Клапейрона – Менделеева для этого процесса можно записать:
`|pΔV|=vR(T_1 - T_2)`
3. В адиабатном процессе (процессе без теплообмена) в соответствии с первым законом термодинамики сумма изменения внутренней энергии газа и его работы равна нулю:
`3/2*vR(T_3 - T_2)+A_2=0`
При записи последнего соотношения учтено выражение для изменения внутренней энергии идеального одноатомного газа:
`ΔU=3/2*vR(T_3 - T_2)`
Преобразуя записанные уравнения с учётом соотношений температур, заданных в условии задачи, получаем:
`A_1=3vRT_2`
`A_2=3/4vRT_2`
Следовательно
`A_2=A_1/4=2400/4=600`Дж
Ответ: 600 Дж.
Номер: 63AF96
Дайте развернутый ответ.
Воздушный шар наполняется горячим воздухом при нормальном атмосферном давлении. Абсолютная температура Т горячего воздуха в 2 раза больше температуры Т0 окружающего воздуха. При каком отношении массы оболочки к массе наполняющего её воздуха шар начнёт подниматься? Оболочка шара нерастяжима и имеет в нижней части небольшое отверстие.
Массой груза и объёмом материала оболочки шара пренебречь.
КЭС: 2.1.1 Модели строения газов, жидкостей и твердых тел
2.1.2 Тепловое движение атомов и молекул вещества
2.1.3 Взаимодействие частиц вещества
2.1.4 Диффузия. Броуновское движение
2.1.5 Модель идеального газа в МКТ: молекулы газа движутся хаотически и не взаимодействуют друг с другом
2.1.6 Связь между давлением и средней кинетической энергией поступательного теплового движения молекул идеального газа (основное уравнение МКТ)
2.1.7 Абсолютная температура
2.1.8 Связь температуры газа со средней кинетической энергией поступательного теплового движения его молекул
2.1.9 Уравнение p=nkT
2.1.10 Модель идеального газа в термодинамике
2.1.11 Закон Дальтона для давления смеси разреженных газов
2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
2.1.13 Насыщенные и ненасыщенные пары. Качественная зависимость плотности и давления насыщенного пара от температуры, их независимость от объёма насыщенного пара
2.1.14 Влажность воздуха
2.1.15 Изменение агрегатных состояний вещества: испарение и конденсация, кипение жидкости
2.1.16 Изменение агрегатных состояний вещества: плавление и кристаллизация
2.1.17 Преобразование энергии в фазовых переходах
Решение:
Нам необходимо обеспечить такое соотношение массы горячего воздуха + массы шара, чтобы все это "погруженное" в воздух при нормальных условиях возникла сила Архимеда.
Пусть
m – масса воздуха в оболочке шара,
ρ0 – плотность воздуха снаружи шара,
μ – молярная масса воздуха,
p0 – атмосферное давление.
Запишем второй закон Ньютона:
(M + m)g +FA = (M + m)a,
где FA - сила Архимеда,
a – ускорение шара.
Сила Архимеда, направленная вверх, равна:
`FA = ρ_0gV`.
Запишем уравнение Менделеева-Клапейрона для воздуха внутри шарика:
`p_0 = (mRT)/(Vμ)⇒ m = (p_0Vμ)/RT`.
Запишем также уравнение Менделеева-Клапейрона для воздуха снаружи шарика:
`p_0 = (ρ_0RT_0)/μ ⇒ ρ_0 = (p_0μ)/(RT_0)`.
Так как сила Архимеда направлена вверх, то второй закон Ньютона проецируется на вертикальную ось
`F_A − (M + m)g = (M + m)a`,
а для того чтобы шарик поднялся вверх должно выполняться неравенство:
`ρ_0gV ≥ (M + m)g`.
Тогда
`(p0μV)/(RT_0)≥ M + m ⇒ (p0μV)/(RT_0)≥ m(1 + M/m)`
Или
`(p_0μV)/(RT_0)≥ p_0μV/RT(1+ M/m)` , то
`T/T_0 = 2≥ 1+ M/m ⇒ M/m ≤ 1`
Ответ: При соотношении масс меньше 1 шар начнет взлетать
Номер: B27AE1
Дайте развернутый ответ.
В сосуде под поршнем находится влажный воздух при давлении р1 = 120 кПа и температуре t = 80 oC с относительной влажностью φ = 70%. Объём под поршнем уменьшают в три раза при постоянной температуре. Каким станет давление влажного воздуха под поршнем? Давление насыщенных паров воды рн при температуре t = 80 oC равно 47,3 кПа.
КЭС: 2.1.14 Влажность воздуха
Решение:
Первоначальное давление водяных паров:
`φ = p_(1н)/p_(нп)`
`p_(1н)=φ*p_(нп)`
По условию температура в сосуде постоянна, поэтому давление насыщенного пара
в сосуде остается неизменным.
При изотермическом уменьшении объема давление должно увеличиваться. Это
будет происходить до тех пор, пока пар не станет насыщенным.
Давление сухого пара будет также увеличиваться изотермически.
По закону Бойля-Мариотта
`p_1cV_1=p_2cV_2`
Так как `V_1=3V_2`, то `p_2c=3p_1c`
Уравнение Дальтона для обоих случаев:
`p_1=φp_(нп)+p_(1c) p_2=p_(нп)+p_(2c)`
Отсюда конечное давление влажного воздуха в сосуде:
`p_2=3p_1-p_(нп)(3φ-1)=3*120-47,3*(3*0,7-1)=307,97 кПа`
Ответ: 307,97 кПа.
Номер: A099EB
Дайте развернутый ответ.
В запаянной с одного конца длинной горизонтальной стеклянной трубке постоянного сечения (см. рисунок) находится столбик воздуха длиной l1 = 30,7 см, запертый столбиком ртути. Если трубку поставить вертикально отверстием вверх, то длина воздушного столбика под ртутью будет равна l2 = 23,8 см. Какова длина ртутного столбика? Атмосферное давление 747 мм рт. ст. Температуру воздуха в трубке считать постоянной.
КЭС: 2.1.1 Модели строения газов, жидкостей и твердых тел
2.1.2 Тепловое движение атомов и молекул вещества
2.1.3 Взаимодействие частиц вещества
2.1.4 Диффузия. Броуновское движение
2.1.5 Модель идеального газа в МКТ: молекулы газа движутся хаотически и не взаимодействуют друг с другом
2.1.6 Связь между давлением и средней кинетической энергией поступательного теплового движения молекул идеального газа (основное уравнение МКТ)
2.1.7 Абсолютная температура
2.1.8 Связь температуры газа со средней кинетической энергией поступательного теплового движения его молекул
2.1.9 Уравнение p=nkT
2.1.10 Модель идеального газа в термодинамике
2.1.11 Закон Дальтона для давления смеси разреженных газов
2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
2.1.13 Насыщенные и ненасыщенные пары. Качественная зависимость плотности и давления насыщенного пара от температуры, их независимость от объёма насыщенного пара
2.1.14 Влажность воздуха
2.1.15 Изменение агрегатных состояний вещества: испарение и конденсация, кипение жидкости
2.1.16 Изменение агрегатных состояний вещества: плавление и кристаллизация
2.1.17 Преобразование энергии в фазовых переходах
Решение:
Решение.
1. Когда трубка расположена горизонтально, объём воздуха и его давление равны, соответственно: `V_1=l_1S`, где S — площадь сечения трубки; `p_1 = p_(атм)`, что вытекает из условия равновесия столбика ртути.
2. Когда трубка расположена вертикально отверстием вверх, объём закрытой части трубки и давление воздуха в ней равны, соответственно:
`V_2=l_2S; p_2=p_(атм)+ρgl`,
где ρ — плотность ртути (13600 кг/м3).
3. Так как T = const, получаем: `p_1V_1=p_2V_2*p_(атм)l_1S`. , откуда (с учетом того, что 747 мм рт. ст. = 100 000 Па):
`l=(p_(атм)(l_1-l_2))/(ρgl_2)=(10^5*(0,307-0,238))/(10*0,238*13600)=69/323,68≈0,21`
Ответ: 21 см
Номер: B3F130
Дайте развернутый ответ.
В комнате размерами 4×5×3 м, в которой воздух имеет температуру 10 °C и относительную влажность 30%, включили увлажнитель воздуха производительностью 0,2 л/ч. Чему станет равна относительная влажность воздуха в комнате через 1,5 ч? Давление насыщенного водяного пара при температуре 10 °C равно 1,23 кПа. Комнату считать герметичным сосудом.
КЭС: 2.1.1 Модели строения газов, жидкостей и твердых тел
2.1.2 Тепловое движение атомов и молекул вещества
2.1.3 Взаимодействие частиц вещества
2.1.4 Диффузия. Броуновское движение
2.1.5 Модель идеального газа в МКТ: молекулы газа движутся хаотически и не взаимодействуют друг с другом
2.1.6 Связь между давлением и средней кинетической энергией поступательного теплового движения молекул идеального газа (основное уравнение МКТ)
2.1.7 Абсолютная температура
2.1.8 Связь температуры газа со средней кинетической энергией поступательного теплового движения его молекул
2.1.9 Уравнение p=nkT
2.1.10 Модель идеального газа в термодинамике
2.1.11 Закон Дальтона для давления смеси разреженных газов
2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
2.1.13 Насыщенные и ненасыщенные пары. Качественная зависимость плотности и давления насыщенного пара от температуры, их независимость от объёма насыщенного пара
2.1.14 Влажность воздуха
2.1.15 Изменение агрегатных состояний вещества: испарение и конденсация, кипение жидкости
2.1.16 Изменение агрегатных состояний вещества: плавление и кристаллизация
2.1.17 Преобразование энергии в фазовых переходах
Решение:
Масса испарившейся воды равна
m = ρV, где ρ – её плотность, V – объём
Тогда за 1,5 часа работы увлажнителя испарится 0,2 ⋅ 1,5 = 0,3 л воды, т. е.
Δm = 0,3 кг воды.
Относительная влажность равна
`φ = p_(в.п.)/p_(н.п.)`,
где
`p_(в.п.)` – давление водяных паров,
`p_(н.п.)` – давление насыщенных паров.
Запишем также уравнение Менделеева-Клапейрона
`p_(в.п.)V = M/μ *RT`, где
V – объём сосуда,
M – масса водяного пара,
μ – молярная масса водяного пара,
T – температура.
Тогда для начального состояния (до работы увлажнителя) и после работы увлажнителя
`φ_1p_(н.п)V = M_1/μ*RT`,
`φ_2p_(н.п)V = M_2/μ*RT`
При этом M2 − M1 = Δm , значит
`φ_2p_(н.п)V = M/μ RT + Δm/μ*RT = φ_1p_(н.п)V + Δm/μ*RT`
Отсюда
`φ_2 = φ_1+ (ΔmRT)/(μ*p_(н.п)V) = 0,3+ (0.3*8.31*283)/(18*10^-3*1.23*10^3*60) = 0,83`
Ответ: 83 %
Номер: 211F34
Дайте развернутый ответ.
В комнате размерами 6 м × 5 м × 3 м, в которой воздух имеет температуру 20 °C и относительную влажность 35%, включили увлажнитель воздуха производительностью 0,36 кг/ч. Сколько времени необходимо работать увлажнителю, чтобы относительная влажность воздуха в комнате стала равна 70%? Давление насыщенного водяного пара при температуре 20 °C равно 2,33 кПа. Комнату считать герметичным сосудом.
КЭС: 2.1.1 Модели строения газов, жидкостей и твердых тел
2.1.2 Тепловое движение атомов и молекул вещества
2.1.3 Взаимодействие частиц вещества
2.1.4 Диффузия. Броуновское движение
2.1.5 Модель идеального газа в МКТ: молекулы газа движутся хаотически и не взаимодействуют друг с другом
2.1.6 Связь между давлением и средней кинетической энергией поступательного теплового движения молекул идеального газа (основное уравнение МКТ)
2.1.7 Абсолютная температура
2.1.8 Связь температуры газа со средней кинетической энергией поступательного теплового движения его молекул
2.1.9 Уравнение p=nkT
2.1.10 Модель идеального газа в термодинамике
2.1.11 Закон Дальтона для давления смеси разреженных газов
2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
2.1.13 Насыщенные и ненасыщенные пары. Качественная зависимость плотности и давления насыщенного пара от температуры, их независимость от объёма насыщенного пара
2.1.14 Влажность воздуха
2.1.15 Изменение агрегатных состояний вещества: испарение и конденсация, кипение жидкости
2.1.16 Изменение агрегатных состояний вещества: плавление и кристаллизация
2.1.17 Преобразование энергии в фазовых переходах
Решение:
Объем комнаты равен
V = 6*5*3=90 м3
Относительная влажность воздуха - это отношение давления водяного пара к давлению насыщенного пара при этой же температуре, т. е.
φ = (р/р0) * 100%.
Давление насыщенного водяного пара при температуре 20 °С равно 2,33 кПа
`35 = р/(2,33) * 100%`
`p_1=φ_1*р_(нп)`
`p_2=φ_2*р_(нп)`
Масса выделенной воды будет равна:
`m_в = ρV_в = ρPt`
t - время, Р - производительность, ρ - плотность воды, чтобы перевести литры в г
Увлажнитель повышает содержание водяного пара путем испарения воды. Тем самым в комнате увеличивается масса водяного пара в воздухе и как следствие увеличивается влажность.
`m_2 = m_1 +ρPt`
m_2 - конечная масса воды
Запишем уравнение Менделеева — Клапейрона для двух состояний водяного пара:
`p_1V=m_1/M RT`
`p_2V=m_2/M RT`
Вычтем из нижнего уравнения верхнее:
`p_2V-p_1V=(RT)/M (m_2-m_1) = (RT)/M *ρPt`
Выразим отсюда время:
`t = (VM(p_2-p_1))/(RTρP)=(VMp_(нп)(φ_2-φ_1))/(RTρP) = (90*18*10^-3*2.33*10^3(0.7-0.35))/(8.31*293*0.36*10^-3*1000)≈1,5`ч
Ответ:1,5ч
Номер: 27AA31
Дайте развернутый ответ.
Сосуд с воздухом, отделённым от атмосферы поршнем, поместили в сосуд с водой и прикрепили ко дну кастрюли нитью, не дающей сосуду всплыть на поверхность. Начальная температура воздуха в сосуде и воды в кастрюле t1 =18 °С. Кастрюлю помещают в холодильник. Ниже какой температуры t2 должна охладиться вода, чтобы сосуд опустился на дно кастрюли? Начальный объём воздуха в сосуде V1 = 2 дм3. Масса сосуда с поршнем m = 2,2 кг. Сосуд и поршень изготовлены из стали, плотность которой ρ = 7800 кг/м3. Поршень может скользить без трения со стенками сосуда. Считать массу воздуха в сосуде намного меньшей, чем масса сосуда с поршнем.
КЭС: 2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
Решение:
По закону Гей-Люссака:
`V_1/V_2=Т_1/Т_2`
`Т_2 = V_2 *T_2/V_1`
При понижении температуры воды, воздух в сосуде будет изобарно охлаждаться, объем воздуха уменьшится. Тогда уменьшится суммарный объем воздуха и сосуда.
Силы натяжения нитей станут равными нулю. Тело будет тонуть при условии, что
Fa < mg.
Сила Архимеда:`F_a= ρ_0gV`, где `V = Vc + V_2`.
Объем сосуда с поршнем
`V_c=m/ρ`
Отсюда:
`ρ_0(m/ρ+V_2)<m`
`V_2 <(m(ρ-ρ_0))/(ρρ_0)`
Значит, температура воды:
`T_2 < (m(ρ-ρ_0)T_1)/(ρρ_0V_1)=(2,2 ∗ (7,8 − 1) ∗ 10^3∗ 291)/(10^3 ∗ 7,8 ∗ 10^3 ∗ 2 ∗ 10^−3) ≈ 279 К`
𝑡2 < 6℃
Ответ: ниже 6°C
Номер: ACC239
Дайте развернутый ответ.
В вольфрамовом цилиндре под поршнем водород при атмосферном давлении и температуре 300 К занимает объём 0,1 л. При нагревании водорода в цилиндре при постоянном давлении часть молекул распадается согласно реакции H2↔H+H, причём процент α распавшихся молекул увеличивается с ростом температуры T, как показано на рисунке (α –отношение числа распавшихся молекул к первоначальному числу молекул, выраженное в процентах). Какой объём занимает смесь газов в цилиндре при температуре 3000 К?
КЭС: 2.1.10 Модель идеального газа в термодинамике
Решение:
| `P_o = 10^5 Па` `T_o = 300 К` `V_o = 0,1 k` Т = 3000 К _____________ V - ? |
`p_0V_0 = v_0RT_0` `p_0V = 1.2v_0RT` `V/V_0 = (1.2T)/N_0` `V = V_0*(1.2T)/T_0 = (0.1*1.2*3000)/300 = 1.2 л` |
Ответ:1,2 л
Номер: A9E186
Дайте развернутый ответ.
Два теплоизолированных сосуда, объёмы которых V1 = 2V и V2 = V, соединены между собой трубкой с вентилем. Вентиль закрыт. Сосуды содержат соответственно разреженный аргон и разреженный криптон в количествах n1 и n2 = 2n1 при температурах Т1 и Т2 = 2Т1 соответственно. Каким будет давление в сосудах, если вентиль открыть?
КЭС: 2.1.1 Модели строения газов, жидкостей и твердых тел
2.1.2 Тепловое движение атомов и молекул вещества
2.1.3 Взаимодействие частиц вещества
2.1.4 Диффузия. Броуновское движение
2.1.5 Модель идеального газа в МКТ: молекулы газа движутся хаотически и не взаимодействуют друг с другом
2.1.6 Связь между давлением и средней кинетической энергией поступательного теплового движения молекул идеального газа (основное уравнение МКТ)
2.1.7 Абсолютная температура
2.1.8 Связь температуры газа со средней кинетической энергией поступательного теплового движения его молекул
2.1.9 Уравнение p=nkT
2.1.10 Модель идеального газа в термодинамике
2.1.11 Закон Дальтона для давления смеси разреженных газов
2.1.12 Изопроцессы в разреженном газе с постоянным числом молекул N (с постоянным количеством вещества ν)
2.1.13 Насыщенные и ненасыщенные пары. Качественная зависимость плотности и давления насыщенного пара от температуры, их независимость от объёма насыщенного пара
2.1.14 Влажность воздуха
2.1.15 Изменение агрегатных состояний вещества: испарение и конденсация, кипение жидкости
2.1.16 Изменение агрегатных состояний вещества: плавление и кристаллизация
2.1.17 Преобразование энергии в фазовых переходах
Решение:
Поскольку сосуды теплоизолированы, а газы при открытии вентиля работу не совершают, то в соответствии с первым началом термодинамики суммарная внутренняя энергия газов сохраняется:
`(3v_1RT_1)/2+(3v_2RT_2)/2=3/2(v_1+v_2)RT_k
откуда
` T_k=5/3*T_1`
В соответствии с уравнением Менделеева-Клапейрона для парциальных давлений газов после открывания вентиля имеем:
`p_1=(v_1RT_k)/(3V)`
`p_2=(v_2RT_k)/(3V)`
Согласно закону Дальтона для суммарного давления смеси газов получаем:
`p = p_1+p_2=((v_1+v_2)RT_k)/(3V)=(v_1RT_k)/V=5/3*(v_1RT_1)/V`
Ответ: `(5v_1RT_1)/(3V)`
Номер: C0FF8E

