В демо 2023 года по сравнению с 2022-м поменялись местами задание 33-е с 34-м, остальное без изменений.
В демонстрационном варианте представлено по несколько примеров заданий на некоторые позиции экзаменационной работы. В реальных вариантах экзаменационной работы на каждую позицию будет предложено только одно задание.
Будет доступна таблица растворимости, электрохимический ряд напряжений и периодическая система Менделеева.
Экзаменационная работа состоит из двух частей, включающих в себя 34 задания. Часть 1 содержит 28 заданий с кратким ответом, часть 2 содержит 6 заданий с развёрнутым ответом. На выполнение экзаменационной работы по химии отводится 3,5 часа (210 минут).
Ответом к заданиям части 1 является последовательность цифр или число. Ответ запишите в поле ответа в тексте работы, а затем перенесите в бланк ответов № 1. Последовательность цифр в заданиях 1–25 запишите без пробелов, запятых и других дополнительных символов.
Ответы к заданиям 29–34 включают в себя подробное описание всего хода выполнения задания. В бланке ответов № 2 укажите номер задания и запишите его полное решение.
Все бланки ЕГЭ заполняются яркими чёрными чернилами. Допускается использование гелевой или капиллярной ручки.
При выполнении заданий можно пользоваться черновиком. Записи в черновике, а также в тексте контрольных измерительных материалов не учитываются при оценивании работы.
При выполнении работы используйте Периодическую систему химических элементов Д.И. Менделеева, таблицу растворимости солей, кислот и оснований в воде, электрохимический ряд напряжений металлов. Эти сопроводительные материалы прилагаются к тексту работы. Для вычислений используйте непрограммируемый калькулятор.
Баллы, полученные Вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов. После завершения работы проверьте, чтобы ответ на каждое задание в бланках ответов № 1 и № 2 был записан под правильным номером.
Часть 1
Ответом к заданиям 1–25 является последовательность цифр. Ответ запишите в поле ответа в тексте работы, а затем перенесите в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки. Последовательность цифр записывайте без пробелов, запятых и других дополнительных символов. Каждый символ пишите в отдельной клеточке в соответствии с приведёнными в бланке образцами. Цифры в ответах на задания 7, 8, 10, 14, 15, 19, 20, 22, 23, 24, 25 могут повторяться.
Для выполнения заданий 1–3 используйте следующий ряд химических элементов:
1) Cs 2) C 3) O 4) Cr 5) N
Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
1 Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют одинаковое число неспаренных электронов.
Запишите номера выбранных элементов.
Ответ: 23
2 Из указанных в ряду химических элементов выберите три p-элемента.
Расположите выбранные элементы в порядке уменьшения их атомного радиуса.
Запишите номера выбранных элементов в нужной последовательности.
Ответ: 253
3 Из числа указанных в ряду элементов выберите два элемента, которые имеют одинаковую разность между значениями их высшей и низшей степеней окисления.
Запишите номера выбранных элементов.
Ответ: 25
4 Из предложенного перечня выберите два вещества молекулярного строения с ковалентной полярной связью.
1) Na2SO4
2) HCOOH
3) CH4
4) CaO
5) Cl2
Запишите номера выбранных ответов.
Ответ: 23
5 Среди предложенных формул/названий веществ, расположенных в пронумерованных ячейках, выберите формулы/названия: А) двухоснóвной кислоты; Б) средней соли; В) амфотерного гидроксида.
1 NaH2PO4
2 Zn(OH)2
3 HNO2
4 H2SO3
5 фосфин
6 ZnO
7 цинк
8 аммиачная селитра
9 Fe(OH)2
Запишите в таблицу номера ячеек, в которых расположены выбранные вещества, под соответствующими буквами.
А Б В
Ответ: 4 8 2
6 В одну из пробирок с осадком гидроксида алюминия добавили сильную кислоту X, а в другую – раствор вещества Y. В результате в каждой из пробирок наблюдали растворение осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) бромоводородная кислота
2) гидросульфид натрия
3) сероводородная кислота
4) гидроксид калия
5) гидрат аммиака
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
X Y
Ответ: 1 4
7 Установите соответствие между веществом и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) S
Б) SO3
В) Zn(OH)2
Г) ZnBr2 (р-р)
РЕАГЕНТЫ
1) AgNO3, Na3PO4, Cl2
2) BaO, H2O, KOH
3) H2, Cl2, O2
4) HBr, LiOH, CH3COOH (р-р)
5 ) H3PO4 (р-р), BaCl2, CuO
Запишите в таблицу выбранные цифры под соответствующими буквами.
А Б В Г
Ответ: 3 2 4 1
8 Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ИСХОДНЫЕ ВЕЩЕСТВА
А) Mg и H2SO4 (конц.)
Б) MgО и H2SO4
В) S и H2SO4 (конц.)
Г) H2S и O2 (изб.)
ПРОДУКТЫ РЕАКЦИИ
1) MgSO4 и H2O
2) MgO, SO2 и H2O
3) H2S и H2O
4) SO2 и H2O
5) MgSO4, H2S и H2O
6) SО3 и H2О
Запишите в таблицу выбранные цифры под соответствующими буквами.
А Б В Г
Ответ: 5 1 4 4
9 Задана следующая схема превращений веществ:
Fe Y
X → FeCl3 → FeCl2
Определите, какие из указанных веществ являются веществами X и Y.
1) HCl
2) CuCl2
3) KI
4) Cl2
5) AgI
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
X Y
Ответ: 4 3
10 Установите соответствие между формулой вещества и классом/группой органических соединений, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) H
N
/ \
\ /
Б) H2C-CH2-CH2-C=O
| |
NH2 O OH
||
В) H2C-C-NH-CH2-C=O
| |
NH2 OH
КЛАСС/ГРУППА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1) дипептиды
2) амины
3) аминокислоты
4) карбоновые кислоты
Запишите в таблицу выбранные цифры под соответствующими буквами.
А Б В
Ответ: 2 3 1
11 Из предложенного перечня выберите два вещества, которые являются структурными изомерами бутена-1.
1) бутан
2) циклобутан
3) бутин-2
4) бутадиен-1,3
5) метилпропен
Запишите номера выбранных ответов.
Ответ: 25
12 Из предложенного перечня выберите все вещества, при взаимодействии которых с раствором перманганата калия в кислой среде образуется карбоновая кислота.
1) гексен-1
2) бензол
3) метилбензол
4) метилэтиловый эфир
5) уксусный альдегид
Запишите номера выбранных ответов.
Ответ: 135
13 Из предложенного перечня выберите два вещества, с которыми реагирует метиламин.
1) пропан
2) хлорметан
3) водород
4) гидроксид натрия
5) соляная кислота
Запишите номера выбранных ответов.
Ответ: 25
14 Установите соответствие между схемой реакции и веществом Х, принимающим в ней участие: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) CH3CHClCH2Cl + X → CH3CH=CH2
Б) CH3CH2CH2Cl + X → CH3CH=CH2
В) CH3CH2Cl + X → CH3CH2CH2CH3
Г) CH3CHClCH2Cl + X → CH3C≡CH
ВЕЩЕСТВО Х
1) Mg
2) NaOH (спирт.)
3) NaOH (водн.)
4) Cu(OH)2
5) Na
6) Cu
Запишите в таблицу выбранные цифры под соответствующими буквами.
А Б В Г
Ответ: 1 2 5 2
15 Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
A) уксусная кислота и сульфид натрия
Б) муравьиная кислота и гидроксид натрия
В) муравьиный альдегид и гидроксид меди(II) (при нагревании)
Г) этанол и натрий
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) пропионат натрия
2) этилат натрия
3) формиат меди(II)
4) формиат натрия
5) ацетат натрия
6) углекислый газ
Запишите в таблицу выбранные цифры под соответствующими буквами.
А Б В Г
Ответ: 5 4 6 2
16 Задана схема превращений веществ:
AlCl3, t
CH3-CH2-ОН → X → CH3-CH2-CH2-CH3 ⎯⎯⎯⎯→ Y
Определите, какие из указанных веществ являются веществами Х и Y.
1) 2-хлорбутан
2) этаналь
3) этилен
4) метилпропан
5) бромэтан
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
X Y
Ответ: 5 4
17 Из предложенного перечня выберите все реакции, которые являются
окислительно-восстановительными.
1) взаимодействие сульфида калия с перманганатом калия
2) взаимодействие концентрированной серной кислоты с хлоридом натрия
3) взаимодействие при нагревании хлорида аммония и нитрита натрия
4) взаимодействие при нагревании оксида кремния с карбонатом натрия
5) взаимодействие иодоводородной кислоты с дихроматом натрия
Запишите номера выбранных ответов.
Ответ: 135 .
18 Из предложенного перечня выберите все реакции, для которых увеличение давления не приводит к увеличению скорости реакции.
1) 2P + 5Cl2(г) = 2PCl5
2) Fe + CuSO4(р-р) = FeSO4 + Cu
3) Ca + 2H2O(ж) = Ca(OH)2 + H2
4) Fe2O3 + H2(г) = 2FeO + H2O
5) 2KOH(р-р) + H2SO4(р-р) = K2SO4 + 2H2O
Запишите номера выбранных ответов.
Ответ: 235
19 Установите соответствие между уравнением реакции и свойством элемента азота, которое он проявляет в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
УРАВНЕНИЕ РЕАКЦИИ
А) NH4HCO3 = NH3 + H2O + CO2
Б) 3СuO + 2NH3 = N2 + 3Cu + 3H2O
В) 4NH3 + 5O2 = 4NО + 6H2O
СВОЙСТВО АЗОТА
1) является окислителем
2) является восстановителем
3) является и окислителем, и восстановителем
4) не проявляет окислительно-восстановительных свойств
Запишите в таблицу выбранные цифры под соответствующими буквами.
А Б В
Ответ: 4 2 2
20 Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ
А) Na3PO4
Б) KCl
В) CuBr2
ПРОДУКТЫ ЭЛЕКТРОЛИЗА
1) металл, кислород
2) металл, галоген
3) водород, кислород
4) водород, галоген
Запишите в таблицу выбранные цифры под соответствующими буквами.
А Б В
Ответ: 3 4 2
ИЛИ
Установите соответствие между веществом и возможным способом его получения путём электролиза: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) алюминий
Б) кислород
В) калий
ПОЛУЧЕНИЕ ЭЛЕКТРОЛИЗОМ
1) раствора Al2O3 в расплавленном криолите
2) водного раствора KF
3) водного раствора AlCl3
4) расплава KF
Запишите в таблицу выбранные цифры под соответствующими буквами.
А Б В
Ответ: 1 2 4
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
Шкала pH водных растворов электролитов
pH 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
кислотная среда←↓→ щелочная среда
нейтральная
сильно слабо слабо сильно
кислая кислая щелочная щелочная
21 Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) Na2SO4
2) Fe(NO3)2
3) K2SO3
4) НClO3
Запишите номера веществ в порядке возрастания значения pH их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
Ответ: 4 → 2 → 1 → 3
22 Установите соответствие между способом воздействия на равновесную
систему
H2O(ж) + Al3+(р-р) ⇄ AlOH2+(р-р) + H+(р-р) – Q
и смещением химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВОЗДЕЙСТВИЕ НА СИСТЕМУ
А) добавление кислоты
Б) понижение давления
В) повышение температуры
Г ) добавление твёрдой щёлочи
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) смещается в сторону прямой реакции
2) смещается в сторону обратной реакции
3 ) практически не смещается
Запишите в таблицу выбранные цифры под соответствующими буквами.
А Б В Г
Ответ: 2 3 1 1
23 В реактор постоянного объёма поместили оксид серы(IV) и кислород.
В результате протекания обратимой реакции
2SO2(г) + О2(г) ⇄ 2SO3(г)
в реакционной системе установилось химическое равновесие.
Используя данные, приведённые в таблице, определите равновесную концентрацию SO2 (X) и исходную концентрацию O2 (Y).
Реагент SO2 O2 SO3
Исходная концентрация (моль/л) 0,6
Равновесная концентрация (моль/л) 0,3 0,4
Выберите из списка номера правильных ответов.
1) 0,1 моль/л
2) 0,2 моль/л
3) 0,3 моль/л
4) 0,4 моль/л
5) 0,5 моль/л
6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
X Y
Ответ: 2 5
24 Установите соответствие между формулами веществ и реагентом, с помощью которого можно различить водные растворы этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛЫ ВЕЩЕСТВ
А) HNO3 и NaNO3
Б) KCl и NaОН
В) NaCl и BaCl2
Г) AlCl3 и MgCl2
РЕАГЕНТ
1) Cu
2) KOH
3) HCl
4) KNO3
5) CuSO4
Запишите в таблицу выбранные цифры под соответствующими буквами.
А Б В Г
Ответ: 1 5 5 2
ИЛИ
Установите соответствие между реагирующими веществами и признаком протекающей между ними реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) пропановая кислота и литий
Б) пропанол-2 и калий
В) гидроксид цинка и уксусная кислота
Г) бромная вода и ацетилен
ПРИЗНАК РЕАКЦИИ
1) растворение осадка
2) образование осадка
3) видимые признаки реакции отсутствуют
4) выделение газа
5) обесцвечивание раствора
Запишите в таблицу выбранные цифры под соответствующими буквами.
А Б В Г
Ответ: 4 4 1 5
25 Установите соответствие между веществом и основной областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО ОБЛАСТЬ ПРИМЕНЕНИЯ
А) метан 1) получение капрона
Б) изопрен 2) в качестве топлива
В) этилен 3) получение каучука
4) получение пластмасс
Запишите в таблицу выбранные цифры под соответствующими буквами.
А Б В
Ответ: 2 3 4
ИЛИ
Установите соответствие между названием мономера и формулой соответствующего ему полимера: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ МОНОМЕРА
А) этен
Б) пропен
В) дивинил
ФОРМУЛА ПОЛИМЕРА
1) (–СН2–СН(СН3)–)n
2) (–CH2–CH2–)n
3) (–СН2–С(CН3)=CH–CH2–)n
4) (–СН2–СН=CH–CH2–)n
Запишите в таблицу выбранные цифры под соответствующими буквами.
А Б В
Ответ: 2 1 4
ИЛИ
Установите соответствие между аппаратом химического производства и процессом, протекающим в этом аппарате: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
АППАРАТ
А) контактный аппарат
Б) ректификационная колонна
В) поглотительная башня
ПРОЦЕСС
1) перегонка нефти
2) поглощение оксида серы(VI)
3) окисление сернистого газа
4) очистка сернистого газа
Запишите в таблицу выбранные цифры под соответствующими буквами.
А Б В
Ответ: 3 1 2
Ответом к заданиям 26–28 является число. Запишите это число в поле ответа в тексте работы, соблюдая при этом указанную степень точности. Затем перенесите это число в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки.
Каждый символ пишите в отдельной клеточке в соответствии с приведёнными в бланке образцами. Единицы измерения физических величин в бланке ответа указывать не нужно.
При проведении расчётов для всех элементов, кроме хлора, используйте значения относительных атомных масс, выраженные целыми числами (Ar(Cl) = 35,5).
26 Вычислите массу нитрата калия (в граммах), которую следует растворить в 150 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%. (Запишите число с точностью до десятых.)
Ответ: 3,4 г.
27 Синтез аммиака протекает в соответствии с термохимическим уравнением реакции
N2(г) + 3Н2(г) = 2NН3(г) + 92 кДж.
Определите количество теплоты, которое выделится в результате образования 560 мл (н.у.) газообразного аммиака. (Запишите число с точностью до сотых.)
Ответ: 1,15 кДж.
28 Из 150 кг природного известняка при взаимодействии с азотной кислотой был получен нитрат кальция массой 196,8 кг. Вычислите массовую долю (%) примесей в указанном известняке. (Запишите число с точностью до целых.)
Ответ: 20 %.
ИЛИ
В результате реакции тримеризации ацетилена объёмом 26,88 л (н.у) получили 23,4 г бензола. Вычислите массовую долю выхода продукта реакции от теоретически возможного. (Запишите число с точностью до целых.)
Ответ: 75 %.
Не забудьте перенести все ответы в бланк ответов № 1 в соответствии с инструкцией по выполнению работы.
Проверьте, чтобы каждый ответ был записан в строке с номером соответствующего задания.
Часть 2
Для записи ответов на задания 29–34 используйте БЛАНК ОТВЕТОВ № 2. Запишите сначала номер задания (29, 30 и т.д.), а затем его подробное решение. Ответы записывайте чётко и разборчиво.
Для выполнения заданий 29 и 30 используйте следующий перечень веществ: перманганат калия, гидрокарбонат натрия, сульфит натрия, сульфат бария, гидроксид калия, пероксид водорода. Допустимо использование воды в качестве среды протекания реакции.
29 Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета раствора. Выделение осадка или газа в ходе этой реакции не наблюдается.
В ответе запишите уравнение только одной из возможных окислительно- восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Ответ:
Na2SO3 + 2KMnO4 + 2KOH = Na2SO4 + 2K2MnO4 + H2O
2 | Mn+7 + ē → Mn+6
1 | S+4 – 2ē → S+6
Сульфит натрия (или сера в степени окисления +4) является восстановителем.
Перманганат калия (или марганец в степени окисления +7) – окислителем
30 Из предложенного перечня веществ выберите кислую соль и вещество, которое вступает с этой кислой солью в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Ответ:
2NaHCO3 + 2KOH = Na2CO3 + K2CO3 + 2H2O
2Na+ + 2HCO3– + 2K+ + 2OH– = 2Na+ + 2K+ + 2CO32– + 2H2O
HCO3– + OH– = CO32– + H2O
31 При электролизе водного раствора нитрата меди(II) получили металл. Металл обработали концентрированной серной кислотой при нагревании.
Выделившийся в результате газ прореагировал с сероводородом с образованием простого вещества. Это вещество нагрели с концентрированным раствором гидроксида калия.
Напишите молекулярные уравнения четырёх описанных реакций.
Ответ:
1) 2Cu(NO3)2 + 2H2O = 2Cu + 4HNO3 + O2 (электролиз)
2) Cu + 2H2SO4(конц.) = CuSO4 + SO2↑ + 2H2O
3) SO2 + 2H2S = 3S + 2H2O
4) 3S + 6KOH = 2K2S + K2SO3 + 3H2O
(возможно образование K2S2O3)
32 Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
H2 (избыток), Pt
гексан → X1 ⎯⎯⎯⎯⎯⎯⎯→ циклогексан →
K2Cr2O7, H2SO4, t°
→ X2 → X3 ⎯⎯⎯⎯⎯⎯⎯⎯→ ![]()
При написании уравнений реакций указывайте преимущественно образующиеся продукты, используйте структурные формулы органических веществ.
Ответ:
кат., t°
1) CH3-CH2-CH2-CH2-CH2-CH3 ⎯⎯⎯⎯⎯⎯→+ 4H2
Pt, t°
2)+ 3H2 ⎯⎯⎯⎯⎯⎯→
hν
3)+ Cl2 ⎯⎯⎯⎯⎯⎯→
+ HCl
(возможна реакция бромирования)
H2O, t °
4)+ KOH ⎯⎯⎯⎯⎯⎯→
+ KCl
5) 3+ K2Cr2O7 + 4H2SO4 ⎯⎯⎯⎯⎯⎯→ 3
+ Cr2(SO4)3 + K2SO4 + 7H2O
33 При сгорании органического вещества А массой 3,4 г получено 4,48 л (н.у.) углекислого газа и 1,8 г воды. Известно, что вещество А вступает в реакцию с раствором гидроксида лития при нагревании, в результате чего образуется предельный одноатомный спирт и соль, кислотный остаток которой содержит семь атомов углерода.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения и обозначения искомых физических величин) и установите молекулярную формулу вещества А;
2) составьте возможную структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции вещества А с раствором гидроксида лития при нагревании (используйте структурные формулы органических веществ).
Ответ:
n(CO2) = 4,48 / 22,4 = 0,2 моль; n(С) = 0,2 моль
n(H2O) = 1,8 / 18 = 0,1 моль; n(H) = 0,1 · 2 = 0,2 моль
m(C + H) = 0,2 · 12 + 0,2 · 1 = 2,6 г
m(О) = 3,4 – 2,6 = 0,8 г
n(O) = 0,8 / 16 = 0,05 моль
n(С) : n(Н) : n(O) = 0,2 : 0,2 : 0,05 = 4 : 4 : 1
Молекулярная формула вещества А: C8H8O2
Структурная формула вещества А:
Уравнение реакции с раствором гидроксида лития:
t°+ LiOH ⎯⎯→
+ CH3OH
34 Смесь кальция и карбоната кальция, в которой массовая доля атомов кальция составляет 50%, растворили в 300 г соляной кислоты, взятой в избытке. При этом образовался раствор массой 330 г. Один из выделившихся газов был поглощён 400 г 4%-ного раствора гидроксида натрия. Вычислите массовую долю соли в образовавшемся после поглощения газа растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения и обозначения искомых физических величин).
Ответ:
[1] Ca + 2HCl = CaCl2 + H2
[2] CaCO3 + 2HCl = CaCl2 + CO2 + H2O
[3] CO2 + NaOH = NaHCO3
Δm(р-ра) = 330 – 300 = 30 г
Пусть в исходной смеси
n(Ca) = х моль
n(CaCO3) = y моль
Тогда:
Δm(р-ра) = 40х + 100у – 2х – 44у = 30 г
ω(Ca) = 40(х + у) / (40x + 100у) = 0,5
n(Ca) = x = 0,2 моль
n(CaCO3) = y = 0,4 моль
n(CO2) = n(CaCO3) = 0,4 моль
m(CO2) = 0,4 · 44 = 17,6 г
m(NaOH) = 400 · 0,04 = 16 г
n(NaOH) = 16 / 40 = 0,4 моль
n(NaHCO3) = n(NaOH) = 0,4 моль
m(NaHCO3) = 0,4 · 84 = 33,6 г
Массовая доля соли в растворе:
m(р-ра) = 400 + 17,6 = 417,6 г
ω(NaHCO3) = 33,6 / 417,6 = 0,08, или 8%
Проверьте, чтобы каждый ответ был записан рядом с номером соответствующего задания.
Система оценивания ЕГЭ по химии
Часть 1
За правильный ответ на каждое из заданий 1–5, 9–13, 16–21, 25–28 ставится 1 балл.
Задание считается выполненным верно, если экзаменуемый дал правильный ответ в виде последовательности цифр или числа с заданной степенью точности.
Номер Правильный
задания ответ
1 23
2 253
3 25
4 23
5 482
9 43
10 231
11 25
12 135
13 25
16 54
17 135
18 235
19 422
20 342 / 124
21 4213
25 234 / 214 / 312
26 3,4
27 1,15
28 20 / 75
Задания 6–8, 14, 15, 22, 23 и 24 считаются выполненными верно, если правильно указана последовательность цифр.
За полный правильный ответ заданий 6–8, 14, 15, 22, 23 и 24 ставится 2 балла; если допущена одна ошибка – 1 балл; за неверный ответ (более одной ошибки) или его отсутствие – 0 баллов.
Номер Правильный
задания ответ
6 14
7 3241
8 5144
14 1252
15 5462
22 2311
23 25
24 1552 / 4415
Часть 2
Критерии оценивания выполнения заданий с развёрнутым ответом
При наличии уравнений химических реакций, отражающих дополнительные/альтернативные химические превращения, не противоречащие условиям заданий, а также соответствующих им расчётов (в заданиях 33 и 34) эксперт оценивает правильность представленного экзаменуемым решения в соответствии со шкалой и критериями оценивания.
Для выполнения заданий 29 и 30 используйте следующий перечень веществ: перманганат калия, гидрокарбонат натрия, сульфит натрия, сульфат бария, гидроксид калия, пероксид водорода. Допустимо использование воды в качестве среды протекания реакции.
Задание 29 Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета раствора. Выделение осадка или газа в ходе этой реакции не наблюдается.
В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ.
Составьте электронный баланс, укажите окислитель и восстановитель.
Содержание верного ответа к заданию 29 и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла)
Вариант ответа
Na2SO3 + 2KMnO4 + 2KOH = Na2SO4 + 2K2MnO4 + H2O
2 | Mn+7 + ē → Mn+6
1 | S+4 – 2ē → S+6
Сульфит натрия (или сера в степени окисления +4) является восстановителем.
Перманганат калия (или марганец в степени окисления +7) – окислителем
Ответ правильный и полный, содержит следующие элементы:
• выбраны вещества, и записано уравнение окислительно- восстановительной реакции;
• составлен электронный баланс, указаны окислитель и восстановитель - 2 балла
Правильно записан один элемент ответа - 1
Все элементы ответа записаны неверно - 0
Максимальный балл 2
Примечание. Если молекулярное уравнение реакции не соответствует условию задания или в нём неверно определены продукты реакции, то электронный баланс не оценивается (выставляется 0 баллов).
Задание 30 Из предложенного перечня веществ выберите кислую соль и вещество, которое вступает с этой кислой солью в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Содержание верного ответа к заданию 30 и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла)
Вариант ответа
2NaHCO3 + 2KOH = Na2CO3 + K2CO3 + 2H2O
2Na+ + 2HCO3– + 2K+ + 2OH– = 2Na+ + 2K+ + 2CO32– + 2H2O
HCO3– + OH– = CO32– + H2O
Ответ правильный и полный, содержит следующие элементы:
• выбраны вещества, и записано молекулярное уравнение реакции ионного обмена;
• записаны полное и сокращённое ионное уравнения реакций 2
Правильно записан один элемент ответа 1
Все элементы ответа записаны неверно 0
Максимальный балл 2
Задание 31 При электролизе водного раствора нитрата меди(II) получили металл. Металл обработали концентрированной серной кислотой при нагревании. Выделившийся в результате газ прореагировал с сероводородом с образованием простого вещества. Это вещество нагрел с концентрированным раствором гидроксида калия.
Напишите молекулярные уравнения четырёх описанных реакций.
Содержание верного ответа к заданию 31 и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла)
Вариант ответа
1) 2Cu(NO3)2 + 2H2O = 2Cu + 4HNO3 + O2 (электролиз)
2) Cu + 2H2SO4(конц.) = CuSO4 + SO2↑ + 2H2O
3) SO2 + 2H2S = 3S + 2H2O
4) 3S + 6KOH = 2K2S + K2SO3 + 3H2O
(возможно образование K2S2O3)
Правильно записаны четыре уравнения реакций 4
Правильно записаны три уравнения реакций 3
Правильно записаны два уравнения реакций 2
Правильно записано одно уравнение реакции 1
Все уравнения реакций записаны неверно 0
Максимальный балл 4
Задание 32 Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
H2 (избыток), Pt
гексан → X1 ⎯⎯⎯⎯⎯⎯⎯→ циклогексан →
K2Cr2O7, H2SO4, t°
→ X2 → X3 ⎯⎯⎯⎯⎯⎯⎯⎯→ ![]()
При написании уравнений реакций указывайте преимущественно образующиеся продукты, используйте структурные формулы органических веществ.
Содержание верного ответа к заданию 32 и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла)
Вариант ответа
кат., t°
1) CH3-CH2-CH2-CH2-CH2-CH3 ⎯⎯⎯⎯⎯⎯→ ![]() + 4H2
+ 4H2
Pt, t°
2) ![]() + 3H2 ⎯⎯⎯⎯⎯⎯→
+ 3H2 ⎯⎯⎯⎯⎯⎯→ ![]()
hν
3) ![]() + Cl2 ⎯⎯⎯⎯⎯⎯→
+ Cl2 ⎯⎯⎯⎯⎯⎯→ ![]() + HCl
+ HCl
(возможна реакция бромирования)
H2O, t °
4) ![]() + KOH ⎯⎯⎯⎯⎯⎯→
+ KOH ⎯⎯⎯⎯⎯⎯→ ![]() + KCl
+ KCl
5) 3![]() + K2Cr2O7 + 4H2SO4 ⎯⎯⎯⎯⎯⎯→ 3
+ K2Cr2O7 + 4H2SO4 ⎯⎯⎯⎯⎯⎯→ 3![]() + Cr2(SO4)3 + K2SO4 + 7H2O
+ Cr2(SO4)3 + K2SO4 + 7H2O
Правильно записаны пять уравнений реакций - 5 баллов
Правильно записаны четыре уравнения реакций - 4 балла
Правильно записаны три уравнения реакций - 3 балла
Правильно записаны два уравнения реакций - 2 балла
Правильно записано одно уравнение реакции - 1 балл
Все элементы ответа записаны неверно - 0 баллов
Максимальный балл 5
Примечание. Допустимо использование структурных формул разных видов (развёрнутой, сокращённой, скелетной), однозначно отражающих порядок связи атомов и взаимное расположение заместителей и функциональных групп в молекуле органического вещества.
Ответ к заданию 33 При сгорании органического вещества А массой 3,4 г получено 4,48 л (н.у.) углекислого газа и 1,8 г воды. Известно, что вещество А вступает в реакцию с раствором гидроксида лития при нагревании, в результате чего образуется предельный одноатомный спирт и соль, кислотный остаток которой содержит семь атомов углерода.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения и обозначения искомых физических величин) и установите молекулярную формулу вещества А;
2) составьте возможную структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции вещества А с раствором гидроксида лития при нагревании (используйте структурные формулы органических веществ).
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла)
Вариант ответа
Проведены необходимые вычисления, и найдена молекулярная формула вещества А:
n(CO2) = 4,48 / 22,4 = 0,2 моль; n(С) = 0,2 моль
n(H2O) = 1,8 / 18 = 0,1 моль; n(H) = 0,1 · 2 = 0,2 моль
m(C + H) = 0,2 · 12 + 0,2 · 1 = 2,6 г
m(О) = 3,4 – 2,6 = 0,8 г
n(O) = 0,8 / 16 = 0,05 моль
n(С) : n(Н) : n(O) = 0,2 : 0,2 : 0,05 = 4 : 4 : 1
Молекулярная формула – C8H8O2
Приведена структурная формула вещества А:
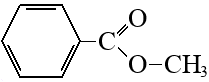
Составлено уравнение реакции с раствором гидроксида лития:
t°![]() + LiOH ⎯⎯→
+ LiOH ⎯⎯→ ![]() + CH3OH
+ CH3OH
Ответ правильный и полный, содержит следующие элементы:
• правильно произведены вычисления, необходимые для установления молекулярной формулы вещества, и записана молекулярная формула вещества;
• записана структурная формула органического вещества, которая отражает порядок связи и взаимное расположение заместителей и функциональных групп в молекуле в соответствии с условием задания;
• с использованием структурной формулы органического вещества записано уравнение реакции, на которую даётся указание в условии задания - 3 балла
Правильно записаны два элемента ответа - 2 балла
Правильно записан один элемент ответа - 1 балл
Все элементы ответа записаны неверно - 0 баллов
Максимальный балл 3
Задание 34 Смесь кальция и карбоната кальция, в которой массовая доля атомов кальция составляет 50%, растворили в 300 г соляной кислоты, взятой в избытке. При этом образовался раствор массой 330 г. Один из выделившихся газов был поглощён 400 г 4%-ного раствора гидроксида натрия. Вычислите массовую долю соли в образовавшемся после поглощения газа растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения и обозначения искомых физических величин).
Содержание верного ответа к заданию 33 и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла)
Вариант ответа
Записаны уравнения реакций:
[1] Ca + 2HCl = CaCl2 + H2
[2] CaCO3 + 2HCl = CaCl2 + CO2 + H2O
[3] CO2 + NaOH = NaHCO3
Рассчитаны количество вещества реагентов и массы продуктов реакций:
Δm(р-ра) = 330 – 300 = 30 г
Пусть в исходной смеси
n(Ca) = х моль
n(CaCO3) = y моль
Тогда:
Δm(р-ра) = 40х + 100у – 2х – 44у = 30 г
ω(Ca) = 40(х + у) / (40x + 100у) = 0,5
n(Ca) = x = 0,2 моль
n(CaCO3) = y = 0,4 моль
n(CO2) = n(CaCO3) = 0,4 моль
m(CO2) = 0,4 · 44 = 17,6 г
m(NaOH) = 400 · 0,04 = 16 г
n(NaOH) = 16 / 40 = 0,4 моль
n(NaHCO3) = n(NaOH) = 0,4 моль
m(NaHCO3) = 0,4 · 84 = 33,6 г
Вычислена массовая доля соли в растворе:
m(р-ра) = 400 + 17,6 = 417,6 г
ω(NaHCO3) = 33,6 / 417,6 = 0,08, или 8%
Ответ правильный и полный, содержит следующие элементы:
• правильно записаны уравнения реакций, соответствующих условию задания;
• правильно произведены вычисления, в которых используются необходимые физические величины, заданные в условии задания;
• продемонстрирована логически обоснованная взаимосвязь физических величин, на основании которой проводятся расчёты;
• в соответствии с условием задания определена искомая физическая величина 4
Правильно записаны три элемента ответа - 3
Правильно записаны два элемента ответа - 2
Правильно записан один элемент ответа - 1
Все элементы ответа записаны неверно - 0
Максимальный балл 4
Примечание. В случае, когда в ответе содержится ошибка в вычислениях, которая привела к неверному ответу, оценка за выполнение задания снижается только на 1 балл.

