ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Лабораторная работа №1.
Задание №1
ЛАБОРАТОРНАЯ РАБОТА № 1 «Механизмы саморегуляции»
Цель: провести исследование функций своего организма и объяснить полученные результаты с позиции понимания сущности механизмов саморегуляции.
Ход работы:
1. Измерьте собственный пульс, находясь в состоянии покоя. Запишите результат в тетрадь.
2. Сделайте десять интенсивных и глубоких приседаний. Повторно измерьте пульс. Запишите полученные данные в тетрадь.
3. Сравните полученные результаты и сделайте вывод.
Ответ:
1. Мой пульс, находясь в состоянии покоя, составляет 58 ударов в минуту.
2. После нагрузки пульс − 100 ударов в минуту.
3. Вывод: мы видим, что после активной нагрузки пульс повышается. Повышается он за счет того, что кровь начинает течь по сосудам интенсивнее для питания тканей кислородом (эритроциты в крови переносят кислород).
Лабораторная работа №2.
Задание №1
ЛАБОРАТОРНАЯ РАБОТА № 2 «Обнаружение липидов с помощью качественной реакции»
Цель: показать наличие липидов в биологических объектах.
Оборудование: штатив с пробирками, водяная баня, мерный стакан объёмом 50 мл.
Реактивы: подсолнечное (или любое растительное) масло, 10 %−ный раствор гидроксида натрия, плод фенхеля.
Ход работы:
1. В пробирку налейте 1 мл растительного масла, прибавьте щепотку ванилина и прилейте 4−5 капель 10 %−ного NaOH. Нагрейте на водяной бане. Наблюдается жёлто−оранжевая окраска.
2. Плод фенхеля поместите на поверхность дистиллированной воды, при этом он начнёт непрерывно вращаться.
3. Внесите на поверхность дистиллированной воды небольшое количество растительного масла − движение фенхеля мгновенно прекратится.
4. Запишите результаты эксперимента и сделайте вывод
Ответ:
1. В пробирке мы можем наблюдать желто−оранжевую окраску, так как это является качественной реакцией на липиды.
2. Плод фенхеля поместили на поверхность дистиллированной воды, при этом он начал непрерывно вращаться.
3. Внесли на поверхность дистиллированной воды небольшое количество растительного масла − движение фенхеля мгновенно прекратилось, так как растительное масло не растворяется в воде.
4. Вывод: этот опыт показывает наличие липидов в клетках организма.
Лабораторная работа №3.
Задание №1
ЛАБОРАТОРНАЯ РАБОТА № 3 «Обнаружение углеводов с помощью качественной реакции»
Выполните лабораторную работу «Обнаружение углеводов с помощью качественной реакции» на с. 200.
Цель: показать наличие углеводов в биологических объектах.
Оборудование: штатив с пробирками, пипетки ёмкостью 1 мл, водяная баня.
Реактивы: холодная вода со льдом, 1 %−ный раствор крахмала, 1 %−ный раствор иода в иодиде калия (раствор Люголя).
Ход работы:
1. К 10—12 каплям 1 %−ного раствора крахмала прибавьте каплю раствора Люголя. Запишите результат.
2. Осторожно нагрейте раствор на водяной бане (100 °С). Отметьте, что произошло с раствором. Запишите результат.
3. Аккуратно поставьте пробирку в холодную воду со льдом. Что происходит с раствором по мере его охлаждения?
4. Сделайте вывод. Объясните сущность наблюдаемых процессов.
Ответ:
1. Мы видим, как крахмал окрасился в синий цвет (качественная реакция на крахмал).
2. В результате нагревания раствора произошло его обесцвечивание.
3. По мере охлаждения раствор становится синего цваета.
4. Вывод: качественной реакцией на крахмал является раствор люголя, содержащий йод. Если нам нужно узнать, находится ли в биологическом объекте углевод, мы можем провести реакцию с йодом. Синий цвет обозначает наличие углеводов.
Лабораторная работа №4.
Задание №1
ЛАБОРАТОРНАЯ РАБОТА № 4 «Обнаружение белков с помощью качественной реакции»
Цель: показать наличие белков в биологических объектах.
Оборудование: штатив с пробирками, водяная баня, кристаллизатор со льдом, мерный стакан объёмом 50 мл.
Реактивы: куриное яйцо, концентрированная азотная кислота, раствор аммиака, гидроксид натрия, раствор медного купороса, вода.
Ход работы:
1. Приготовьте раствор белка.
2. Ксантопротеиновая реакция. В пробирку налейте 2−3 мл раствора белка и добавьте несколько капель азотной кислоты. Соблюдайте технику безопасности при работе с химическими реагентами! Нагрейте содержимое пробирки, при этом образуется жёлтый осадок. Охладите смесь и добавьте раствор аммиака до перехода жёлтой окраски в оранжевую.
3. Биуретовая реакция. В пробирку налейте 2−3 мл раствора белка и 2−3 мл раствора гидроксида натрия, затем 1−2 мл раствора медного купороса. Появляется фиолетовое окрашивание.
4. Запишите результаты эксперимента и сделайте вывод.
Ответ:
После приготовления раствора белка и добавления азотной кислоты мы получаем ксантопротеиновую реакцию (качественную реакцию). В результате получается раствор желтого цвета.
При добавлении к раствору белка гидроксида натрия, а затем медного купороса мы получаем биуретовую реакцию, раствор становится васильково−фиолетовым.
Вывод: Ксантопротеиновая и биуретовая реакции являются качественными реакциями на белки. В результате мы можем узнать о присутствии белка в биологическом объекте.
Лабораторная работа №5.
Задание №1
ЛАБОРАТОРНАЯ РАБОТА № 5 «Каталитическая активность ферментов (на примере амилазы)»
Цель: доказать каталитическое действие белков−ферментов, показать их высокую специфичность, а также зависимость их действия от условий среды.
Оборудование: штатив с пробирками, мерный цилиндр объёмом 50 мл, пипетки, водяная баня или термостат, термометр.
Реактивы: лёд, 1 %−ный раствор крахмала, 1 %−ный раствор иода в иодиде калия (раствор Люголя), 5 %−ный раствор сульфата меди(II), 10 %−ный раствор гидроксиданатрия, 2 %−ный раствор сахарозы, 0,2 %−ная соляная кислота, свежий 3 %−ный раствор пероксида водорода.
Ход работы:
1. Приготовление раствора слюны, содержащего фермент амилазу.
− Тщательно прополощите рот водой.
− Наберите 2−4 мл слюны в мерный цилиндр.
− Добавьте в цилиндр воды до объёма 10 мл.
2. В две пронумерованные пробирки налейте по 10 капель раствора крахмала.
3. В пробирку № 1 внесите четыре капли воды (контроль), а в пробирку № 2 − 4 капли раствора слюны.
4. Перемешайте и поставьте на водяную баню или в термостат на 15 мин при температуре 37 °С.
5. Из пробирки № 2 возьмите четыре капли исследуемого вещества и внесите их вдве разные пробирки (по две капли в каждую). В одну из них добавьте каплю раствора иода в иодиде калия. В другую − каплю раствора сульфата меди (II) и четыре капли раствора гидроксида натрия и осторожно нагрейте до кипения. Те же действия проделайте с содержимым контрольной пробирки (№ 1).
6. Оформите полученные результаты в виде таблицы.
7. Сделайте вывод на основе проведённого исследования.
Ответ:
Пробирка Результат Результат после закипания
№ 2.1 − с каплей раствора йода в иодиде калия Мы наблюдаем красное окрашивание с расщеплением крахмала После закипания цвет исчезает (раствор обесцвечивается)
№ 2.2 − с каплей раствора сульфата меди (II) и 4−мя каплями раствора гидроксида натрия Мы видим синее окрашивание Появление желтого осадка, который становится красно−коричневым
№ 1.1 − с каплей раствора йода в йодиде калия Появляется васильковое окрашивание в результате образования комплексного соединения Обесцвечивание раствора
№ 1.2 − с каплей раствора сульфата меди (II) и 4−мя каплями раствора гидроксида натрия Раствор становится мутным Раствор становится черного цвета
Вывод: в данном случае белок амилаза представляет собой фермент, который расщепляет (гидролизует) крахмал до мономеров. Данный фермент действует в зависимости от условий среды (температура).
Лабораторная работа №6.
Задание №1
ЛАБОРАТОРНАЯ РАБОТА № 6 «Выделение ДНК из ткани печени»
Метод основан на способности ДНП (дезоксинуклеопротеида) растворяться в солевых растворах большой ионной силы и выпадать в осадок при снижении их концентрации.
Цель: выделить из клеток печени ДНП−соединение, состоящее из ДНК и белков.
Оборудование: ступка с пестиком, мелкий песок, кристаллизатор, мерный цилиндр объёмом 50 мл, деревянные палочки с насечками, водяная баня, марля для фильтрования.
Реактивы: хлорид натрия (5 %−ный раствор, содержащий 0,04 % нитрата натрия), дистиллированная вода, печень свежая или мороженая.
Ход работы:
1. 2—3 г ткани печени тщательно разотрите в ступке с песком, постепенно приливая 35—40 мл раствора хлорида натрия.
2. Из двух слоёв марли сделайте фильтр и пропустите через него полученный вязкий раствор в кристаллизатор.
3. Цилиндром отмерьте шестикратный (по отношению к фильтрату) объём дистиллированной воды и медленно добавьте её в фильтрат.
4. Возьмите деревянную палочку и намотайте на неё образовавшиеся нити ДНП.
5. Сделайте вывод.
Ответ:
Вывод: в результате выпадения белых нитей дезоксирибонуклеопротеидов в осадок в солевых растворах, мы понимаем, что клетки печени очень богаты нуклеопротеидами.
Лабораторная работа №7.
Задание №1
ЛАБОРАТОРНАЯ РАБОТА № 7 «Сравнение строения клеток растений, животных, грибов и бактерий под микроскопом на готовых микропрепаратах и их описание»
Цель: на основе изучения клеток разных организмов выявить основные черты сходства и различия в их строении.
Оборудование: микроскоп, готовые микропрепараты клеток растений, животных, грибов и бактерий.
Ход работы:
1. Настройте микроскоп на малое увеличение и рассмотрите готовые микропрепараты.
2. Зарисуйте увиденное.
3. Переведите настройки микроскопа на большое увеличение и снова рассмотрите клетки организмов. Сделайте соответствующие рисунки.
4. Сделайте вывод на основе проведённого исследования.
Ответ:
Вывод: при малом увелечении мы можем увидеть только основные структуры клетки (ядро, плазматическая мембрана и цитоплазма), но не мембранные органоиды. В случае большего увлелечения мы можем наблюдать ЭПС, аппарат Гольджи, митохондрии и другие органоиды клетки.
Лабораторная работа №8.
Задание №1
ЛАБОРАТОРНАЯ РАБОТА № 8 «Наблюдение плазмолиза и деплазмолиза в клетках кожицы лука»
Цель: познакомиться с явлением плазмолиза растительной клетки.
Оборудование: микроскоп, покровные и предметные стёкла, препаровальная игла, пипетка, фильтровальная бумага, репчатый лук.
Реактивы: вода, дистиллированная вода, раствор иода, 3 %−ный раствор хлорида натрия.
Ход работы:
1. Приготовьте временный препарат растительной клетки. Для этого отделите от кусочка луковицы мясистую чешуйку. Пинцетом снимите с внутренней стороны чешуйки тонкую плёнку. Положите кусочек плёнки на предметное стекло, нанесите на него каплю раствора иода и накройте покровным стеклом.
2. Рассмотрите препарат при малом, а затем при большом увеличении. Найдите клеточную стенку, окрашенное иодом ядро (возможно, и ядрышки), цитоплазму, неокрашенные вакуоли. Зарисуйте и подпишите увиденное.
3. Нанесите на один край покровного стекла 3 %−ный раствор хлорида натрия, а с противоположной стороны положите полоску фильтровальной бумаги, которая впитает часть воды. Наблюдайте за состоянием цитоплазмы в клетках (при большом увеличении). Вода из цитоплазмы клетки будет переходить в окружающую среду. Объём цитоплазмы при этом уменьшится, и она начнёт отходить от клеточных стенок. Постепенно цитоплазма примет форму шара. Это явление называют плазмолизом. Зарисуйте увиденное, объясните происходящий процесс.
4. Добавьте под покровное стекло дистиллированную воду. Что происходит с цитоплазмой? Это явление называют деплазмолизом. Зарисуйте увиденное.
5. Сделайте вывод.
Ответ:
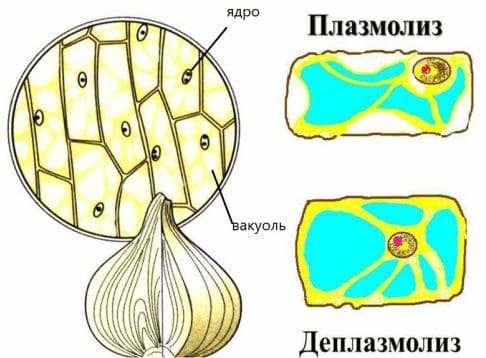 Плазмолиз происходит в результате того, что под воздействием более концентрированного внешнего раствора вода выходит из клетки. При помещении клетки в чистую воду или слабоконцентрированный раствор вода поступает в клетку. объем вакуоли возрастает, клеточный сок давит на цитоплазму и прижимает ее к клеточной оболочке. под влиянием внутреннего давления клеточная стенка растягивается, а клетка переходит в напряженное состояние (тургор).
Плазмолиз происходит в результате того, что под воздействием более концентрированного внешнего раствора вода выходит из клетки. При помещении клетки в чистую воду или слабоконцентрированный раствор вода поступает в клетку. объем вакуоли возрастает, клеточный сок давит на цитоплазму и прижимает ее к клеточной оболочке. под влиянием внутреннего давления клеточная стенка растягивается, а клетка переходит в напряженное состояние (тургор).
Деплазмолиз – процесс, обратный плазмолизу, проявляющийся в восстановлении нормального состояния клетки при перенесении ее в чистую воду.
Вывод: клетка является эластичной и достаточно прочной, так она способна в гипертоническом растворе отставать от оболочки клетки, а в гипотоническом вновь восстанавливать первоначальное положение. Плазмолиз и деплазмолиз можно наблюдать только в живых клетках.
Лабораторная работа №9.
Задание №1
ЛАБОРАТОРНАЯ РАБОТА № 9 «Приготовление, рассматривание и описание микропрепаратов клеток растений»
В растительных клетках пигменты, окрашивающие в яркие цвета цветки и плоды покрытосеменных растений, содержатся не только в пластидах, но и в растворе, заполняющем крупные клеточные вакуоли.
Цель: развить умение работать с лабораторным оборудованием, освоить технику приготовления временных микропрепаратов, изучить строение клеток, сделать описание.
Оборудование: микроскоп, предметные и покровные стёкла, пипетки, пинцеты, скальпели, биологический материал (кусочки яблока, томата, мякоть арбуза).
Реактивы: вода.
Ход работы:
1. Приготовьте препараты клеток мякоти яблока, томата, арбуза. Для этого в каплю воды на предметном стекле перенесите частицу мякоти плода, разделите её на клетки и накройте покровным стеклом.
2. Рассмотрите препарат под микроскопом. Найдите в клетках вакуоли, отметьте их окраску.
3. Зарисуйте строение клеток.
4. Сделайте вывод.
Ответ:
Клетки мякоти томата на которых мы можем видеть небольшие темно−красные очертания вакуолей: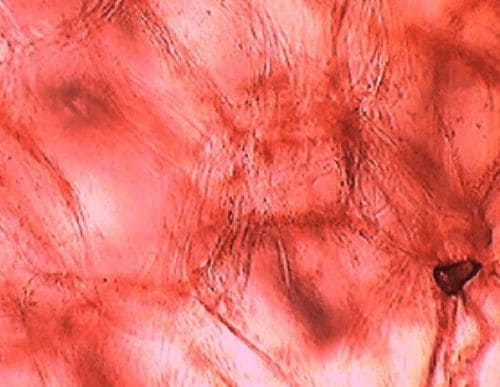 На препарате мы видим что у вакуолей есть окраска (они заметны на фоне границ окраски других частей клетки).
На препарате мы видим что у вакуолей есть окраска (они заметны на фоне границ окраски других частей клетки).
Вывод: сок в вакуолях также влияет на окраску плода растения, помимо пластид, содержащихся в растительной клетке. Пигменты клеточного сока (антоцианы, флавоноиды) окрашивают органы растений в красный, розовый, синий, голубой, желтый и бурый цвета.

