§17. Дистилляция, или перегонка
Демонстрационный опыт (стр.89)
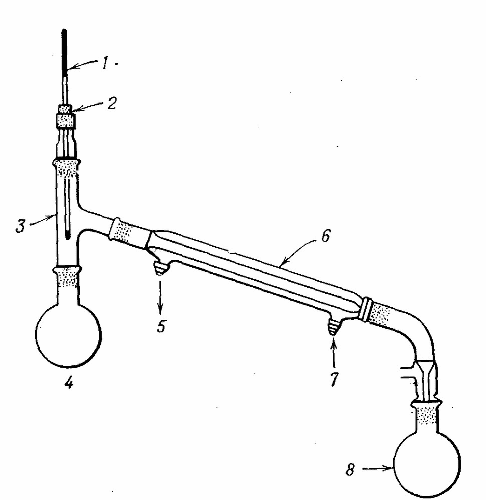
На учительском столе собрана лабораторная установка для перегонки жидкостей (рис.88).
В перегонную колбу учитель наливает воду, подкрашенную в оранжевый цвет растворимой неорганической солью (дихроматом калия).
Так вы воочию убедитесь, что в очищенной воде этого вещества не будет. Для равномерного кипения в колбу бросают 3 − 4 кусочка пористого фарфора или пемзы (кипелки).В холодильник подаётся вода, а содержимое перегонной колбы нагревается до кипения с помощью нагревательного прибора (спиртовки, газовой горелки, электронагревателя). Пары воды, попадая в холодильник, конденсируются, и дистиллированная вода стекает в приёмник.
Какую температуру показывает термометр? Как вы думаете, через какой отвод в холодильник подаётся холодная вода, а через какой она сливается?
Рис. 88 Лабораторная установка для дистилляции жидкостей
Ответ:
После дистилляции вода достигает 70 − 85 градусов. В холодильник подаётся вода через отвод под номером 7, а сливается через отвод под номером 5:
Вопросы
1. Что такое дистилляция, или перегонка? На чём она основана?
Ответ:
Дистилляция − это процесс очистки жидкости от примесей. Дистилляция основана на разных температурах кипения чистой жидкости и жидкости, содержащей примеси.
Сущность дистилляции состоит в том, что жидкость, содержащую примеси, нагревают до кипения. Образующиеся пары чистой жидкости отводят и охлаждают. Получается жидкость, очищенная от примесей.
2. Какая вода называется дистиллированной? Как её получают? Где она применяется?
Ответ:
Дистиллированная вода − это вода, очищенная от примесей.
Ее получают с помощью процесса, называемого дистилляцией или перегонкой. Для этого неочищенную воду нагревают до кипения, образующиеся пары чистой воды отводят и охлаждают. Получается вода, которая не содержит примесей.
Дистиллированная вода применяется для изготовления лекарств, для приготовления растворов в химических лабораториях, в аккумуляторах автомобилей.
3. Какие нефтепродукты получают при перегонке нефти? Где они применяются?
Ответ:
При перегонке нефти получают нефтяной газ, петролейный эфир, бензин, лигроин, керосин, газойль, соляр, мазут.
Продукты фракционной перегонки нефти используют в качестве топлива, а также сырья для нефтехимической промышленности.
4. Как разделить воздух на отдельные газы?
Ответ:
Для разделения воздуха на отдельные газы его сжижают при сильном охлаждении и сжатии, а затем подвергают фракционной перегонке. За счет разных температур кипения последовательно отгоняют азот, аргон и кислород.
5. Чем выпаривание (кристаллизация) отличается от перегонки (дистилляции)? На чем основаны оба способа разделения жидких смесей?
Ответ:
Кристаллизация (выпаривание) предназначена для выделения растворенного вещества из раствора.
Дистилляция (перегонка) предназначена для очистки жидкости от примесей.
Оба способа основаны на разнице температур кипения компонентов смеси (раствора).
6. Чем отличаются процессы выпаривания и кристаллизации? На чём основаны оба способа выделения твёрдого вещества из раствора?
Ответ:
В случае выпаривания мы удаляем жидкость (растворитель) из смеси (раствора) при помощи нагревания.
В случае кристаллизации мы удаляем растворенное вещество из раствора при помощи охлаждения.
Оба способа основаны на температурном воздействии на смесь (раствор).
7. Приведите примеры из повседневной жизни, в которых применяются выпаривание и дистилляция.
Ответ:
Кипячение воды в чайнике – пример выпаривания (в чайнике остается известковый налет). Образование соли на берегах соляных озер так же пример выпаривания. Фракционная перегонка нефти – пример дистилляции. Еще один пример дистилляции – получение дистиллированной воды.
8. Какую массу соли можно получить при выпаривании 250 г 5%−го её раствора? Какой объём воды можно получить из этого раствора при помощи дистилляции?
Ответ:
Дано:
m (раствора) = 250 г
w (соли) = 5% = 0,05
Найти:
m (соли) = ?
V ($H_{2}O$) = ?
Решение:
m (соли) = m (раствора) * w (соли) = 250 * 0,05 = 12,5 г
m ($H_{2}O$) = 250 − 12,5 = 237,5 г
Плотность воды равна 1 (это постоянная величина)
V ($H_{2}O$) = m ($H_{2}O$) * p ($H_{2}O$) = 237,5 * 1 = 237,5 л
Ответ: m (соли) = 12,5 г; V ($H_{2}O$) = 237,5 л
Практическая работа №41
Приготовьте горячий насыщенный раствор соли. Для этого наполовину заполните банку горячей водой (кипяток брать не нужно, чтобы не обжечься). Порциями добавляйте соль и перемешивайте. Когда соль перестанет растворяться, оставьте раствор на одну−две минуты, чтобы нерастворившиеся кристаллы успели осесть. Отфильтруйте раствор через воронку с ватой в чистый термос. Закройте термос крышкой и оставьте раствор медленно остывать два−три часа.
Раствор немного остыл. Теперь внесите в него затравку — кристаллик соли, приклеенный на кончике нитки. После того как ввели затравку, прикройте сосуд крышкой и оставьте на продолжительное время. Чтобы вырос крупный кристалл, потребуется несколько дней.
Обычно на нитке вырастает несколько кристаллов. Надо периодически удалять лишние, что бы рос один большой кристалл.
Важно записывать условия проведения эксперимента и его результат, в нашем случае это характеристики полученного кристалла. Если получилось не сколько кристаллов, то приводят описание самого большого.
Изучите свой кристалл и ответьте на вопросы.
Сколько дней вы выращивали кристалл?
Какова его форма?
Какого цвета кристалл?
Прозрачный он или нет?
Каковы размеры кристалла: высота, ширина, толщина?
Какова масса кристалла?
Зарисуйте или сфотографируйте полученный кристалл (рис. 93, 94).
Рис. 93 Кристалл поваренной соли
Рис. 94 Кристаллы медного купороса
Ответ:
Ход работы:
Я приготовил(а) горячий насыщенный раствор соли. Для этого наполовину заполнил(а) банку горячей водой. Порциями добавил(а) соль и перемешивал(а). Когда соль перестала растворяться, оставил(а) раствор на одну−две минуты, чтобы нерастворившиеся кристаллы успели осесть. Отфильтровал(а) раствор через воронку с ватой в чистый термос. Закрыл(а) термос крышкой и оставил(а) раствор медленно остывать два−три часа. После того как раствор немного остыл, я добавил(а) в него затравку — кристаллик соли, приклеенный на кончике нитки. После того как ввел(а) затравку, прикрыл(а) сосуд крышкой и оставил(а) на продолжительное время. Периодически убирал(а) лишние кристаллы, чтобы рос один большой кристалл.
Наблюдения:
1) Первые маленькие кристаллы появляются в первый−второй день. Свой кристалл я растил(а) две недели.
2) Кристалл имеет неправильную форму, в виде группировки большого числа маленьких кристаллов с острыми краями.
3) Кристалл получился такого же цвета, как и пищевая соль − прозрачный.
4) Размер необходимо измерить линейкой. Мой получился размером: длина = 5 см; ширина = 3,5 см.
5) Массу необходимо измерить на весах. Мой получился весом 12 г.
Практическая работа №51
В химический стакан поместите выданную учителем загрязнённую соль и налейте 50—70 мл дистиллированной воды. Перемешивая содержимое стеклянной палочкой, добейтесь полного растворения соли в воде.
Раствор соли от песка можно отделить фильтрованием. Для этого соберите установку, как показано на рисунке 95. С помощью стеклянной палочки осторожно перелейте содержимое стакана на фильтр. Прозрачный фильтрат будет стекать в чистый стакан, нерастворимые компоненты исходной смеси остаются на фильтре.
Жидкость в стакане — это водный раствор поваренной соли. Выделить из него чистую соль можно выпариванием. Для этого 5—7 мл фильтрата налейте в фарфоровую чашку, поместите её в кольцо штатива и осторожно нагревайте на пламени спиртовки, постоянно перемешивая содержимое стеклянной палочкой до полного выпаривания жидкости. Сравните кристаллы соли, полученные после выпаривания раствора, с исходной загрязнённой солью. Перечислите, какие приёмы и операции вы использовали для очистки загрязнённой соли.
Рис. 95 Установка для фильтрования
Ответ:
Кристаллы соли после очистки имели равномерный белый цвет и не содержали посторонних неоднородных примесей.
Для очистки загрязненной поваренной соли использовались методы фильтрования и выпаривания.