§13. Кислород
Вопрос в начале параграфа
✓ Без кислорода невозможно протекание двух важнейших процессов. Значение одного из них для человеческой цивилизации подтверждает легенда о Прометее, другой − основа жизни на Земле. О каких же процессах идёт речь?
Ответ:
Два важнейших процесса с участием кислорода − горение и дыхание.
Проверьте свои знания
1. Назовите аллотропные модификации кислорода и сравните их свойства.
Ответ:
Для кислорода характерна аллотропия, т.е. образование двух простых веществ, различающихся числом атомов в молекуле: кислорода $O_{2}$ и озона $O_{3}$. Биологическая роль озона известка. Поэтому отметим, что озон − эффективное средство для обеззараживания питьевой воды. Кислород − газ без цвета, запаха и вкуса, немного растворимый в воде, несколько тяжелее воздуха.
2. Какое значение в природе имеет озон и где он применяется?
Ответ:
Озон образует тонкий слой в атмосфере Земли, защищает все живое на планете от губительного воздействия космического излучения.
В быту озон применяется для обеззараживании питьевой воды.
3. Запишите уравнения реакций получения кислорода в лаборатории. Каким образом можно: а) собрать кислород в сосуд; б) доказать наличие кислорода в сосуде?
Ответ:
Запишем уравнения реакций получения кислорода в лаборатории:
2$KMnO_{4}$ = $K_{2}$ $MnO_{4}$ + $MnO_{2}$ + $O_{2}$↑
2$H_{2}$ $O_{2}$ = 2$H_{2}$O + $O_{2}$↑
2$KClO_{3}$ = 2KCl + 3$O_{2}$↑
а) Кислород собирается в сосуд методом вытеснения воздуха, так как он тяжелее воздуха (32>29).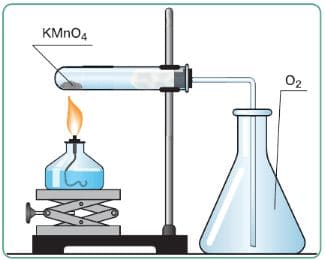
Рис. 43. Получение кислорода и собирание его методом вытеснения воздуха
б) Доказать наличие кислорода в сосуде можно с помощью тлеющей лучинки, так как кислород поддерживает горение.
Рис. 44. Получение кислорода разложением пероксида водорода и обнаружение с помощью тлеющей лучинки
4. Как кислород получают в промышленности?
Ответ:
В промышленности кислород получают фракционной перегонкой (или ректификацией) жидкого воздуха в специальных аппаратах, называемых ректификационными колоннами.
5. Назовите области применения кислорода.
Ответ:
Два важнейших процесса с участием кислорода − горение и дыхание.
Способность кислорода поддерживать горение лежит в основе применения всех видов топлива. Не менее важны процессы медленного (беспламенного) окисления различных веществ. Так, при окислении пищи в нашем организме выделяется энергия, за счёт которой организм живёт и поддерживает нужную температуру. При дыхании кислород поступает в лёгкие человека, соединяется с гемоглобином и переносится потоком крови в каждую клетку. Здесь происходит обмен молекулы кислорода в гемоглобине на молекулу углекислого газа, который, будучи токсичным продуктом жизнедеятельности, удаляется из клетки.
Растениям тоже необходим кислород. В темноте идёт процесс поглощения кислорода растениями, на свету протекает противоположный ему процесс − фотосинтез.
Именно за счёт фотосинтеза в атмосфере нашей планеты появился и поддерживается на постоянном уровне живительный кислород. Причём 80 % кислорода поставляют в атмосферу морские водоросли. Кислород совершает бесконечный круговорот на нашей планете.
Также кислород применяют в медицине: в оксибарокамерах, при заправке кислородных масок, для изготовления кислородных коктейлей, при выращивании микроорганизмов.
Жидкий кислород применяют в реактивных двигателях, в автогенной сварке, резке металлов.
В чистом виде кислород используют в металлургии при получении чугуна, стали, цветных металлов.
Примените свои знания
6. Запишите уравнения реакций, схемы которых:
а) $SO_{2}$ + … → $SO_{3}$
б) $Li_{2}$S + … → $SO_{2}$ + $Li_{2}$O
в) $NaNO_{3}$ → $NaNO_{2}$ + …
г) $C_{2}$ $H_{2}$ + $O_{2}$ → … + …
Ответ:
а) 2$SO_{2}$ + $O_{2}$ = 2$SO_{3}$
б) 2$Li_{2}$S + 3$O_{2}$ = 2$SO_{2}$ + 2$Li_{2}$O
в) 2$NaNO_{3}$ = 2$NaNO_{2}$ + $O_{2}$
г) 2$C_{2}$ $H_{2}$ + 5$O_{2}$ = 4$CO_{2}$ + 2$H_{2}$O
7. Исторически одним из самых первых способов получения кислорода была реакция разложения оксида ртути(II). Запишите уравнение этой реакции. К какому типу реакций по тепловому эффекту она относится?
Ответ:
2HgO = 2Hg + $O_{2}$↑ − это эндотермическая реакция, так как происходит разложение
Используйте дополнительную информацию
8. Подготовьте сообщение по одной из тем: а) «Происхождение и изменение состава земной атмосферы»; б) «Из истории открытия кислорода»; в) «Значение кислорода в жизни».
Ответ:
Значение кислорода
Кислород представляет собой бесцветный газ без вкуса и запаха.
Значение этого газа для человека и живых организмов велико. Всем живым организмам кислород необходим для дыхания, так как для поддержания жизни нужно постоянное поступление кислорода, а его запасов в организме нет. Также кислород участвует в окислительных процессах, процессах горения.
Способность кислорода поддерживать горение лежит в основе применения всех видов топлива. Не менее важны процессы медленного (беспламенного) окисления различных веществ. Так, при окислении пищи в нашем организме выделяется энергия, за счёт которой организм живёт и поддерживает нужную температуру. При дыхании кислород поступает в лёгкие человека, соединяется с гемоглобином и переносится потоком крови в каждую клетку. Здесь происходит обмен молекулы кислорода в гемоглобине на молекулу углекислого газа, который, будучи токсичным продуктом жизнедеятельности, удаляется из клетки.
Растениям тоже необходим кислород. В темноте идёт процесс поглощения кислорода растениями, на свету протекает противоположный ему процесс − фотосинтез.
Именно за счёт фотосинтеза в атмосфере нашей планеты появился и поддерживается на постоянном уровне живительный кислород. Причём 80 % кислорода поставляют в атмосферу морские водоросли. Кислород совершает бесконечный круговорот на нашей планете.
Также кислород применяют в медицине: в оксибарокамерах, при заправке кислородных масок, для изготовления кислородных коктейлей, при выращивании микроорганизмов.
Жидкий кислород применяют в реактивных двигателях, в автогенной сварке, резке металлов.
В чистом виде кислород используют в металлургии при получении чугуна, стали, цветных металлов.
9. Присутствие кислорода в атмосфере Земли делает её пригодной для жизни. Однако известно и негативное влияние кислорода. Приведите примеры отрицательных явлений, связанных с наличием кислорода в воздухе. Предложите методы борьбы с этими явлениями.
Ответ:
Кислород жизненно необходим для человека, однако встречаются и негативные его влияния. К ним можно отнести брожение молока и образование ржавчины. Причина всему этому − участие кислорода в окислительных реакциях.
Для более длительного хранения продуктов питания их замораживают, консервируют.
Для предотвращения образования ржавчин используют лаки и специальные растворы.
Практическая работа 4
Вариант 1
1. Работу начните со сборки прибора для получения газов и проверки его герметичности. Для этого используйте подготовленную учителем пробирку−реактор с перманганатом калия. Положите в неё небольшой ватный тампон как можно ближе к отверстию, чтобы пылевидное твёрдое вещество через газоотводную трубку не попало в сосуд−приёмник для кислорода. Собранный прибор поместите в ладонь, а конец газоотводной трубки опустите в воду. Согрейте пробирку ладонью. Появление пузырьков воздуха указывает на герметичность прибора.
2. Закрепите пробирку−реактор с веществом в лабораторном штативе, регулируя её положение так, чтобы конец газоотводной трубки доходил до дна сосуда−приёмника для кислорода.
3. Зажгите спиртовку, прогрейте пробирку−реактор, равномерно перемещая спиртовку по всей её длине. Затем установите спиртовку под ту часть пробирки, где находится перманганат калия. Нагрейте пробирку−реактор, собирая выделяющийся кислород вытеснением воздуха из сосуда. Почему кислород собирают именно так?
4. Приготовьте тлеющую лучинку. Проверьте наличие кислорода в сосуде. Для этого тлеющую лучинку опустите в сосуд. Что наблюдаете?
5. По окончании опыта погасите спиртовку и оформите отчёт по следующей форме:
Что сделал(а) Что наблюдал(а) (сделайте рисунок, если необходимо) Выводы и уравнения реакций
Используйте эту форму и при выполнении других работ.
Ответ:
Таблица
| Что сделал(а) | Что наблюдал(а) (сделайте рисунок, если необходимо) | Выводы и уравнения реакций |
|---|---|---|
| Собрала прибор для получения газов и проверки его герметичности. | 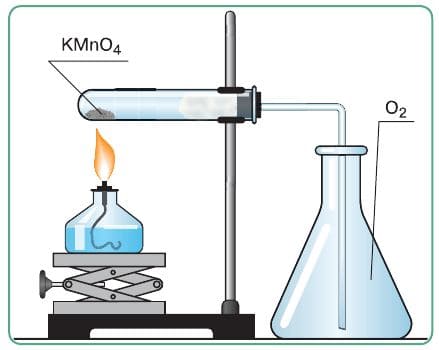 |
Прибор герметичен. |
| Закрепила пробирку−реактор с веществом в лабораторном штативе. | ||
| Зажгла спиртовку, прогрела пробирку−реактор, равномерно перемещая спиртовку по всей ее длине. Затем установила спиртовку под ту часть пробирки, где находится перманганат калия. Нагрела пробирку−реактор, собирая выделяющийся кислород вытеснением воздуха из сосуда. | Наблюдала выделение пузырьков газа − кислорода. Он собирается таким методом, так как тяжелее воздуха (32 > 29). | 2$KMnO_{4}$ = $K_{2}$ $MnO_{4}$ + $MnO_{2}$ + $O_{2}$ |
| Приготовила тлеющую лучинку. Проверила наличие кислорода в сосуде. | Лучинка ярко вспыхнула, так как кислород поддерживает горение. | В сосуде находится кислород. |
Вариант 2
1. Работу начните со сборки прибора для получения газов и проверки его герметичности. Для этого собранный прибор поместите в ладонь, а конец газоотводной трубки опустите в воду. Согрейте пробирку ладонью. Появление пузырьков воздуха указывает на герметичность прибора.
2. Выньте пробку с газоотводной трубкой, налейте в пробирку 3−4 мл аптечного препарата перекиси водорода, добавьте небольшое количество оксида марганца(IV) (на кончике шпателя). Быстро закройте пробирку−реактор пробкой и конец газоотводной трубки опустите в сосуд−приёмник. Что наблюдаете?
3. Соберите выделяющийся кислород вытеснением воздуха из сосуда. Почему кислород собирают именно так?
4. Приготовьте тлеющую лучинку. Проверьте наличие кислорода в сосуде. Для этого тлеющую лучинку опустите в сосуд. Что наблюдаете?
Какую роль в эксперименте играет оксид марганца(IV)? По завершении работы оформите отчёт.
Ответ:
Таблица
| Что сделал(а) | Что наблюдал(а) (сделайте рисунок, если необходимо) | Выводы и уравнения реакций |
|---|---|---|
| Собрала прибор для получения газов и проверки его герметичности. | Наблюдала выделение пузырьков газа.  |
Прибор герметичен. |
| Вынула пробку с газоотводной трубкой , налила в пробирку 3−4 мл аптечного препарата перекиси водорода, добавила небольшое количество оксида марганца(IV) (на кончике шпателя). Быстро закрыла пробирку−реактор пробкой и конец газоотводной трубки опустила в сосуд−приёмник. | Кислород собрался в сосуде−приемнике. | Кислород собирают таким методом, так как он тяжелее воздуха (32 > 29). 2$KMnO_{4}$ = $K_{2}$ $MnO_{4}$ + $MnO_{2}$ + $O_{2}$ Оксид марганца(IV) является катализатором, то есть ускоряет химическую реакцию. |
| Приготовила тлеющую лучинку. Проверила наличие кислорода в сосуде. | Лучинка ярко вспыхнула, так как кислород поддерживает горение. | В сосуде находится кислород. |

