§15. Водород
Вопрос в начале параграфа
✓ Водород − самый лёгкий газ. Предложите способ его собирания в сосуд и распознавания на основе анализа названия этого вещества.
Ответ:
Чтобы собрать водород в сосуд, нужно перевернуть его вверх дном, потому что водород – легче воздуха и стремится вверх.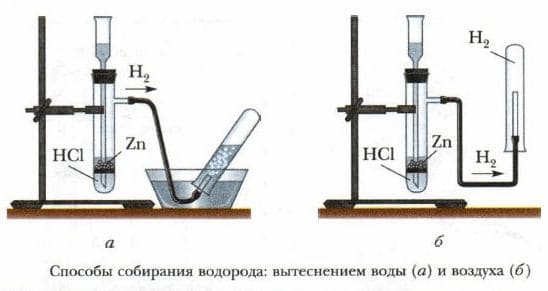
Водород распознают по характерному хлопку при поджигании (рис. 55).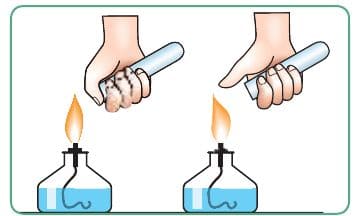
Рис. 55. Проверка водорода на чистоту
Если водород достаточно чистый, то хлопок глухой. Если водород загрязнён примесью воздуха, раздаётся хлопок−взрыв с характерным «лающим» звуком.
Лабораторный опыт 13
1. Соберите прибор для получения газов, проверьте его герметичность. В пробирку поместите 1−2 гранулы цинка и добавьте 2 мл соляной кислоты. Закройте пробирку пробкой с газоотводной трубкой. Что наблюдаете? На конец газоотводной трубки, обращённой вверх, наденьте пустую пробирку. Через 1−2 минуты поднимите её и, не переворачивая, поднесите к пламени спиртовки. Что наблюдаете? Что можно сказать о чистоте собранного водорода? Запишите уравнения реакций.
Ответ:
Zn − цинк
HCl − соляная кислота
Запишем уравнение реакции:
Zn + 2HCl = $ZnCl_{2}$ + $H_{2}$↑
Наблюдается выделение газа (водорода).
При поднесении спиртовки к пробирке с водородом раздается хлопок, что говорит о чистоте водорода.
Проверьте свои знания
1. Какими физическими свойствами характеризуется водород? Как его собирают? Почему водородом опасно заполнять воздушные шары и дирижабли?
Ответ:
Водород − простое вещество. Он не имеет цвета, запаха и вкуса, почти нерастворим в воде. При нормальных условиях это самый лёгкий из газов, и потому в первой половине XX в. им заполняли летательные аппараты − дирижабли. Однако наряду с таким преимуществом, как лёгкость, водород имеет существенный недостаток: он крайне огнеопасен. Сейчас дирижабли, метеозонды, воздушные шары заполняют более дорогим, но безопасным гелием.
Водород собирают двумя методами: путем вытеснения воды и путем вытеснения воздуха.
2. Сравните получение, собирание и распознавание кислорода и водорода.
Ответ:
Получение кислорода :
2$KMnO_{4}$ = $K_{2}$ $MnO_{4}$ + $MnO_{2}$ + $O_{2}$↑
2$H_{2}$ $O_{2}$ = 2$H_{2}$O + $O_{2}$↑
2$KClO_{3}$ = 2KCl + 3$O_{2}$↑
Получение водорода:
Zn + 2HCl = $ZnCl_{2}$ + $H_{2}$↑
Собирание кислорода: так как кислород тяжелее воздуха (32 > 29), то собирается методом вытеснения воздуха.
Собирание водорода: так как водород легче воздуха (2 < 29), собирается в сосуд методом вытеснения из воздуха или воды.
Распознавание кислорода: с помощью тлеющей лучинки (вспыхивает ярким пламенем).
Распознавание водорода: с помощью тлеющей лучинки (сгорает с характерным хлопком).
3. Охарактеризуйте применение водорода на основе его свойств.
Ответ:
Водород — важнейшее химическое вещество, имеющее большое практическое значение. Он эффективное ракетное топливо, а в перспективе и автомобильное. Водород применяют для получения соляной кислоты, аммиака, газовой резки и сварки металлов, для получения чистых металлов.
Примените свои знания
4. Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
$H_{2}$ → $H_{2}$S → $SO_{2}$ → $SO_{3}$
Ответ:
Уравнения реакций:
1) $H_{2}$ + S = $H_{2}$S
2) 2$H_{2}$S + 3$O_{2}$ = 2$SO_{2}$ + 2$H_{2}$O
3) 2$SO_{2}$ + $O_{2}$ = 2$SO_{3}$
5. Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Cu → CuS → CuO → Cu
Ответ:
Уравнения реакций:
1) Cu + S = CuS
2) 2CuS + 3$O_{2}$ = 2CuO + 2$SO_{2}$
3) CuO + $H_{2}$ = Cu + $H_{2}$O
Используйте дополнительную информацию
6. Посмотрите видеозапись взрыва гремучего газа: http://school−collection.edu.ru → Коллекции → Предметные коллекции. Химия → Неорганическая химия. Видеоопыты → Водород. Кислоты → Водород и его свойства → 7. Приготовление и взрыв гремучей смеси.
Какие меры предосторожности принимаются при проведении опыта? Какие области применения этой реакции в мирных целях вы могли бы предложить?
Ответ:
При проведении опыта следует соблюдать правила работы с горючими газами и правила работы с кислотами:
1) Работать только в халате, защитных очках.
2) В лаборатории должен быть огнетушитель и песок.
3) На всех склянках должны быть этикетки.
4) Вещества нельзя пробовать на вкус.
5) Нельзя подносить вещества к лицу, чтобы понюхать надо легким движением руки направить к себе его пары.
Области применения этой реакции в мирных целях: источник энергии; топливо для транспорта.
7. Подготовьте сообщение по одной из тем: а) «Водород на Земле и в космосе»; б) «Использование водорода в воздухоплавании: победы и трагедии».
Ответ:
Водород на Земле и в космосе
По легкости он первый среди газов. При нормальных условиях безвкусен, бесцветен, и абсолютно без запаха. При попадании в термосферу улетает в космос из−за малого веса.
Водород является самым распространенным элементом в космосе. У планет, таких как Сатурн, Нептун, Юпитер, водород образует атмосферу. Половину массы Солнца составляет водород в виде плазмы. При этом постоянно происходит термоядерная реакция: превращение атомов водорода в атомы гелия, в результате которой образуется энергия.
На планете Земля водород достаточно распространен. Водород встречается в воде. Там на его долю приходится практически 11%. Во−вторых, Водород встречается также в составе угля, нефти, природного газа в виде органических соединений.
Практическая работа 5
5. ПОЛУЧЕНИЕ, СОБИРАНИЕ И РАСПОЗНАВАНИЕ ВОДОРОДА
1. Соберите прибор для получения газов: пробирку плотно закройте пробкой с газоотводной стеклянной трубкой. Проверьте герметичность прибора: появление пузырьков воздуха в стакане с водой указывает на то, что прибор герметичен.
2. В пробирку поместите 2−3 гранулы цинка.
3. В пробирку с цинком добавьте соляную кислоту так, чтобы она покрыла гранулы цинка. Закройте пробирку пробкой со стеклянной газоотводной трубкой.
4. Прибор закрепите в лапке лабораторного штатива. На стеклянную трубку наденьте пробирку−приёмник. Соберите в неё выделяющийся водород.
5. Проверьте водород на чистоту. Для этого используйте зажжённую спиртовку.
ВНИМАНИЕ! Горящая спиртовка не должна находиться рядом с прибором для получения водорода.
Аккуратно снимите с газоотводной трубки пробирку−приёмник и, слегка наклоняя её, внесите в пламя спиртовки. Что наблюдаете?
Если водород смешан с воздухом, хлопок будет со свистом («лающий»), если водород чистый, хлопок будет глухой.
6. Убедившись, что выделяется чистый водород, подожгите его у конца стеклянной трубки. Водород горит голубым пламенем, если этого не видно, пинцетом поднесите полоску белой бумаги на задний план. По окончании опыта погасите спиртовку. Оформите отчёт.
Ответ:
Практическая работа 5: ПОЛУЧЕНИЕ, СОБИРАНИЕ И РАСПОЗНАВАНИЕ ВОДОРОДА
1. Собрала прибор для получения газов и проверила его на герметичность.
2. В пробирку поместила 2−3 гранулы цинка.
3. В пробирку с цинком добавила соляную кислоту так, чтобы она покрыла гранулы цинка. Закрыла пробирку пробкой со стеклянной газоотводной трубкой.
4. Прибор закрепила в лапке лабораторного штатива. На стеклянную трубку надела пробирку−приёмник. Собрала в неё выделяющийся водород.
5. Проверила водород на чистоту. Для этого использовала зажжённую спиртовку.
6. Убедившись, что выделяется чистый водород, подожгла его у конца стеклянной трубки. Водород горит голубым пламенем. По окончании опыта погасила спиртовку.
Запишем уравнение реакции:
Zn + 2HCl = $ZnCl_{2}$ + $H_{2}$
Аккуратно сняла с газоотводной трубки пробирку−приёмник и, слегка наклоняя её, внесла в пламя спиртовки. Так как водород водород чистый, хлопок глухой.

