§8. Валентность
Вопрос в начале параграфа
✓ Сложные вещества образованы не одним, а двумя и более химическими элементами. Например, молекула воды имеет формулу $H_{2}$ O . Почему именно такая формула у этого вещества, а не, допустим, $H_{3}$ O или $HO_{2}$?
Ответ:
Формула воды $H_{2}$ O , потому что молекула воды содержит 2 атома водорода и 1 атом кислорода.
Проверьте свои знания
1. Запишите формулы оксидов железа и меди, т. е. бинарных соединений металлов с кислородом. Данные о валентности элементов приведены на схеме 3.
Ответ:
FeO − оксид железа (II)
$Fe_{2}$ $O_{3}$ − оксид железа (III)
CuO − оксид меди (II)
$Cu_{2}$O − оксид меди (I)
2. Сера образует два оксида, формулы которых $SO_{2}$ и $SO_{3}$. Назовите эти оксиды. В каком из них содержание серы выше? Ответ подтвердите расчётами.
Ответ:
Дано:
$SO_{2}$ − оксид серы (IV)
$SO_{3}$ − оксид серы (VI)
Найти: В каком из них содержание серы выше?
Решение:
Mr ($SO_{2}$) = 32 + 2 * 16 = 64
ω (S) = 32 : 64 * 100% = 50%
Mr ($SO_{3}$) = 32 + 3 * 16 = 80
ω (S) = 32 : 80 * 100% = 40%
Ответ: содержание серы выше в оксиде серы (IV).
3. Рассчитайте массовую долю фосфора в оксиде фосфора (III) и оксиде фосфора (V).
Ответ:
Дано:
$P_{2}$ $O_{3}$ – оксид фосфора (III)
$P_ {2}$ $O_{5}$ – оксид фосфора (V)
Найти:
ω(P) − ?
Решение:
Mr ($P_{2}$ $O_{3}$) = 2 * 31 + 3 * 16 = 110
$ω_{1}$ (P) = 62 : 110 * 100% = 56,4% − массовая доля в оксиде фосфора (III).
Mr ($P_{2}$ $O_{5}$) = 2 * 31 + 5 * 16 = 142
$ω_{2}$ (P) = 62 : 142 * 100% = 43,7% − массовая доля в оксиде фосфора (V).
Ответ: ω (P) = 56,4% − массовая доля в оксиде фосфора (III); ω (P) = 43,7% − массовая доля в оксиде фосфора (V).
4. Назовите вещества, формулы которых: FeS, $Al_{2}$ $S_{3}$, $SCl_{4}$, CO, $CO_{2}$, $Na_{3}$ P, $Ca_{3}$ $P_{2}$.
Ответ:
FeS − сульфид железа (II)
$Al_{2}$ $S_{3}$ − сульфид алюминия
$SCl_{4}$ − хлорид серы (IV)
CO − оксид углерода (II)
$CO_{2}$ − оксид углерода (IV)
$Na_{3}$ P − фосфид натрия
$Ca_{3}$ $P_{2}$ − фосфид кальция
5. Запишите формулы хлоридов − бинарных соединений элементов с одновалентным хлором: углерода (IV), калия, азота (III), меди (I), меди (II), железа (II), железа (III), свинца (II).
Ответ:
$CCl_{4}$ − хлорид углерода (IV)
KCl − хлорид калия
$NCl_{3}$ − хлорид азота (III)
CuCl − хлорид меди (I)
$CuCl_{2}$ − хлорид меди (II)
$FeCl_{2}$ − хлорид железа (II)
$FeCl_{3}$ − хлорид железа (III)
$PbCl_{2}$ − хлорид свинца (II)
Примените свои знания
6. Запишите формулы фосфатов − соединений металлов (натрия, кальция, алюминия) с группой атомов остатка фосфорной кислоты $H_{3}$ $PO_{4}$.
Ответ:
$Na_{3}$ $PO_{4}$ − фосфат натрия
$Ca_{3}$ $(PO_{4}$ $)_ {2}$ − фосфат кальция
$Al_{3}$ $(PO_{4}$ $)_{2}$ − фосфат алюминия
7. Запишите формулы гидроксидов металлов − соединений металлов (натрия, кальция, алюминия) с одновалентной группой атомов − OH (гидроксильной группой).
Ответ:
NaOH − гидроксид натрия
$Ca(OH)_ {2}$ − гидроксид кальция
$Al(OH)_{3}$ − гидроксид алюминия
Используйте дополнительную информацию
8. Соберите из пластилина и спичек модели молекул: воды, аммиака, метана, углекислого газа.
Ответ:
Молекула воды состоит из двух атомов водорода и одного атома кислорода.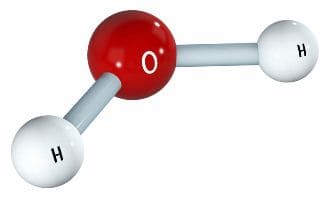
Молекула аммиака состоит из трех атомов водорода и одного атома азота.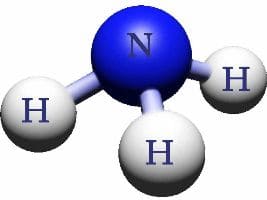
Молекула метана состоит из четырех атомов водорода и одного атома углерода.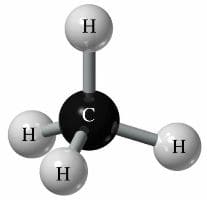
Молекула углекислого газа состоит из двух атомов кислорода и одного атома углерода.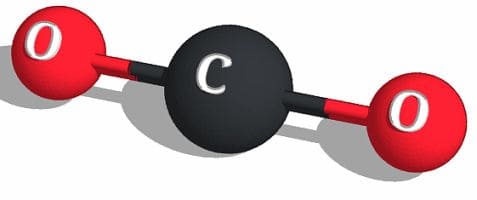
9. Подготовьте сообщение о развитии представлений о валентности.
Ответ:
Понятие валентности формировалось вместе с понятием химической связи, и его содержание неоднократно расширялось и изменялось.
В начале 19 века Дальтоном был сформулирован закон кратных отношений, из которого следовало, что каждый атом одного элемента может соединяться с определенным числом атомов другого элемента. Позже стало ясно, что число таких связей не превышает определённой величины и зависит от природы атома.
В 1916 Льюис сказал, что химическая связь осуществляется парой электронов, принадлежащих одновременно обоим взаимодействующим атомам. В 1917 В. Коссель выдвинул гипотезу, согласно которой электронная пара связи переходит целиком к одному из атомов с образованием ионной пары катион — анион. Согласно обеим гипотезам, валентность атома в соединении стала определяться числом его неспаренных электронов, участвующих в связях, а максимальная валентность — полным числом электронов в валентной оболочке атома, то есть номером группы.

