ГЛАВА III. Основные классы неорганических соединений
§23. Оксиды, их классификация и химические свойства
Вопрос в начале параграфа
✓ С важнейшими свойствами представителей этого класса соединений вы уже знакомились, когда изучали химические свойства воды. Предложите классификацию оксидов, исходя из их химических свойств.
Ответ:
Исходя из химических свойств оксидов, их можно разделить на кислотные и осно́вные оксиды.
Выделяют еще амфотерные оксиды. Они сочетают в себе химические свойства и осно́вных оксидов, и кислотных.
Лабораторный опыт 17
1. Поместите в пробирку небольшое количество (на кончике шпателя) негашёной извести − оксида кальция. Добавьте 4−5 мл воды, взболтайте содержимое пробирки и с помощью пипетки внесите 3−4 капли фенолфталеина. Что наблюдаете?
Ответ:
Запишем уравнение реакции:
CaO + $H_{2}$O = $Ca(OH)_{2}$
При добавлении 3−4 капель фенолфталеина раствор приобретает малиновый цвет, так как имеет щелочную среду.
Вопрос (стр.102)
? А какие ещё свойства проявляют оксиды металлов?
Ответ:
Оксиды металлов взаимодействуют с водой, кислотами и оксидами неметаллов.
С водой образуют гидроксид:
CaO + $H_{2}$O = $Ca(OH)_ {2}$
С кислотами образуют соль и воду:
CaO + $H_{2}$ $SO_{4}$ = $CaSO_{2}$ + $H_{2}$O
С оксидами неметаллов образуют соль:
CaO + $SO_{2}$ = $CaSO_{3}$
Вопрос (стр.103)
? А какие свойства проявляют оксиды неметаллов?
Ответ:
Оксиды неметаллов взаимодействуют со щелочами, водой и оксидами металлов.
С щелочами образуют соль и воду:
$SO_{2}$ + 2NaOH = $Na_{2}$ $SO_{3}$ + $H_{2}$O
С водой образуют кислоту:
$SO_{2}$ + $H_{2}$O = $H_{2}$ $SO_{3}$
С оксидами металлов образуют соль:
$SO_{2}$ + CaO = $CaSO_{3}$
Лабораторный опыт 18
1. Повторите эксперимент по распознаванию углекислого газа. Налейте в пробирку 3−4 мл известковой воды и пропускайте через неё с помощью стеклянной трубочки или соломинки для напитков выдыхаемый воздух (рис. 63). Что наблюдаете?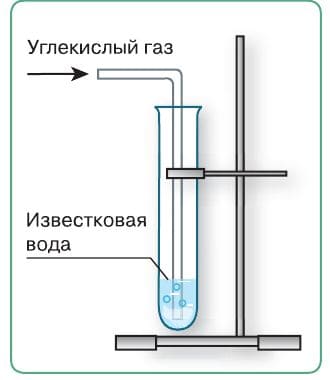
Рис. 63. Помутнение известковой воды − качественная реакция на углекислый газ
Ответ:
Запишем уравнение реакции:
$Ca(OH)_{2}$ + $CO_{2}$ = $CaCO_{3}$↓ + $H_{2}$ O
При пропускании через известковую воду выдыхаемого воздуха наблюдается помутнение раствора (из−за образования осадка − карбоната кальция).
Проверьте свои знания
1. Какие вещества называют оксидами? На какие группы они делятся? Найдите сходство и различия в свойствах этих групп оксидов.
Ответ:
Оксиды − это бинарные соединения элемента с кислородом.
Оксиды делятся на основные и кислотные оксиды.
Оксиды, которые взаимодействуют с кислотами, образуя соль и воду, и которым в качестве гидроксидов соответствуют основания, называют основными.
Оксиды, которые взаимодействуют с основаниями, образуя соль и воду, и которым в качестве гидроксидов соответствуют кислоты, называют кислотными.
Сходство кислотных и основных оксидов в том, что они реагируют с водой и друг с другом.
Различия: кислотные оксиды реакгируют со щелочами, а основные − нет; основные оксиды реагируют с кислотами, а кислотные − нет.
2. Какие гидроксиды − основания и кислородсодержащие кислоты − соответствуют солеобразующим кислотам?
Ответ:
Кислотным солеобразующим оксидам соответствуют кислородсодержащие кислоты. Например, $SO_{2}$ соответствует $H_{2}$ $SO_{3}$.
Основным солеобразующим оксидам соответствуют основания. Например, $Na_{2}$O соответствует NaOH.
3. Назовите основные способы получения оксидов и проиллюстрируйте их уравнениями реакций.
Ответ:
Способы получения оксидов:
1) Взаимодействие металлов и неметаллов с кислородом:
2Mg + $O_{2}$ = 2MgO
$N_{2}$ + $O_{2}$ = 2NO↑
2) Разложение гидроксидов (оснований и кислородсодержащих кислот) и солей:
$Fe(OH)_{2}$ = FeO + $H_{2}$O
$H_{2}$ $SiO_{3}$ = $SiO_{2}$ + $H_{2}$O
$CaCO_{3}$ = CaO + $CO_{2}$↑
3) Взаимодействие сложных веществ с кислородом:
2ZnS + 3$O_{2}$ = 2ZnO + 2$SO_{2}$↑
Примените свои знания
4. Запишите формулы оксидов, соответствующих следующим гидроксидам:
а) серной кислоте $H_{2}$ $SO_{4}$
б) марганцовой кислоте $HMnO_{4}$
в) гидроксиду железа(III)
г) гидроксиду свинца(IV)
д) хлорной кислоте $HClO_{4}$
Ответ:
Формулы оксидов, соответствующих следующим гидроксидам:
а) серной кислоте $H_{2}$ $SO_{4}$ соответствует оксид $SO_{3}$.
б) марганцовой кислоте $HMnO_{4}$ соответствует оксид $Mn_{2}$ $O_{7}$.
в) гидроксиду железа(III) соответствует оксид $Fe_{2}$ $O_{3}$.
г) гидроксиду свинца(IV) соответствует оксид $PbO_{2}$.
д) хлорной кислоте $HClO_{4}$ соответствует оксид $Cl_{2}$ $O_{7}$.
5. Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) Ca → CaO → $Ca(OH)_ {2}$ → $CaCl_{2}$
б) Cu → CuO → $CuSO_{4}$ → $Cu(OH)_{2}$ → CuO → Cu
в) фосфор → оксид фосфора(V) → фосфорная кислота → фосфат калия
г) кремний → оксид кремния(IV) → силикат натрия → кремниевая кислота → оксид кремния(IV)
Ответ:
а) Ca → CaO → $Ca(OH)_ {2}$ → $CaCl_{2}$
2Ca + $O_{2}$ = 2CaO
CaO + $H_{2}$O = $Ca(OH)_ {2}$
$Ca(OH)_ {2}$ + 2HCl = $CaCl_{2}$₂ + 2$H_{2}$O
б) Cu → CuO → $CuSO_{4}$ → $Cu(OH)_ {2}$ → CuO → Cu
Cu + $O_ {2}$ = 2CuO
CuO + $H_{2}$ $SO_{4}$ = $CuSO_{4}$ + $H_{2}$O
$CuSO_{4}$ + 2NaOH = $Cu(OH)_ {2}$ + $Na_{2}$ $SO_{4}$
$Cu(OH)_ {2}$ = CuO + $H_{2}$O
CuO + $H_{2}$ = Cu + $H_{2}$O
в) фосфор → оксид фосфора(V) → фосфорная кислота → фосфат калия
4P + 5$O_{2}$ = 2$P_{2}$ $O_{5}$
$P_{2}$ $O_{5}$ + 3$H_{2}$O = 2$H_{3}$ $PO_{4}$
$H_{3}$ $PO_{4}$ + 3KOH = $K_{3}$ $PO_{4}$ + 3$H_{2}$O
г) кремний → оксид кремния(IV) → силикат натрия → кремниевая кислота → оксид кремния(IV)
Si + $O_{2}$ = $SiO_{2}$
$SiO_{2}$ + $Na_{2}$O = $Na_{2}$ $SiO_{3}$
$Na_{2}$ $SiO_{3}$ + 2HCl = $H_{2}$ $SiO_{3}$ + 2NaCl
$H_{2}$ $SiO_{3}$ = $SiO_{2}$ + $H_{2}$O
6. Какой объём углекислого газа (н. у.) образуется при взаимодействии 730 г 20 %−ной соляной кислоты с необходимым количеством мрамора? Какое количество вещества карбоната кальция потребуется для реакции?
Ответ:
Дано:
m р−ра (HCl) = 730 г
ω = 20%
Найти:
V($CO_{2}$) − ?
n($CaCO_{3}$) − ?
Решение:
Запишем уравнение реакции:
$CaCO_{3}$ + 2HCl = $CaCl_{2}$ + $CO_{2}$ + $H_{2}$O
m(HCl) = m(р−ра) * ω = 730 г * 0,2 = 146 г
n(HCl) = m : М = 146 г : 36,5 г/моль = 4 моль
n($CO_{2}$) = 0,5 * n(HCl) = 0,5 * 4 моль = 2 моль
V($CO_{2}$) = n * Vm = 2 моль * 22,4 л/моль = 44,8 л
n($CaCO_{3}$) = 0,5 * n(HCl) = 0,5 * 4 моль = 2 моль
Ответ: объем углекислого газа − 44,8 л; количество вещества карбоната кальция − 2 моль.
Используйте дополнительную информацию
7. Подготовьте сообщение о свойствах и областях применения одного из оксидов металла или неметалла. Аргументируйте выбор оксида.
Ответ:
Рассмотрим оксид натрия. Натрий составляет около 2% земной коры и занимает 6 место в списке самых распространенных металлов.
Оксида натрия имеет молекулярную формулу $Na_{2}$O. Этот оксид проявляет основные свойства, то есть является основным. $Na_{2}$O вступает в реакции с кислотами, образуя соль и воду, водой, образуя щелочи и с кислотными оксидами, образуя соль. Запишем примеры таких реакций:
$Na_{2}$O + 2HCl = 2NaCl + $H_{2}$O
$Na_{2}$O + $H_{2}$O = 2NaOH
$Na_{2}$O + $SO_{2}$ = $Na_{2}$ $SO_{3}$
Оксид натрия используют при производстве керамики и стекла. А также для приготовления растворов гидроксида натрия.

