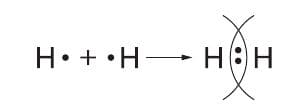§35. Ковалентная химическая связь
Вопрос в начале параграфа
✓ Молекулы многих простых веществ−неметаллов состоят из двух атомов: галогены ($F_{2}$, $Cl_{2}$, $Br_{2}$, $I_{2}$), водород $H_{2}$, кислород $O_{2}$, азот $N_{2}$. Молекула озона состоит из трёх атомов кислорода $O_{3}$, молекула ромбической серы — из восьми атомов $S_{8}$, а молекула белого фосфора из четырёх атомов $P_{4}$. Какие химические связи удерживают одинаковые атомы элементов−неметаллов в составе молекул простого вещества?
Ответ:
Устойчивый восьмиэлектронный слой у таких атомов достигается за счёт того, что каждый из них, связываясь в молекулу, передаёт в совместное пользование свои внешние электроны. При этом образуются общие (поделённые) электронные пары, которые принадлежат внешним электронным слоям соседних атомов. Оба атома удерживаются в молекуле вместе потому, что их положительные ядра притягиваются к электронным парам, которые в одинаковой степени поделены между ними.
Химическую связь, возникающую в результате образования общих электронных пар, называют атомной или ковалентной.
Вопрос (стр.154)
? Что такое валентность с точки зрения её природы?
Ответ:
Число общих электронных пар, т. е. число ковалентных химических связей, которые данный атом образует с другими атомами, называют валентностью.
Проверьте свои знания
1. Какую химическую связь называют ковалентной? Каков механизм её образования? Как определить число непарных электронов на внешнем энергетическом уровне атома? Что такое электронная формула внешнего энергетического уровня атома?
Ответ:
Химическую связь, возникающую в результате образования общих электронных пар, называют атомной или ковалентной.
Устойчивый восьмиэлектронный слой у атомов неметаллов достигается за счёт того, что каждый из них, связываясь в молекулу, передаёт в совместное пользование свои внешние электроны. При этом образуются общие (поделённые) электронные пары, которые принадлежат внешним электронным слоям соседних атомов. Оба атома удерживаются в молекуле вместе потому, что их положительные ядра притягиваются к электронным парам, которые в одинаковой степени поделены между ними.
Число непарных электронов равно числу электронов, которых элементу не хватает до завершения внешнего электронного уровня.
Электронная формула внешнего уровня – графическое отображение числа непарных электронов и электронных пар внешнего энергетического уровня атома элемента.
2. Сравните ионную и ковалентную связи.
Ответ:
Сравним ионную и ковалентную связь:
Ионная связь Ковалентная связь
Способ образования Передача электронов от атома металла к атому неметалла Образование общих электронных пар
Образующие элементы Металл + неметалл Неметалл + неметалл
Примеры NaCl $Cl_{2}$
3. Запишите схему образования ковалентной связи на примере молекулы хлора.
Ответ:
Каждый атом хлора, как и любого другого галогена, содержит на внешнем электронном слое семь электронов: три электронные пары и один непарный электрон, что условно отражает следующая электронная формула его внешнего слоя: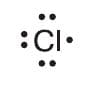
Следовательно, каждому атому не хватает до завершения одного электрона. При сближении двух атомов хлора непарные электроны объединяются в общую электронную пару, которая и связывает их в молекулу.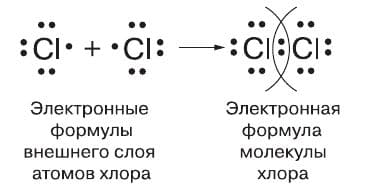
Для того чтобы изобразить образование ковалентной связи, используют условное обозначение — общую электронную пару обозначают чёрточкой, или валентным штрихом. Формулу, в которой ковалентные связи обозначены валентным штрихом, называют структурной формулой. Для молекулы хлора структурную формулу записывают так: Cl − Cl
Примените свои знания
4. Молекула простого вещества состоит из двух атомов. Сумма чисел протонов в ядрах атомов, образующих молекулу, равна 16, что на четырнадцать меньше общего числа нейтронов. Определите: а) формулу вещества; б) какие изотопы данного элемента образовали молекулу; в) какой вид химической связи реализуется в этом веществе.
Ответ:
а) Сумма чисел протонов в ядрах атомов 16, значит, один атом содержит 16 : 2 = 8 протонов. Количество протонов численно равняется порядковому номеру, следовательно, порядковый номер элемента 8 – это кислород ($O_{2}$).
б) Изотопы $^{23}_{8}O$ образовали молекулу кислорода, так как массовое число равняется 8 + 15 = 23 (число нейтронов (16 + 14) : 2 = 16).
в) В этом веществе ковалентная неполярная связь, так как молекула образована двумя атомами неметаллов с одинаковой электроотрицательностью.
5. Число общих электронных пар между двумя атомами в молекулах характеризует кратность ковалентной связи: одинарная, двойная или тройная. Какова кратность ковалентной связи в молекулах веществ, формулы которых $H_{2}$, $Cl_{2}$, $N_{2}$?
Ответ:
Запишем структурные формулы веществ:
1) H − H: одинарная связь, так как атомы водорода соединяются в молекулу с помощью одной общей электронной пары.
2) Cl − Cl: одинарная связь, так как атомы хлора соединяются в молекулу с помощью одной общей электронной пары.
3) N ≡ N: атомы азота соединяются в молекулу с помощью трёх общих электронных пар.
6. Найдите объём (н. у.), который занимают 112 г азота.
Ответ:
Дано:
m ($N_{2}$) = 112 г
Найти:
V ($N_{2}$) − ?
Решение:
V ($N_{2}$) = Vm * n
n ($N_{2}$) = m : M
n ($N_{2}$) = 112 г : 28 г/моль = 4 моль
V ($N_{2}$) = 22,4 л/моль * 4 моль = 89,6 л
Ответ: V ($N_{2}$) = 89,6 л
Выразите свое мнение
7. Американский химик Гилберт Льюис в своей работе «Валентность и структура атомов и молекул» в 1923 г. утверждал, что число электронных пар у атомов в молекулах, как правило, равно четырём. Используйте это утверждение для обоснования постоянного состава двухатомных молекул. Почему это утверждение несостоятельно для двухатомной молекулы водорода?
Ответ:
Это утверждение несостоятельно для двухатомной молекулы водорода, так как атом водорода стремится получить не 8−электронную конфигурацию, а 2−электронную. Это можно объяснить тем, что у атома водорода только один энергетический уровень, а значит у него может быть только 2 электрона.