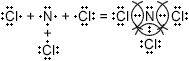Ответы к §12. Ковалентная полярная химическая связь
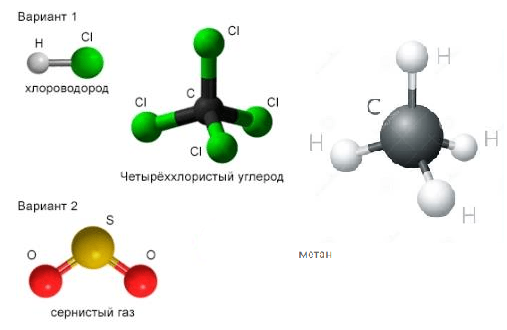
Лабораторный опыт №4
Изготовление моделей молекул бинарных соединений.
Используя шаростержневые наборы, соберите модели молекул следующих веществ:
вариант 1 − хлороводорода HCl, четырёххлористого углерода $ССl_{4}$;
вариант 2 − сернистого газа $SO_{2}$, метана $CH_{4}$.
Ответ:
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. http://www.hemi.nsu.ru/ucheb132.htm
2. https://dic.academic.ru/dic.nsf/ruwiki/972648
3. https://scienceland.info/chemistry8/covalent−bond1
2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Электроорицательность
При взаимодействии элементов образуются электронные пары за счёт принятия или отдачи электронов. Способность атома оттягивать электроны была названа Лайнусом Полингом электроотрицательностью химических элементов. Полинг составил шкалу электроотрицательности элементов от 0,7 до 4.
Электроотрицательность (ЭО) – количественная характеристика элемента, показывающая, с какой силой притягиваются электроны ядром атома. ЭО также характеризует способность удерживать валентные электроны на внешнем энергетическом уровне.
Возможность отдавать или принимать электроны определяет принадлежность элементов к металлам или неметаллам. Ярко выраженными металлическими свойствами обладают элементы, легко отдающие электроны. Элементы, принимающие электроны проявляют неметаллические свойства.
Электроотрицательность проявляется в химических соединениях и показывает смещение электронов в сторону одного из элементов.
Электроотрицательность увеличивается слева направо и уменьшается сверху вниз в периодической таблице Менделеева.
Определить значение можно с помощью таблицы электроотрицательности химических элементов или шкалы Полинга. За единицу принята электроотрицательность лития.
Наибольшей ЭО обладают окислители и галогены. Значение их электроотрицательности больше двух. Рекордсменом является фтор с электроотрицательностью 4
Наименьшую ЭО (меньше двух) имеют металлы первой группы периодической таблицы. Активными металлами считаются натрий, литий, калий, т.к. им легче расстаться с единственным валентным электроном, чем принять недостающие электроны.
Некоторые элементы занимают промежуточное положение. Их электроотрицательность близка к двум. Такие элементы (Si, B, As, Ge, Te) проявляют металлические и неметаллические свойства.
Для удобства сравнения ЭО используется ряд электроотрицательности элементов. Слева располагаются металлы, справа – неметаллы. Чем ближе к краям, тем активнее элемент. Самый сильным восстановителем, легко отдающим электроны и имеющим наименьшую электроотрицательность, является цезий. Активным окислителем, способным притягивать электроны, является фтор.
?. Вопросы и задания
1. У атомов водорода и фосфора почти одинаковые значения ЭО. Каков тип химической связи в молекуле фосфина $PH_{3}$?
Ответ:
В молекуле фосфина $PH_{3}$ ковалентная неполярная химическая связь, так как значения электроотрицательности (ЭО) водорода H и фосфора P приблизительно одинаковы.
Н
|
Н-Р-Н
2. Определите тип химической связи и запишите схему её образования для веществ с формулами:
а) $S_{2}, K_{2}O$ и $H_{2}S$;
б) $N_{2}, LiF$ и $Cl_{3}N$.
Ответ:
а) $S_{2}$ − ковалентная неполярная связь, так как она образована атомами одного и того же элемента.
Сера (S) — это элемент главной подгруппы VI группы, неметалл. Его атомы имеют по шесть электронов на внешнем уровне.
Чтобы определить число неспаренных электронов, воспользуемся формулой:
8 – N = число неспаренных электронов, где N— номер группы химического элемента.
Следовательно, атомы серы будут иметь (8 – 6 = 2) два неспаренный электрона.
В молекуле $S_{2}$ атомы связаны двумя общими электронными парами, поэтому связь двойная.
Схема образования химической связи в молекуле $S_{2}$:
•• •• •• ••
•S• + •S• → S(::)S
•• •• •• ••
S = S
$K_{2}O$ − ионная связь, так как она образована атомами элементов металла и неметалла.
Калий — это элемент главной подгруппы I группы Периодической системы Д.И. Менделеева, металл. Его атому легче отдать один внешний электрон, чем принять недостающие семь.
Кислород — элемент главной подгруппы VI группы, неметалл. Его атому легче принять 2 электрона, чем отдать 6 электронов с внешнего уровня.
Найдём наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2 (2 * 1). Затем определим, сколько атомов калия нужно взять, чтобы они отдали два электрона (т.е. надо взять 2 атома калия), и сколько атомов кислорода надо взять, чтобы они могли принять два электрона (т.е. нужно взять 1 атом кислорода).
K0 — 1e- → K+
O0 + 2e- → O2-
2K0 + O0 → K2+O2-
|_2e_↑
$H_{2}S$ − ковалентная полярная связь, так как она образована атомами разных элементов − неметаллов.
Водород (H) — это элемент главной подгруппы VII группы, неметалл. Его атомы имеют по семь электронов на внешнем уровне.
Непарных электронов будет: 8−7 = 1.
Сера (S) — это элемент главной подгруппы VI группы, неметалл. Его атомы имеют по шесть электронов на внешнем уровне.
Непарных электронов будет: 8−6 = 2.
•• ••
H• + •S• + •H → H(••)S(••)H
•• ••
Н − S − H
Общие электронные пары будут смещены от водорода к сере, как к более электроорицательному элементу.
Hδ+ → S2δ- ← Hδ+
б) $N_{2}$ − ковалентная неполярная связь, так как она образована атомами одного и того же элемента.
Азот (N) — это элемент главной подгруппы V группы, неметалл. Его атомы имеют по пять электронов на внешнем уровне.
Непарных электронов будет: 8−5 = 3.
В молекуле $N_{2}$ атомы связаны тремя общими электронными парами, поэтому связь тройная.
Схема образования химической связи в молекуле $N_{2}$:
• • • •
:N• + •N: = :N(:::)N:
• • • •
N ≡ N
$LiF$ − ионная связь.
Литий — элемент I группы главной подгруппы, металл. Его атому легче отдать 1 внешний электрон, чем принять недостающие 7.
Фтор — элемент главной подгруппы VII группы, неметалл. Его атому легче принять 1 электрон, чем отдать 7 электронов с внешнего уровня.
Найдём наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 1 (1 * 1). Затем определим, сколько атомов лития нужно взять, чтобы они отдали один электрон (т.е. надо взять 1 атом лития), и сколько атомов фтора надо взять, чтобы они могли принять один электрон (т.е. нужно взять 1 атом фтора).
Li0 — 1e- → Li+
F0 + 1e- → F-
Li0 + F0 → Li+F-
|_1e_↑
$Cl_{3}N$ − ковалентная полярная связь.
Хлор (Cl) — это элемент главной подгруппы VII группы, неметалл. Его атомы имеют по семь электронов на внешнем уровне.
Непарных электронов будет: 8−7 = 1.
Азот (N) — это элемент главной подгруппы V группы, неметалл. Его атомы имеют по пять электронов на внешнем уровне.
Непарных электронов будет: 8−5 = 3.
Cl-N-Cl
|
Cl
Общие электронные пары будут смещены от азота к хлору, как к более электроорицательному элементу.
3. В какой из молекул − хлороводорода HCl или фтороводорода HF − ковалентная химическая связь более полярна?
Ответ:
В ряду электроотрицательности фтор (самый э/о элемент) и водород более отдалены друг от друга, чем хлор и водород, значит у молекулы фтороводорода HF связь более полярная.
4. В следующих предложениях впишите пропущенные слова и выражения: «Ковалентная химическая связь образуется за счёт .... По числу общих электронных пар она бывает .... По ЭО ковалентную связь делят на ... и ...»
Ответ:
Ковалентная химическая связь образуется за счет образования общих электронных пар. По числу общих электронных пар она бывает одинарной, двойной и тройной. По ЭО ковалентную связь делят на полярную и неполярную.
5. Определите валентности элементов в соединениях с формулами:
PbS, $PbO_{2}, FeS_{2}, Fe_{2}S_{3}, SF_{6}$.
Ответ:
PbS
Свинец (Pb) в своих соединениях проявляет валентности равные II и IV.
В данном соединении валентность у свинца II.
Определим общее число валентностей всех атомов свинца: II * 1 = 2.
Разделим полученное число на число атомов серы − это и будет значение её валентности: 2 : 1 = II.
$\overset{II}{Pb}\overset{II}{S}$
$PbO_{2}$
Валентность кислорода постоянна $Pb\overset{II}{S_{2}}$.
Общее число валентностей всех атомов кислорода: II * 2 = 4.
Валентность серы: 4 : 1 = IV
$\overset{IV}{Pb}\overset{II}{S_{2}}$.
$ FeS_{2}$
Сера в своих соединениях проявляет валентности равные II, IV и VI.
В данном соединении валентность у серы II.
Общее число валентностей всех атомов серы: II * 2 = 4.
Валентность железа: 4 : 1 = IV
$\overset{IV}{Fe}\overset{II}{S_{2}}$.
$Fe_{2}S_{3}$
Валентность серы II. $Fe_{2}\overset{II}{S_{3}}$.
Общее число валентностей всех атомов серы: II * 3 = 6.
Валентность железа: 6 : 2 = 3
$\overset{III}{Fe_{2}}\overset{II}{S_{3}}$.
$SF_{6}$.
Валентность фтора постоянна $S\overset{I}{F_{6}}$.
Общее число валентностей всех атомов фтора: I * 6 = 6.
Валентность серы: 6 : 1 = VI
$\overset{VI}{S}\overset{I}{F_{6}}$.
6. Запишите формулы хлоридов — соединений элементов с одновалентным хлором: железа (III), меди (I), меди (II),марганца (IV), фосфора (V).
Ответ:
Fe (III): $\overset{III}{Fe}\overset{I}{Cl}$
Наименьшее общее кратное между валентностями элементов: 3 * 1 = 3.
Разделим наименьшее общее кратное на валентность каждого элемента − определим индексы, т.е. число атомов каждого элемента в формуле данного вещества: 3 : III = 1; 3 : I = 3 → $FeCl_{3}$ − хлорид железа (III)
Сu (I): $\overset{I}{Cu}\overset{I}{Cl}$
Наименьшее общее кратное между валентностями элементов: 1 * 1 = 1.
Разделим наименьшее общее кратное на валентность каждого элемента:
1 : I = 1; 1 : I = 1 → CuCl − хлорид меди (I)
Сu (II): $\overset{II}{Cu}\overset{I}{Cl}$
Наименьшее общее кратное между валентностями элементов: 2 * 1 = 2.
Разделим наименьшее общее кратное на валентность каждого элемента:
2 : II = 1; 2 : I = 2 → $CuCl_{2}$ − хлорид меди (II)
Mn (IV): $\overset{IV}{Mn}\overset{I}{Cl}$
Наименьшее общее кратное между валентностями элементов: 4 * 1 = 4.
Разделим наименьшее общее кратное на валентность каждого элемента:
4 : IV = 1; 4 : I = 4 → $MnCl_{4}$ − хлорид марганца (IV)
P (V): $\overset{V}{P}\overset{I}{Cl}$
Наименьшее общее кратное между валентностями элементов: 5 * 1 = 5.
Разделим наименьшее общее кратное на валентность каждого элемента:
5 : V = 1; 5 : I = 5 → $PCl_{5}$ − хлорид фосфора (V)