Ответы к §39. Кислоты, их классификация и свойства
Лабораторный опыт №19
Взаимодействие кислот с основаниями.
Налейте в пробирку 2 мл раствора гидроксида натрия и добавьте к нему 1—2 капли фенолфталеина. Что наблюдаете? Объясните, какие частицы в растворе гидроксида натрия вызвали изменение окраски индикатора. К раствору щёлочи с фенолфталеином добавляйте по каплям соляную кислоту, перемешивая содержимое пробирки. Что вы наблюдаете? Объясните, образование какого вещества привело к изменению окраски индикатора. Потрогайте пробирку, в которой проводили реакцию. Сделайте вывод о её тепловом эффекте. С помощью пипетки поместите 1—2 капли раствора из пробирки на стеклянную или фарфоровую пластину и выпарьте. Что наблюдаете?
Получите нерастворимое основание − гидроксид железа (II): налейте в пробирку 1 мл раствора сульфата железа (II) и добавьте к нему 3 − 4 капли раствора гидроксида калия.
Добавьте в пробирку с гидроксидом железа (II)1 − 2 мл соляной кислоты. Что вы наблюдаете? Поместите 1 − 2 капли полученного раствора на стеклянную или фарфоровую пластину и выпарьте. Рассмотрите образовавшиеся кристаллы. Отметьте их цвет. Составьте молекулярные и ионные уравнения проделанных реакций.
Ответ:
После добавления фенолфталеина к раствору гидроксида натрия индикатор изменяет цвет с бесцветного на малиновый. Изменение окраски фенолфталеина вызывают гидроксид−ионы $(OH^{-})$.
$NaOH = Na^{+} + OH^{-}$.
При добавлении соляной кислоты протекает реакция нейтрализации (катионы водорода связываются с гидроксид−анионами, образуя воду). Раствор становится бесцветным.
$NaOH + HCl = NaCl + H_{2}O$
$Na^{+} + OH^{-} + H^{+} + Cl^{-} = Na^{+} + Cl^{-}+ H_{2}O $
$H^{+} + OH^{-} = H_{2}O$
После протекания реакции нейтрализации пробирка нагрелась, значит эта реакция экзотермическая.
Если поместить 1—2 капли раствора из пробирки на стеклянную пластину и выпарить, то вода испарится, а на пластине останется хлорид натрия в виде белого налёта.
Для получения гидроксида железа смешаем растворы сульфата железа и гидроксида калия.
$FeSO_{4} + 2KOH = K_{2}SO_{4}+ Fe(OH)_{2}↓$
$Fe^{2+} + SO_{4}^{2-}+ 2К^{+} + 2 ОН^{-} = 2K^{+} + SO_{4}^{2-} + Fe(OH)_{2}↓$
$Fe^{2+} + 2OH^{-} = Fe(OH)_{2}↓ $
Если в пробирку добавить раствор соляной кислоты, осадок растворится.
$Fe(OH)_{2} + 2HCl = FeCl_{2} + 2H_{2}O$
$Fe(OH)_{2} + 2H^{+} + 2 Cl^{-} = Fe^{2+} + 2Cl^{-} + 2H_{2}O$
$Fe(OH)_{2} + 2H^{+} = Fe^{2+} + 2H_{2}O$
Если поместить 1—2 капли раствора из пробирки на стеклянную пластину и выпарить, то вода испарится, а на пластине останутся белые с зеленоватым оттенком кристаллы хлорида железа (II), темнеющие на воздухе.
Лабораторный опыт №20
Взаимодействие кислот с оксидами металлов (рис.136).
В пробирку поместите немного (объёмом со спичечную головку) порошка оксида меди (II). Отметьте цвет вещества.
Налейте в пробирку с оксидом меди (II) 1−2 мл раствора серной кислоты. Для ускорения реакции слегка нагрейте (не доводя до кипения) содержимое пробирки. Что наблюдаете?
Поместите на стеклянную пластину 1−2 капли полученного раствора, используя стеклянную палочку или пипетку, и выпарьте его. Что наблюдаете?
Напишите молекулярное и ионные уравнения реакции оксида меди (II) с серной кислотой.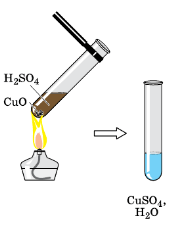
рис. 136. Взаимодействие серной кислоты с оксидом меди (II).
Ответ:
В пробирку поместим немного порошка оксида меди (II). Порошок оксида меди (II) имеет черный цвет.
Нальём в пробирку с оксидом меди (II) 1−2 мл раствора серной кислоты. Для ускорения реакции слегка нагреем (не доводя до кипения) содержимое пробирки. Мы видим, что порошок растворяется.
$CuO + H_{2}SO_{4} = CuSO_{4} + H_{2}O$
$CuO + 2H^{+} + SO_{4}^{2-} = Cu^{2+} + SO_{4}^{2-} + H_{2}O$
$CuO + 2H^{+} = Cu^{2+} + H_{2}O$
Поместим на стеклянную пластину 1−2 капли полученного раствора, используя стеклянную палочку или пипетку, и выпарим его. После выпаривания воды из раствора на стекле остаются голубые кристаллы кристаллогидрата сульфата меди (II).
Если продолжить нагревание, то кристаллы станут белого цвета − безводный сульфат меди.
Лабораторный опыт №21
Взаимодействие кислот с металлами.
Поместите в четыре пробирки металлы (гранулы или кусочки проволоки): в 1−ю − цинк, во 2−ю − алюминий, в 3−ю − свинец, в 4−ю − медь. Налейте в 1−ю и 3−ю пробирки по 2 мл раствора серной кислоты, а во 2−ю и 4−ю − по 2 мл соляной кислоты.
Сделайте вывод о том, в каких пробирках произошли химические реакции. Сформулируйте вывод о возможности взаимодействия кислот с металлами.
Ответ:
Пробирка 1.
$Zn + H_{2}SO4 = ZnSO_{4} + H_{2}↑$
Металл растворился, выделился газ.
Пробирка 2.
$2Al + 6HCl = 2AlCl_{3} + 3H_{2}↑$
Металл растворился, выделился газ.
Пробирка 3.
$Pb + H_{2}SO_{4}$ ⇸ реакция не идет, т. к. на поверхности свинца образуется пленка из сульфата свинца (II), которая защищает его от дальнейшего взаимодействия с серной кислотой.
Пробирка 4.
Cu + HCl ⇸ реакция не идет, т. к. медь в ряду напряжений металлов стоит после водорода.
Вывод. Взаимодействие кислот с металлами возможно, если металл стоит до водорода в ряду напряжений металлов, и если на поверхности металла не образуется нерастворимой пленки, а продуктами реакции являются соль и водород.
Лабораторный опыт №22
Взаимодействие кислот с солями.
В трёх пробирках слейте попарно по 1 − 2 мл растворов веществ: 1−я пробирка − соляной кислоты и силиката натрия; 2−я пробирка − серной кислоты и карбоната калия; 3−я пробирка − соляной кислоты и хлорида или нитрата бария.
Сформулируйте вывод о возможности взаимодействия кислот с солями, вписав пропущенные слова в предложение: «Кислоты взаимодействуют с солями, если в результате реакции образуется ... или ...».
Ответ:
Пробирка 1.
$2HCl + Na_{2}SiO_{3} = 2NaCl + H_{2}SiO_{3}↓ $
Пробирка 2.
$H_{2}SO_{4} + K_{2}CO_{3} = K_{2}SO_{4} + H_{2}O + CO_{2}↑ $
Пробирка 3.
$HCl + Ba(NO_{3})_{2} $ ⇸ реакция не идет.
Вывод: Кислоты взаимодействуют с солями, если в результате реакции образуется осадок или газ.
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. http://www.hemi.nsu.ru/ucheb183.htm
2. https://himi4ka.ru/arhiv−urokov/urok−35−himicheskie−svojstva− kislot.html
3. https://foxford.ru/wiki/himiya/klassifikatsiya−i−nomenklatura−kislot
4. https://obrazovaka.ru/himiya/himicheskie−svoystva−kislot−8−klass.html
5. https://chemege.ru/kisloty/
6. https://multiurok.ru/files/tipichnyie−rieaktsii−kislot−osnovanii−oksidov−soli.html
2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Типичные свойства кислот: взаимодействие их с металлами, оксидами металлов, гидроксидами металлов и солями.
Кислота – это сложное вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток.
Свойства кислот определяются тем, что они способны заменять в своих молекулах атомы водорода на атомы металлов.
Важнейшие химические свойства кислот:
1. Действие растворов кислот на индикаторы. Практически все кислоты (кроме кремниевой) хорошо растворимы в воде. Растворы кислот в воде изменяют окраску специальных веществ – индикаторов. По окраске индикаторов определяют присутствие кислоты. Индикатор лакмус окрашивается растворами кислот в красный цвет, индикатор метиловый оранжевый – тоже в красный цвет.
2. Взаимодействие кислот с основаниями. Эта реакция называется реакцией нейтрализации. Кислота реагируют с основанием с образованием соли, в которой всегда в неизменном виде обнаруживается кислотный остаток. Вторым продуктом реакции нейтрализации обязательно является вода.
Для реакций нейтрализации достаточно, чтобы хотя бы одно из реагирующих веществ было растворимо в воде. Поскольку практически все кислоты растворимы в воде, они вступают в реакции нейтрализации не только с растворимыми, но и с нерастворимыми основаниями. Исключением является кремниевая кислота, которая плохо растворима в воде и поэтому может реагировать только с растворимыми основаниями.
3.Взаимодействие кислот с основными оксидами. Поскольку основные оксиды – ближайшие родственники оснований – с ними кислоты также вступают в реакции нейтрализации.
Как и в случае реакций с основаниями, с основными оксидами кислоты образуют соль и воду. Соль содержит кислотный остаток той кислоты, которая использовалась в реакции нейтрализации.
4. Взаимодействие кислот с металлами. Для взаимодействия кислот с металлом должны выполняться некоторые условия: металл должен быть достаточно активным (реакционноспособным) по отношению к кислотам (чем левее находится металл в ряду активности, тем интенсивнее он взаимодействует с кислотами); кислота должна быть достаточно сильной, чтобы реагировать даже с металлом из левой части ряда напряжения металлов.
5.Взаимодействие с солями. Кислота реагирует в растворе с солью лишь в том случае, если в результате реакции выделяется газ (↑) или образуется нерастворимое вещество, выпадающее в осадок (↓). Такие реакции протекают по механизму ионного обмена.
?. Вопросы и задания
1. Выберите формулу сильной кислоты:
а) $H_{2}S$;
б) $HNO_{3}$;
в) $H_{2}SiO_{3}$.
Запишите уравнение диссоциации кислоты.
Ответ:
б)$HNO_{3}$ − азотная кислота. В водных растворах диссоциируют практически все её молекулы.
$HNO_{3} = H^{+} + NO^{3-}$.
2. Дайте характеристику азотистой кислоты, используя различные признаки классификации кислот.
Ответ:
Азотистая кислота ($HNO_{2}$) – кислородосодержащая, одноосновная, растворимая в воде, летучая, слабая и нестабильная кислота.
3. Определите степени окисления элементов в следующих кислотах: хлорной $HClO_{4}$, хромовой $H_{2}CrO_{4}$, двухромовой $H_{2}Cr_{2}O_{7}$, азотистой $HNO_{2}$, пирофосфорной $H_{4}P_{2}O_{7}$.
Ответ:
1.$HClO_{4}$ − хлорная кислота.
Водород с неметаллами всегда проявляет степень окисления +1, кислород в сложных соединениях всегда проявляет степень окисления −2. Молекула электронейтральная, исходя из этого, вычислим степень окисления хлора. Пусть степень окисления хлора равна − х.
1 + х + (−2) * 4 = 0,
х = 7.
${\overset{+1}{H}}{\overset{+7}{Cl}}{\overset{-2}{O_{4}}}$
2.$H_{2}CrO_{4}$ − хромовая кислота.
Водород с неметаллами всегда проявляет степень окисления +1, кислород в сложных соединениях всегда проявляет степень окисления −2. Молекула электронейтральная, исходя из этого, вычислим степень окисления хрома.Пусть степень окисления хрома равна − х.
1 * 2 + х + (−2) * 4 = 0,
х = 6.
${\overset{+1}{H}}{\overset{+6}{Cr}}{\overset{-2}{O_{4}}}$
3.$H_{2}Cr_{2}O_{7}$ − двухромовая кислота.
Водород с неметаллами всегда проявляет степень окисления +1, кислород в сложных соединениях всегда проявляет степень окисления −2. Молекула электронейтральная, исходя из этого, вычислим степень окисления хрома. Пусть степень окисления хрома равна − х.
1 * 2 + х * 2 + (−2) * 7 = 0,
х = 6.
${\overset{+1}{H_{2}}}{\overset{+6}{Cr}}{\overset{-2}{O_{7}}}$
4.$HNO_{2}$ − азотистая кислота.
Водород с неметаллами всегда проявляет степень окисления +1, кислород в сложных соединениях всегда проявляет степень окисления −2. Молекула электронейтральная, исходя из этого, вычислим степень окисления азота. Пусть степень окисления азота равна − х.
1 + х + (−2) * 2 = 0,
х = 3.
${\overset{+1}{H}}{\overset{+3}{N}}{\overset{-2}{O_{2}}}$
5.$H_{4}P_{2}O_{7}$ − пирофосфорная кислота.
Водород с неметаллами всегда проявляет степень окисления +1, кислород в сложных соединениях всегда проявляет степень окисления −2. Молекула электронейтральная, исходя из этого, вычислим степень окисления фосфора. Пусть степень окисления фосфора равна − х.
1 * 4 + х * 2 + (−2) * 7 = 0,
х = 5.
${\overset{+1}{H_{4}}}{\overset{+5}{P_{2}}}{\overset{-2}{O_{7}}}$
4. Закончите молекулярные уравнения возможных реакций и запишите соответствующие им ионные уравнения:
а) $ZnO + HNO_{3}$ ⟶
б) $Al + H_{2}SO_{4(разб.)}$ ⟶
в) $HNO_{3} + CuSO_{4}$ ⟶
г) $HCl + FeS$ ⟶
д) $H_{2}SO_{4} + Fe(OH)_{3}$ ⟶
Если реакция не может быть осуществлена, объясните почему.
Ответ:
а) $ZnO + 2HNO_{3} = Zn(NO_{3})_{2} + H_{2}O $
$ZnO + 2H^{+} + 2NO^{3-} = Zn^{2+} + 2NO^{3-} + H_{2}O$
$ZnO + 2H^{+} = Zn^{2+} + H_{2}O $
б) $2Al + 3H_{2}SO_{4(разб.)} = Al_{2}(SO_{4})_{3} + 3H_{2}↑ $
$2Al^{3+} + 6H^{+} + 3SO_{4}^{2-} = 2Al^{3+} + 3SO_{4}^{2-} + 3H_{2}↑ $
$2Al^{3+} + 6H^{+} = 2Al^{3+} + 3H_{2}↑ $
в) $HNO_{3} + CuSO_{4} $ ⇸
реакция не идет, т. к. не выделяется газ, не выпадает осадок и не образуется малодиссоциирующее вещество
г) $2HCl + FeS = FeCl_{2} + H_{2}S↑ $
$2H^{+} + 2Cl^{-}+ FeS = Fe^{2+} + 2Cl^{-} + H_{2}S↑ $
$2H^{+} + FeS = Fe^{2+} + H_{2}S↑ $
д) $3H_{2}SO_{4} + 2Fe(OH)_{3} = Fe_{2}(SO_{4})_{3} + 6H_{2}O$
$6H^{+} + 3SO_{4}^{2-} + 2Fe(OH)_{3} = 2Fe^{3+} + 3SO_{4}^{2-} + 6H_{2}O $
$3H^{+} + Fe(OH)_{3} = Fe^{3+} + 3H_{2}O$
5. Рассчитайте объём водорода (н. у.), который выделится при растворении в соляной кислоте 120 г магния, содержащего 2,5% примесей.
Ответ:
Дано:
m (Мg + примеси) = 120 г;
ω (примеси) = 2,5%;
_____________
V ($H_{2}$) − ?
Решение:
$Mg + 2HCl = MgCl_{2} + H_{2}↑$;
ω (Mg) = 100 − ω (примеси) = 100 − 2,5 = 97,5% или 0,975;
m (вещ−во) = m (р−ра) * ω;
m (Mg) = m (Мg + примеси) * ω (Mg) = 120 * 0,975 = 117 г;
$n = \frac{m}{M}$;
M (Mg) = 1 * Ar (Mg) = 24 г/моль;
$n (Mg) = \frac{m (Mg)}{M(Mg)} = \frac{117}{24} = 4,875$ моль;
Запишем уравнение реакции и составим пропорции:
$\underset{1 моль}{\overset{4,875 моль}{Mg}} + 2HCl =MgCl_{2} + \underset{1 моль}{\overset{x}{H_{2}}}$;
$x = n (H_{2}) = \frac{4,875 * 1}{1} = 4,875$ моль;
$V = V_{m} * n$;
$V_{m}$= 22,4 л/моль;
$V (H_{2}) = V_{m} * n (H_{2}) = 22,4 * 4,875 = 109,2$ л.
Ответ. 109,2 л.
6. Запишите формулы оксидов, соответствующих следующим кислотам: $HNO_{2}, HNO_{3}, H_{3}PO_{4}, H_{2}SO_{3}, H_{2}SO_{4}, H_{2}SiO_{3}$.
Ответ:
Кислота Оксид
$H{\overset{+3}{N}}O_{2}$ ${\overset{+3}{N_{2}}}O_{3}$
$H{\overset{+5}{N}}O_{3}$ $ {\overset{+5}{N_{2}}}O_{5}$
$H_{3}{\overset{+5}{P}}O_{4} $ $ {\overset{+5}{P_{2}}}O_{5} $
$H_{2}{\overset{+4}{S}}O_{3} $ ${\overset{+4}{S}}O_{2} $
$H_{2}{\overset{+6}{S}}O_{4} $ ${\overset{+6}{S}}O_{3} $
$H_{2}{\overset{+4}{Si}}O_{3}$ ${\overset{+4}{ Si}}O_{2}$

