ХИМИЧЕСКИЙ ПРАКТИКУМ №2. Свойства электролитов
Практическая работа №6
Опыт 1
Обнаружение сульфат−ионов $SO^{2-}_{4}$.
В одну пробирку налейте 1 − 2 мл раствора сульфата натрия, а в другую − 1 − 2 мл раствора сульфата калия. В обе пробирки по каплям добавьте раствор хлорида бария. Объясните наблюдаемое.
Составьте уравнения электролитической диссоциации взятых солей и уравнение реакции обмена. Запишите полное и сокращённое ионные уравнения реакции.
Какие соединения могут служить реактивом на ионы бария $Ba^{2+}$?
В чём сущность обнаружения ионов с помощью реактива?
Ответ:
При добавлении раствора хлорида бария в раствор сульфата натрия образуется белый осадок сульфата бария:
$Na_{2}SO_{4} + BaCl_{2} = 2NaCl + BaSO_{4}↓$
$Na_{2}SO_{4} → 2Na^{+} + SO_{4}^{2-}$
$BaCl_{2} → Ba^{2+} + 2Cl^{-}$
$2Na^{+} + SO_{4}^{2-} + Ba^{2+} + 2Cl^{-} = 2Na^{+} + 2Cl^{-} + BaSO_{4}↓$
$Ba^{2+} + SO_{4}^{2-} = BaSO_{4}↓$
При добавлении раствора хлорида бария в раствор сульфата калия также образуется белый осадок сульфата бария:
$K_{2}SO_{4} + BaCl_{2} = 2KCl + BaSO_{4}↓$
$K_{2}SO_{4} → 2K^{+} + SO_{4}^{2-}$
$BaCl_{2} → Ba^{2+} + 2Cl^{-}$
$2K^{+} +SO_{4}^{2-} + Ba^{2+} + 2Cl^{-} = 2K^{+} + 2Cl^{-} + BaSO_{4}↓ $
$Ba^{2+} + SO_{4}^{2-} = BaSO_{4}↓$
Растворимые сульфаты, сульфиты, карбонаты и фосфаты могут служить реактивом на ионы бария $Ba2^{2+}$, которые образуют нерастворимые соли с катионом бария.
Сущность обнаружения ионов с помощью реактива в том, чтобы найти такое вещество, которое дает специфичную реакцию.
Опыт 2
Обнаружение хлорид−ионов $Cl^{-}$.
По таблице растворимости выясните, какие соли, содержащие хлорид−ион $Cl^{-}$, нерастворимы (малораствиримы). При помощи имеющихся у вас реактивов докажите, что в растворе хлорида натрия присутствуют хлорид−ионы.
Составьте уравнения диссоциации солей, реакции обмена и полные и сокращённые ионные уравнения проведённых реакций.
Таблица.
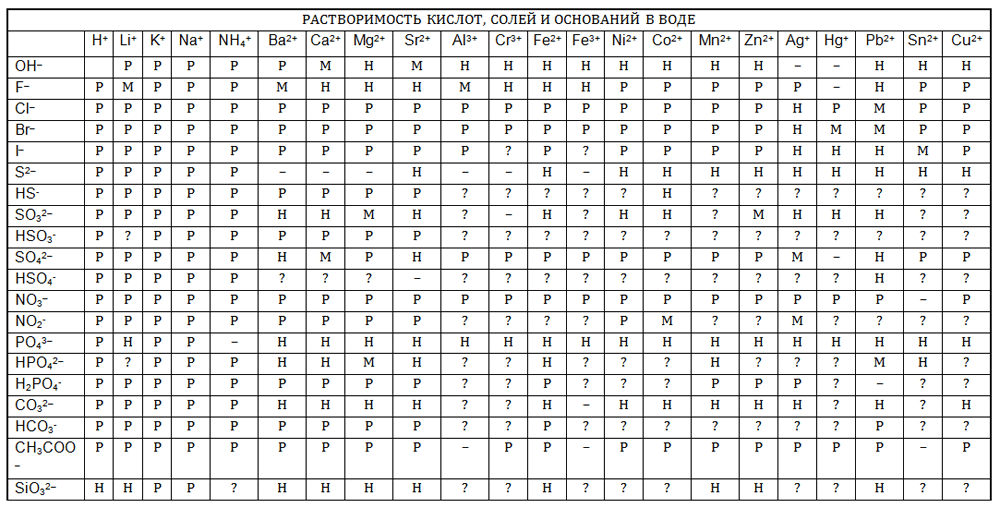
Ответ:
По таблице растворимости видно, что нерастворимым является AgCl − хлорид серебра (I) и малорастворимым является $PbCl_{2}$ хлорид свинца (II).
Для того, чтобы обнаружить хлорид−ионы в растворе хлорида натрия, добавим к раствору нитрат серебра (I), в результате реакции должен образоваться белый творожистый осадок:
$NaCl + AgNO_{3} = NaNO_{3} + AgCl↓$
$NaCl → Na^{+} + Cl^{-} $
$AgNO_{3} → Ag^{+} + NO_{3}^{-} $
$Na^{+} + Cl^{-} + Ag^{+} + NO_{3}^{-} = Na^{+} + NO_{3}^{-} + AgCl↓ $
$Ag^{+} + Cl^{-} = AgCl↓$
Опыт 3
Обнаружение сульфат−ионов $SO^{2-}_{4}$ и хлорид−ионов $Cl^{-}$.
В двух пробирках содержатся растворы хлорида калия и сульфата магния. С помощью каких реакций можно доказать, что в одной пробирке находится раствор хлорида калия, а в другой – раствор сульфата магния?
Раствор из первой пробирки разделите пополам и перелейте в две пробирки. Прилейте в одну пробирку раствор нитрата свинца (II), в другую – раствор хлорида бария. В какой из пробирок выпал осадок? Какая из солей – KCl или $MgSO_{4}$ содержится в первой пробирке?
Раствор из второй пробирки испытайте на присутствие аниона, не обнаруженного в первой пробирке. Для этого к испытуемому раствору прилейте раствор нитрата свинца (II). Объясните наблюдаемое.
Составьте уравнения реакций обмена проведённых вами реакций и полные и сокращённые ионные уравнения реакций обнаружения ионов.
Ответ:
Чтобы доказать, что в пробирке находится раствор хлорида калия, можно использовать раствор растворимой соли серебра (I) или свинца (II).
Осадок выпадет в той пробирке, где добавили нитрат свинца (II) или нитрат серебра (I) к хлориду калия:
$2KCl + Pb(NO_{3})_{2} = 2KNO_{3} + PbCl_{2}↓$
$2K^{+} + 2Cl^{-} + Pb^{2+} + 2NO_{3}^{-} = 2K^{+} + 2NO_{3}^{-} + PbCl_{2}↓$
$Pb^{2+} + 2Cl^{-} = PbCl2↓$
$KCl + AgNO_{3}= KNO_{3} + AgCl↓$
$K^{+} + Cl^{+} + Ag^{+} + NO_{3}^{-} = K^{+} + NO_{3}^{-} + AgCl↓$
$Ag^{+} + Cl^{-} = AgCl↓$
Если к раствору хлорида калия добавить раствор хлорида бария, то осадка не будет.
$2KCl + BaCl_{2}$ − нет изменений.
Чтобы доказать, что в пробирке находится раствор сульфата магния, можно использовать раствор растворимой соли бария.
Осадок выпадет в той пробирке, где добавили раствор хлорида бария к сульфату магния:
$MgSO_{4} + BaCl_{2} = MgCl_{2} + BaSO_{4}↓ $
$Mg^{2+} + SO_{4}^{2-} + Ba^{2+} + 2Cl^{-} = Mg^{2+} + 2Cl^{-} + BaSO_{4}↓$
$Ba^{2+} + SO_{4}^{2-} = BaSO_{4}↓$
Опыт 4
Проделайте реакции, подтверждающие качественный состав следующих веществ: а) хлорида бария; б) сульфата магния; в) карбоната аммония. Для выполнения этого опыта используйте таблицу 12.
Таблица 12. Определение ионов.
Ответ:
а) $BaCl_{2}$ − хлорид бария
Для подтверждения того, что в хлориде бария содержится катион бария, необходимо к его раствору добавить раствор сульфата натрия, в результате реакции образуется белый осадок:
$BaCl_{2} + Na_{2}SO_{4} = 2NaCl + BaSO_{4}↓ $
$Ba^{2+} + 2Cl^{-} + 2Na^{+} + SO_{4}^{2-} = 2Na^{+} + 2Cl^{-} + BaSO_{4}↓$
$Ba^{2+} + SO_{4}^{2-} = BaSO_{4}↓ $
Для подтверждения того, что в хлориде бария содержится хлорид−анион, необходимо к его раствору добавить раствор нитрата серебра (I), в результате реакции образуется белый осадок:
$BaCl_{2} + 2AgNO_{3} = Ba(NO_{3})_{2} + 2AgCl↓ $
$Ba^{+} + 2Cl^{-} + 2Ag^{+} + 2NO_{3}^{-} = Ba^{+} + 2NO_{3}^{-} + 2AgCl↓ $
$Ag^{+} + Cl^{-} = AgCl↓$
б) $MgSO_{4}$ − сульфат магния
Для подтверждения того, что в сульфате магния содержится катион магния, необходимо к его раствору добавить раствор гидроксида натрия, в результате реакции образуется белый осадок:
$MgSO_{4} + 2NaOH = Na_{2}SO_{4} + Mg(OH)2↓$
$Mg^{2+} + SO_{4}^{2-} + 2Na^{2+} + 2OH^{-} = 2Na^{+} + SO_{4}^{2-} + Mg(OH)_{2}↓$
$Mg^{2+} + 2OH^{-} = Mg(OH)2↓$
Для подтверждения того, что в сульфате магния содержится сульфат−анион, необходимо к его раствору добавить раствор хлорида бария, в результате реакции образуется белый осадок:
$MgSO_{4} + BaCl_{2} = MgCl_{2} + BaSO_{4}↓$
$Mg^{2+} + SO_{4}^{2-} + Ba^{2+} + 2Cl^{-} = Mg^{2+} + 2Cl ^{-} + BaSO_{4}↓ $
$Ba^{2+} + SO_{4}^{2-} = BaSO_{4}↓$
в) $(NH_{4})_{2}CO_{3}$ − карбонат аммония
Для подтверждения того, что в карбонате аммония содержится катион аммония, необходимо к его раствору добавить раствор гидроксида натрия, после протекания реакции будет чувствоваться запах аммиака:
$(NH_{4})_{2}CO_{3} + 2NaOH = Na_{2}CO_{3} + 2NH_{3}↑ + 2H_{2}O $
$2NH_{4}^{+} + CO_{3}^{2-} + 2Na^{+} + 2OH^{-} = 2Na^{+} + CO_{3}^{2-} + 2NH_{3}↑ + 2H_{2}O $
$NH_{4}^{+} + OH^{-} = NH_{3}↑ + H_{2}O $
Для подтверждения того, что в карбонате аммония содержится карбонат−анион, необходимо к его раствору добавить раствор соляной кислоты, в результате реакции образуется газ:
$(NH_{4})_{2}CO3 + 2HCl = 2NH_{4}Cl + H_{2}O + CO_{2}↑ $
$2NH_{4}^{+} + CO_{3}^{2-} + 2H^{+} + 2Cl^{-} = 2NH_{4}^{+} + 2Cl^{-} + H_{2}O + CO_{2}↑$
$2H^{+} + CO_{3}^{2-} = H_{2}O + CO_{2}↑$
Практическая работа №7
Опыт 1
Возьмите три пробирки и налейте в каждую по 2 − 3 мл раствора:
в 1−ю — сульфата меди (II),
во 2−ю — хлорида калия,
в 3−ю — сульфата алюминия.
Затем в каждую пробирку добавьте:
в 1−ю — немного раствора гидроксида натрия,
во 2−ю — раствора фосфата натрия,
а в 3−ю — раствора хлорида бария.
Что наблюдаете?
Составьте молекулярные и ионные уравнения реакций.
Сделайте вывод.
Ответ:
1− я пробирка с сульфатом меди (II).
$CuSO_{4} + 2NaOH = Na_{2}SO_{4} + Cu(OH)_{2}↓ $
$Cu^{2+} + SO_{4}^{2-} + 2Na^{+} + 2OH^{-} = 2Na^{+} + SO_{4}^{2-} + Cu(OH)_{2}↓ $
$Cu^{2+} + 2OH^{-} = Cu(OH)_{2}↓ $
Катион меди (II) взаимодействует с гидроксид−анионами, образуя нерастворимый гидроксид меди (II) голубого цвета.
2−я пробирка с хлоридом калия.
$KCl + Na_{3}PO_{4} $ ⇸ реакция не идет.
3−я пробирка с сульфатом алюминия.
$Al_{2}(SO_{4})_{3} + 3BaCl_{2} = 2AlCl_{3} + 3BaSO_{4}↓ $
$2Al^{3+} + 3SO_{4}^{2-} + 3Ba^{2+} + 6Cl^{-} = 2Al^{3+} + 6Cl^{-} + 3BaSO_{4}↓ $
$Ba^{2+} + SO_{4}^{2-} = BaSO_{4}↓ $
Катион бария взаимодействует с сульфат−анионом, образуя нерастворимый сульфат бария белого цвета.
Таким образом, реакции идут до конца, если в результате реакции образуется нерастворимое соединение.
Опыт 2
В две пробирки налейте по 2 − 3 мл растворов сульфита натрия и карбоната натрия соответственно. Затем прилейте в каждую из них раствор азотной кислоты. Что наблюдаете? Составьте молекулярные и ионные уравнения реакций. Сделайте вывод.
Ответ:
При добавлении к солям раствора азотной кислоты выделяется газ.
Пробирка с сульфитом натрия.
$Na_{2}SO_{3} + 2HNO_{3} = 2NaNO_{3} + H_{2}O + SO_{2}↑ $
$2Na^{+} + SO_{3}^{2-} + 2H^{+} + 2NO_{3}^{-} = 2Na^{+} + 2NO_{3}^{-}+ H_{2}O + SO_{2}↑$
$2H^{+} + SO_{3}^{2-} = H_{2}O + SO_{2}↑ $
Пробирка с карбонатом натрия.
$Na_{2}CO_{3} + 2HNO_{3} = 2NaNO_{3} + H_{2}O + CO_{2}↑$
$2Na^{+} + CO_{3}^{2-} + 2H^{+} + 2NO_{3}^{-} = 2Na^{+} + 2NO_{3}^{-} + H_{2}O + CO_{2}↑ $
$2H^{+} + CO_{3}^{2-} = H_{2}O + CO_{2}↑ $
Реакции идут до конца, когда в результате реакции образуется газ. Азотная кислота сильнее угольной и сернистой, поэтому вытесняет их из раствора их солей.
Опыт 3
В одну пробирку налейте 3− 4 мл раствора гидроксида натрия и добавьте две−три капли фенолфталеина .Раствор приобретает малиновый цвет. Затем прилейте соляную кислоту или раствор серной кислоты до обесцвечивания.
В другую пробирку налейте примерно 2—3 мл сульфата меди (II) и добавьте немного раствора гидроксида натрия. Образуется голубой осадок гидроксида меди (II).
Прилейте в пробирку серную кислоту до растворения осадка.
Составьте уравнения происходящих реакций в молекулярном и ионном виде. Поясните, почему в первой пробирке произошло обесцвечивание, а во второй − растворение осадка. Каким общим свойством обладают растворимые и нерастворимые основания?
Ответ:
Пробирка 1.
При добавлении фенолфталеина к гидроксиду натрия раствор окрашивается в малиновый цвет, среда щелочная.
$NaOH → Na^{+} + OH^{-}$
При добавлении соляной кислоты раствор становится бесцветным, значит протекает реакция нейтрализации.
$NaOH + HCl = NaCl + H2O$
$Na^{+} + OH^{-} + H^{+} + Cl^{-} = Na^{+} + Cl^{-} + H_{2}O$
$H^{+} + OH^{-} = H_{2}O $
Пробирка 2.
При добавлении к сульфату меди (II) гидроксида натрия образуется белый осадок.
$CuSO_{4} + 2NaOH = Na_{2}SO_{4} + Cu(OH)_{2}↓ $
$Cu^{2+} + SO_{4}^{2-} + 2Na^{+} + 2OH^{-} = 2Na^{+} + SO_{4}^{2-} + Cu(OH)_{2}↓ $
$Cu^{2+} + 2OH^{-} = Cu(OH)_{2}↓ $
При добавлении раствора серной кислоты осадок растворится, т.к. образуется растворимый сульфат меди (II).
$Cu(OH)_{2}↓ + H_{2}SO_{4} = CuSO_{4} + 2H_{2}O$
$Cu(OH)_{2} ↓ + 2H^{+} + SO_{4}^{2-} = Cu^{2+} + SO_{4}^{2-} + 2H_{2}O $
$Cu(OH)_{2} ↓ + 2H^{+} = Cu^{2+} + 2H_{2}O$
Осадок гидроксида меди (II) растворился, т. к. в результате реакции с серной кислотой образовался растворимый сульфат меди (II).
Взаимодействие с кислотами – это общие свойство, которым обладают растворимые и нерастворимые основания.
Практическая работа №8
Задание 1
вариант 1
Осуществите реакции, характеризующие химические свойства:
соляной кислоты.
Запишите уравнения проделанных вами реакций в молекулярной и ионной формах. Реакцию с металлом рассмотрите как окислительно−восстановительную.
Ответ:
Взаимодействие с металлами, стоящими в электрохимическом ряду до водорода с образованием соли и выделением газообразного водорода.
$Mg + 2HCl = MgCl_{2} + H_{2}↑$
$Mg + 2H^{+} + 2Cl^{-} = Mg^{2+} + 2Cl^{-} + H_{2}↑$
$Mg + 2H^{+} = Mg^{2+} + H_{2}↑$
+1 восст-е 0
H + 2 e- → H2 | 2 | | 1 окислитель
0 окисление +2 | | 2 |
Mg — 2e- → Mg | 2 | | 1 восстановитель
Взаимодействие с основными оксидами с образованием растворимой соли и воды.
$MgO + 2HCl = MgCl_{2} + H_{2}O$
$MgO + 2H^{+} + 2Cl^{-} = Mg^{2+} + 2Cl^{-} + H_{2}O $
$MgO + 2H^{+} = Mg^{2+} + H_{2}O $
Взаимодействие с щелочамис образованием растворимой соли и воды.
$NaOH + HCl = NaCl + H_{2}O$
$Na^{+} + OH^{-} + H^{+} + Cl^{-} = Na^{+} + Cl^{-} + H_{2}O$
$H^{+} + OH^{-} = H_{2}O $
Взаимодействие с нерастворимыми основаниями
$Fe(OH)_{3} + 3HCl = FeCl_{3} + 3H_{2}O$
$Fe(OH)_{3} + 3H^{+} + 3Cl^{-} = Fe^{3+} + 3Cl^{-} + 3H_{2}O$
$Fe(OH)_{3} + 3H^{+} = Fe^{3+} + 3H_{2}O$
Взаимодействие с солями, если выпадает осадок или выделяется газ
$AgNO_{3} + HCl = HNO_{3} + AgCl↓ $
$Ag^{+} + NO^{3-} + H^{+} + Cl^{-} = H^{+} + NO^{3-} + AgCl↓$
$Ag^{+} + Cl^{-} = AgCl↓ $
Сильные кислоты вытесняют более слабые из их солей
$KNO_{2} + HCl= KCl + HNO_{2}$
$K^{+} + NO_{2}^{-} + H^{+} + Cl^{+} = K^{+} + Cl^{-} + HNO_{2}$
$H^{+} + NO_{2}^{-} = HNO_{2}$
вариант 2
Осуществите реакции, характеризующие химические свойства:
раствора серной кислоты.
Запишите уравнения проделанных вами реакций в молекулярной и ионной формах. Реакцию с металлом рассмотрите как окислительно−восстановительную.
Ответ:
Взаимодействие с металлами, стоящими в электрохимическом ряду до водорода с образованием соли и выделением газообразного водорода.
$2Al + 3H_{2}SO_{4} = Al_{2}(SO_{4})_{3} + 3H_{2}↑ $
$2Al + 6H^{+} + 3SO_{4}^{2-} = 2Al^{3+} + 3SO_{4}^{2-} + 3H_{2}↑ $
$2Al + 6H^{+} = 2Al^{3+} + 3H_{2}↑$
+1 восст-е 0
H + 2 e- → H2 | 2 | | 3 окислитель
0 окисление +3 | | 6 |
Al — 3e- → Al | 3 | | 2 восстановитель
Взаимодействие с основными оксидами с образованием растворимой соли и воды.
$CuO + H_{2}SO_{4} = CuSO_{4} + H_{2}O $
$CuO + 2H^{+} + SO_{4}^{2-} = Cu^{2+} + SO_{4}^{2-} + H_{2}O $
$CuO + 2H^{+} = Cu^{2+} + H_{2}O $
Взаимодействие с основаниями с образованием растворимой соли и воды.
$Cu(OH)_{2} + H_{2}SO_{4} = CuSO_{4} + 2H_{2}O $
$Cu(OH)_{2} + 2H^{+} + SO_{4}^{2-} = Cu^{2+} + SO_{4}^{2-} + 2H_{2}O$
$Cu(OH)_{2} + 2H^{+} = Cu^{2+} + 2H_{2}O $
Взаимодействие с солями, если выпадает осадок или выделяется газ.
$BaCl_{2} + H_{2}SO_{4} = 2HCl + BaSO4↓$
$Ba^{2+} + 2Cl^{-} + 2H^{+} + SO_{4}^{2-} = 2H^{+} + 2Cl^{-} + BaSO_{4}↓$
$Ba^{2+} + SO_{4}^{2-} = BaSO_{4}↓ $
Сильные кислоты вытесняют более слабые из их солей.
$2NaNO_{2} + H_{2}SO_{4} = Na_{2}SO_{4} + 2HNO_{2} $
$2Na^{+} + 2NO_{2}^{-} + 2H^{+} + SO_{4}^{2-}=2Na^{+} + SO_{4}^{2-} + 2HNO_{2} $
$H^{+} + NO_{2}^{-} = HNO_{2}$
Задание 2
вариант 1
Проделайте реакции, характеризующие химические свойства раствора гидроксида натрия.
Запишите уравнения проделанных вами реакций в молекулярной и ионной формах
Ответ:
Взаимодействие с кислотными оксидами
$SO_{2} + 2NaOH = Na_{2}SO_{3} + H_{2}O$
$SO_{2} + 2Na^{+} + 2OH^{-} = 2Na^{+} + SO_{3}^{2-} + H_{2}O$
$SO_{2} + 2OH^{-} = SO_{3}^{2-} + H_{2}O$
Взаимодействие с кислотами
$HCl + NaOH = NaCl + H_{2}O $
$H^{+} + Cl^{-} + Na^{+} + OH^{-} = Na^{+} + Cl^{-} + H_{2}O$
$H^{+} + OH^{-} = H_{2}O$
Взаимодействие с растворами солей, если выпадает осадок или выделяется газ.
$FeCl_{3} + 3NaOH = 3NaCl + Fe(OH)_{3}↓ $
$Fe^{3+} + 3Cl^{-} + 3Na^{+} + 3OH^{-} = 3Na^{+} + 3Cl^{-} + Fe(OH)_{3}↓$
$Fe^{3+} + 3OH^{-} = Fe(OH)_{3}↓$
вариант 2
Получите гидроксид железа (III) реакцией обмена и осуществите реакции, характеризующие его химические свойства.
Запишите уравнения проделанных вами реакций в молекулярной и ионной формах.
Ответ:
Получение гидроксида железа (III) реакцией обмена.
$FeCl_{3} + 3NaOH = NaCl + Fe(OH)_{3}↓$
$Fe^{3+} + 3Cl^{-} + 3Na^{+} + 3OH^{-} = 3Na^{+} + 3Cl^{-} + Fe(OH)_{3}↓$
$Fe^{3+} + 3OH^{-} = Fe(OH)_{3}↓ $
Разложение гидроксида железа (III) при нагревании.
$2Fe(OH)_{3} \overset{t}{=} Fe_{2}O_{3} + 3H_{2}O $
Взаимодействие с кислотами.
$Fe(OH)_{3} + 3HCl = FeCl_{3} + 3H_{2}O$
$Fe(OH)_{3} + 3H^{+} + 3Cl^{-} = Fe^{3+} + 3Cl^{-} + 3H_{2}O$
$Fe(OH)_{3} + 3H^{+} = Fe^{3+} + 3H_{2}O$
Задание 3
вариант 1
Получите оксид серы (IV) и проделайте реакции, характеризующие его химические свойства.
Запишите уравнения реакций в молекулярной и ионной формах, если это возможно.
Ответ:
Получение оксида серы (IV):
− сжигание серы на воздухе:
$S + O_{2 }= SO_{2} $
− горение сульфидов и сероводорода:
$2H_{2}S + 3O_{2} = 2SO_{2} + 2H_{2}O$
− взаимодействие сульфитов с более сильными кислотами:
$Na_{2}SO_{3} + 2HNO_{3}= 2NaNO_{3} + SO_{2}↑ + H_{2}O$
$2Na^{+} + SO_{3}^{2-} + 2H^{+} + 2 NO_{3}^{-} = 2 Na^{+} + 2 NO_{3}^{-} + SO_{2}↑ + H_{2}O$
$2H^{+} + SO_{3}^{2-} = SO_{2}↑ + H_{2}O$
Растворяется в воде с образованием слабой и неустойчивой сернистой кислоты.
$H_{2}O + SO_{2} ⇄ H_{2}SO_{3} $
Взаимодействует с основными оксидами.
$K_{2}O + SO_{2} = K_{2}SO_{3} $
Взаимодействует с щелочами.
$2NaOH + SO_{2} = Na_{2}SO_{3} + H_{2}O $
$2Na^{+} + 2OH^{-} + SO_{2} = 2Na^{+} + SO_{3}^{2-} + H_{2}O $
$2OH^{-} + SO_{2} = SO_{3}^{2-} + H_{2}O $
вариант 2
Проделайте реакции, характеризующие химические свойства оксида кальция.
Запишите уравнения реакций в молекулярной и ионной формах, если это возможно.
Ответ:
Взаимодействует с водой:
$CaO + H_{2}O = Ca(OH)_{2}$
Взаимодействует с кислотными оксидами:
$CaO + CO_{2} = CaCO_{3} $
Взаимодействует с кислотами с образованием соли и воды.
$CaO + 2HCl = CaCl_{2} + H_{2}O$
$CaO + 2H^{+} + 2Cl^{-} = Ca^{2+} + 2Cl^{-} + H_{2}O$
$CaO + 2H^{+} = Ca^{2+} + H_{2}O$
Задание 4
вариант 1
Проделайте реакции, характеризующие химические свойства:
хлорида железа (II).
Запишите уравнения реакций в молекулярной и ионной формах. Реакции с участием металла рассмотрите как окислительно−восстановительные.
Ответ:
Взаимодействует с металлами, стоящими в электрохимическом ряду напряжений металлов левее железа.
t
Mg + FeCl2 → MgCl2 + Fe↓
+2 восст-е 0
Fe + 2 e- → Fe | 2 | | 1 окислитель
0 окисление +2 | | 2 |
Mg — 2e- → Mg | 2 | | 1 восстановитель
Взаимодействует с щелочами.
$FeCl_{2} + 2NaOH = 2NaCl + Fe(OH)_{2}↓ $
$Fe^{2+} + 2Cl^{-} + 2Na^{+} + 2OH^{-} = 2Na^{+} + 2Cl^{-} + Fe(OH)2↓$
$Fe^{2+} + 2OH^{-} = Fe(OH)2↓ $
Взаимодействие с растворами солей, если выпадает осадок или выделяется газ.
$FeCl_{2} + Na_{2}S = 2NaCl + FeS↓ $
$Fe^{2+} + 2Cl^{-} + 2Na^{+} + S^{2-} = 2Na^{+} + 2Cl^{-} + FeS↓$
$Fe^{2+} + S^{2-} = FeS↓$
вариант 2
Проделайте реакции, характеризующие химические свойства:
хлорида меди (II).
Запишите уравнения реакций в молекулярной и ионной формах. Реакции с участием металла рассмотрите как окислительно−восстановительные.
Ответ:
Взаимодействует с металлами, стоящими в электрохимическом ряду напряжений металлов левее меди.
$Fe + CuCl_{2} \overset{t}{→} FeCl_{2} + Cu↓$
+2 восст-е 0
Cu + 2 e- → Cu | 2 | | 1 окислитель
0 окисление +2 | | 2 |
Fe — 2e- → Fe | 2 | | 1 восстановитель
Взаимодействует с щелочами.
$CuCl_{2} + 2NaOH = 2NaCl + Cu(OH)_{2}↓ $
$Cu^{2+} + 2Cl^{-} + 2Na^{+} + 2OH^{-} = 2Na^{+} + 2Cl^{-} + Cu(OH)_{2}↓ $
$Cu^{2+} + 2OH^{-} = Cu(OH)_{2}↓ $
Взаимодействие с растворами солей, если выпадает осадок или выделяется газ.
$CuCl_{2} + Na_{2}S = 2NaCl + CuS↓ $
$Cu^{2+} + 2Cl^{-} + 2Na^{+} + S^{2-} = 2Na^{+} + 2Cl^{-} + CuS↓ $
$Cu^{2+} + S^{2-} = CuS↓$
Практическая работа №9
1. Налейте в пробирку 1 − 2 мл концентрированного раствора серной кислоты и опустите в неё гранулу цинка. Составьте уравнение реакции в молекулярном и ионном видах, покажите переход электронов. Что в этой реакции является окислителем?
Ответ:
Серная кислота реагирует с цинком с образованием газа водорода, цинк при этом растворяется.
$Zn + H_{2}SO_{4} = ZnSO_{4} + H_{2}↑$
$Zn + 2H^{+} + SO_{4}^{2-} = Zn^{2+} + SO_{4}^{2-} + H_{2}↑ $
$Zn + 2H^{+} = Zn^{2+} + H_{2}↑$
+ восст-е 0
2H + 2 e- → H2 | 2 | | 1 окислитель
0 окисление +2 | | 2 |
Zn — 2e- → Zn | 2 | | 1 восстановитель
2. В шести пробирках находятся растворы хлорида магния. В каждую из пробирок последовательно прилейте следующие растворы:
а) гидроксид натрия;
б) сульфат калия;
в) карбонат натрия;
г) нитрат цинка;
д) фосфат калия;
е) сульфид натрия.
Составьте уравнения реакций, протекающих до конца, в молекулярном и ионном видах.
Ответ:
а) $MgCl_{2} + 2NaOH = 2NaCl + Mg(OH)_{2}↓ $
$Mg^{2+} + 2Cl^{-} + 2Na+ 2OH^{-} = 2Na+ + 2Cl^{-} + Mg(OH)_{2}↓ $
$Mg^{2+} + 2OH^{-} = Mg(OH)_{2}↓ $
б) $MgCl_{2} + K_{2}SO_{4}$ ⇸
реакция не идет, т. к. не образуется осадок или газ.
в) $MgCl_{2} + Na_{2}CO_{3} = 2NaCl + MgCO_{3}↓$
$Mg^{2+} + 2Cl^{-} + 2Na^{+} + CO_{3}^{2-} = 2Na^{+} + 2Cl^{-} + MgCO_{3}↓ $
$Mg^{2+} + CO_{3}^{2-} = MgCO_{3}↓ $
г) $MgCl_{2} + Zn(NO_{3})_{2}$ ⇸ реакция не идет, т. к. не образуется осадок или газ.
д) $3MgCl_{2} + 2K_{3}PO_{4} = 6KCl + Mg_{3}(PO_{4})_{2}↓$
$3Mg^{2+} + 6Cl^{-} + 6K^{+} + 2PO_{4}^{3-} = 6K^{+} + 6Cl^{-} + Mg_{3}(PO_{4})_{2}↓ $
$3Mg^{2+} + 2PO_{4}^{3-} = Mg_{3}(PO_{4})_{2}↓ $
е) $MgCl_{2} + Na_{2}S = 2NaCl + MgS↓ $
$Mg^{2+} + 2Cl^{-} + 2Na^{+} + S^{2-} = 2Na^{+} + 2Cl^{-} + MgS↓ $
$Mg^{2+} + S^{2-} = MgS↓$
3. Даны растворы:
а) карбоната калия и соляной кислоты;
б) сульфида натрия и серной кислоты;
в) хлорида цинка и азотной кислоты;
г) сульфита натрия и серной кислоты;
д) сульфата меди (II) и азотной кислоты.
Слейте попарно эти растворы, немного нагрейте и осторожно определите по запаху, в каких случаях реакции протекают до конца и почему. Составьте уравнения соответствующих реакций в молекулярном и ионном виде.
Ответ:
а) $K_{2}CO_{3} + 2HCl= 2KCl + H_{2}O + CO_{2}↑ $
$2K^{+} + CO_{3}^{2-} + 2H^{+} + 2Cl^{-} = 2K^{+} + 2Cl^{-} + H_{2}O + CO_{2}↑ $
$2H^{+} + CO_{3}^{2-} = H_{2}O + CO_{2}↑ $
Реакция идет до конца, т. к. выделяется газ, не имеющий запаха.
б) $Na_{2}S + H_{2}SO_{4} = Na_{2}SO_{4} + H_{2}S↑ $
$2Na^{+} + S^{2-} + 2H^{+} + SO_{4}^{2-} = 2Na^{+} + SO_{4}^{2-} + H_{2}S↑$
$2H^{+} + S^{2-} = H_{2}S↑ $
Реакция идет до конца, т. к. выделяется газ, имеющий запах тухлых яиц.
в) $ZnCl_{2} + HNO_{3}$ ⇸ реакция не идет, т. к. не образуется осадок или газ.
г) $Na_{2}SO_{3} + H_{2}SO_{4} = Na_{2}SO_{4} + H_{2}O + SO_{2}↑$
$2Na^{+} + SO_{3}^{2-} + 2H^{+} + SO_{4}^{2-} = 2Na^{+} + SO_{4}^{2-} + H_{2}O + SO_{2}↑ $
$2H^{+} + SO_{3}^{2-} = H_{2}O + SO_{2}↑ $
Реакция идет до конца, т. к. выделяется газ, имеющий запах загорающейся спички.
д) $CuSO_{4} + 2HNO_{3} $⇸ реакция не идет, т. к. не образуется осадок или газ.
4. Осуществите реакции, схемы которых:
а) $Ba^{2+} + CO^{2-}_{3} ⟶ BaCO_{3}↓$;
б) $2H^{+} + CO^{2-}_{3}⟶ CO_{2}↑ + H_{2}O$;
в) $H^{+} + OH^{-} ⟶ H_{2}O$;
г) $Fe^{0} ⟶ Fe^{2+}$;
д) $CuO ⟶ Cu^{2+}$;
е) $Pb^{2+} + S^{2-} ⟶ PbS↓$.
Ответ:
а) $Ba^{2+} + CO^{2-}_{3} ⟶ BaCO_{3}↓$;
$BaCl_{2} + Na_{2}CO_{3} = 2NaCl + BaCO_{3}↓ $
б) $2H^{+} + CO^{2-}_{3}⟶ CO_{2}↑ + H_{2}O$;
$2HCl + K_{2}CO_{3} = 2KCl + CO_{2}↑ + H_{2}O $
в) $H^{+} + OH^{-} ⟶ H_{2}O$;
$HCl + NaOH = NaCl + H_{2}O $
г) $Fe^{0} ⟶ Fe^{2+}$;
$Fe + H_{2}SO_{4} = FeSO_{4} + H_{2}↑ $
д) $CuO ⟶ Cu^{2+}$;
$CuO + H_{2}SO_{4} = CuSO_{4} + H_{2}O $
е) $Pb^{2+} + S^{2-} ⟶ PbS↓$.
$Pb(NO_{3})_{2} + Na_{2}S = 2NaNO_{3} + PbS↓$
5. Проделайте реакции между следующими веществами:
а) сероводородной и хлорной водой;
б) раствором иодида калия и хлорной водой;
в) соляной кислотой и алюминием;
г) концентрированной серной кислотой и медью (при нагревании).
Составьте уравнения реакций, покажите переход электронов. Что является окислителем и что − восстановителем?
Ответ:
а) а) $H_{2}S + Cl_{2} = S + 2HCl $
0 восст-е -
Cl2 + 2 е- → 2Cl | 2 | 2 | 1 окислитель
-2 окисление 0
S — 2e- → S | 2 | | 1 восстановитель
б) б) $2KI + Cl_{2} = 2KCl + I_{2} $
0 восст-е -
Cl2 + 2 е- → 2Cl | 2 | 2 | 1 окислитель
- окисление 0
2I — 2e- → I2 | 2 | | 1 восстановитель
в) в) $2Al + 6HCl = 2AlCl_{3} + 3H_{2}↑ $
+ восст-е 0
H + 2 е- → H2 | 2 | 6 | 3 окислитель
0 окисление +3
Al — 3e- → Al | 2 | | 2 восстановитель
г) г) $Cu + 2H_{2}SO_{4(конц.)} ⟶ CuSO_{4} + SO_{2}↑ + 2H{2}O $
+6 восст-е +4
S + 2 е- → S | 2 | 2 | 1 окислитель
0 окисление +2
Cu — 2e- → Cu | 2 | | 1 восстановитель
6. Пользуясь растворами и веществами, находящимися на столе, получите:
а) гидроксид железа (III);
б) сульфид меди (II);
в) оксид серы (IV);
г) карбонат магния;
д) свинец.
Составьте молекулярные и ионные уравнения соответствующих реакций.
Ответ:
а) $FeCl_{3} + 3NaOH = 3NaCl + Fe(OH)_{3}↓$
$Fe^{3+} + 3Cl^{-} + 3Na^{+} + 3OH^{-} = 3Na^{+} + 3Cl^{-} + Fe(OH)_{3}↓$
$Fe^{3+} + 3OH^{-} = Fe(OH)_{3}↓ $
б) $ CuSO_{4} + Na_{2}S = Na_{2}SO_{4} + CuS↓ $
$Cu^{2+} + SO_{4}^{2-} + 2Na^{+} + S^{2-} = 2Na^{+} + SO_{4}^{2-} + CuS↓ $
$Cu^{2+} + S^{2-} = CuS↓ $
в) $Na_{2}SO_{3} + H_{2}SO_{4} = Na_{2}SO_{4} + H_{2}O + SO_{2}↑ $
$2Na^{+} + SO_{3}^{2-} + 2H^{+} + SO_{4}^{2-} = 2Na^{+} + SO_{4}^{2-} + H_{2}O + SO_{2}↑ $
$2H^{+} + SO_{3}^{2-} = H_{2}O + SO_{2}↑ $
г) $MgCl_{2} + Na_{2}CO_{3} = 2NaCl + MgCO_{3}↓$
$Mg^{2+} + 2Cl^{-} + 2Na^{+} + CO_{3}^{2-} = 2Na^{+} + 2Cl^{-} + MgCO_{3}↓$
$Mg^{2+} + CO_{3}^{2-} = MgCO_{3}↓ $
д) $Zn + Pb(NO_{3})_{2} = Zn(NO_{3})_{2} + Pb↓ $
$Zn+ Pb^{2+} + 2NO_{3}^{2-} = Zn^{2+} + 2NO_{3}^{2-} + Pb↓ $
$Zn + Pb^{2+} = Zn^{2+} + Pb↓$

