Ответы к §40. Основания, их классификация и свойства
Лабораторный опыт №23
Взаимодействие щелочей с кислотами.
Запишите два молекулярных уравнения реакций, сущность которых выражается следующим ионным уравнением: $H^{+} + ОН^{-}= H_{2}O$.
Проведите реакции, уравнения которых вы составили. Вспомните, какие вещества (кроме кислоты и щёлочи) необходимы для наблюдения за этими химическими реакциями.
Ответ:
$H^{+} + ОН^{-}= H_{2}O$
$HCl + NaOH = NaCl + H_{2}O$
$2HNO_{3} + Ca(OH)_{2} = Ca(NO_{3})_{2} + 2H_{2}O$
Необходимо использовать индикаторы, которые изменяют свой цвет в зависимости от pH раствора.
Лабораторный опыт №24
Взаимодействие щелочей с оксидами неметаллов.
Повторите опыт, который вы проделывали раньше. В пробирку налейте 2 − 3 мл прозрачного раствора известковой воды. Поместите в неё соломинку для сока, которая выполняет роль газоотводной трубки. Осторожно пропускайте через раствор выдыхаемый воздух. Что наблюдаете? Запишите молекулярное и ионное уравнения реакции.
Ответ:
В пробирку нальём 2 − 3 мл прозрачного раствора известковой воды. Поместим в неё соломинку для сока. Осторожно пропустим через раствор выдыхаемый воздух, который содержит углекислый газ. При пропускании воздуха через прозрачный раствор известковой воды, наблюдаем помутнение раствора за счет выпадения осадка карбоната кальция.
$Ca(OH)_{2} + CO_{2} = CaCO_{3}↓ + H_{2}O$
$Ca^{2+} + 2OH^{-}+ CO_{2} = CaCO_{3}↓ + H_{2}O$
Лабораторный опыт №25
Взаимодействие щелочей с солями.
В трёх пробирках слейте попарно по 1 − 2 мл растворов веществ:
1−я пробирка − гидроксида натрия и хлорида аммония;
2−я пробирка − гидроксида калия и сульфата железа (III);
3−я пробирка − гидроксида натрия и хлорида бария.
Нагрейте содержимое 1−й пробирки и определите по запаху один из продуктов реакции.
Сформулируйте вывод о возможности взаимодействия щелочей с солями.
Ответ:
Пробирка 1.
$NaOH + NH_{4}Cl = NaCl + NH_{3}↑ + H_{2}O$
При нагревании происходит выделение аммиака - вещества с характерным запахом.
Пробирка 2.
$6KOH + Fe_{2}(SO_{4})_{3} = 3K_{2}SO_{4} + 2Fe(OH)_{3}↓ $
Пробирка 3.
$NaOH + BaCl_{2}$ ⇸
Таким образом, щелочи взаимодействуют с солями, если в результате реакции образуется осадок, или газ, или малодиссоциирующие вещество.
Лабораторный опыт №26
Получение и свойства нерастворимых оснований.
В две пробирки налейте по 1 мл раствора сульфата или хлорида меди (II). В каждую пробирку добавьте по 3 − 4 капли раствора гидроксида натрия. Опишите образовавшийся гидроксид меди (II).
Примечание. Оставьте пробирки с полученным гидроксидом меди (II) для проведения следующих опытов.
Составьте молекулярное и ионные уравнения проведённой реакции. Укажите тип реакции по признаку «число и состав исходных веществ и продуктов реакции».
Добавьте в одну из пробирок с полученным в предыдущем опыте гидроксидом меди (II) 1 − 2 мл соляной кислоты. Что наблюдаете?
Используя пипетку, поместите 1− 2 капли полученного раствора на стеклянную или фарфоровую пластину и, используя тигельные щипцы, выпарьте его. Рассмотрите образующиеся кристаллы. Отметьте их цвет.
Составьте молекулярное и ионные уравнения проведённой реакции. Укажите тип реакции по признаку «число и состав исходных веществ и продуктов реакции», «участие катализатора» и «обратимость химической реакции».
Нагрейте одну из пробирок с полученным ранее или выданным учителем гидроксидом меди (II) (рис. 141).Что наблюдаете?
Составьте уравнение проведённой реакции, укажите условие её протекания и тип реакции по признакам «число и состав исходных веществ и продуктов реакции», «выделение или поглощение теплоты» и «обратимость химической реакции».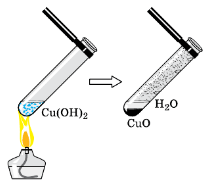
рис. 141. Разложение гидроксида меди (II) при нагревании.
Ответ:
$CuSO_{4} + 2NaOH = Na_{2}SO_{4} + Cu(OH)_{2}↓ $
$Cu^{2+} + SO_{4}^{2-}+ 2Na^{+} + 2OH^{-} = 2Na^{+} + SO_{4}^{2-} + Cu(OH)_{2}↓ $
$Cu^{2+} + 2OH^{-} = Cu(OH)_{2}↓ $
Выпадает синий осадок гидроксида меди (II). Это реакция ионного обмена.
При добавлении соляной кислоты к гидроксиду меди (II) наблюдается растворение осадка:
$2HCl + Cu(OH)_{2} = CuCl_{2} + 2H_{2}O $
$2H^{+} + 2Cl^{-} + Cu(OH)_{2} = Cu^{2+} + 2Cl^{-} + 2H_{2}O$
$2H^{+} + Cu(OH)_{2} = Cu^{2+} + 2H_{2}O$
Эта реакция ионного обмена, необратимая, некаталитическая.
Используя пипетку, поместим 1− 2 капли полученного раствора на стеклянную пластину и, используя тигельные щипцы, выпарим его. При выпаривании раствора образуются кристаллы зеленого цвета, это хлорид меди (II).
При нагревании гидроксида меди (II) наблюдается его почернение, т. к. образуется оксид меди (II):
$Cu(OH)_{2} \overset{t}{=} CuO + H_2O$
Реакция протекает при нагревании. Это реакция разложения, эндотермическая, необратимая.
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. http://www.hemi.nsu.ru/ucheb184.htm
2. http://lib.repetitors.eu/himiya/160−2010−07−16−04−24−25/2150−2010−08−21−05−33−37
3. https://www.yaklass.ru/p/himija/89−klass/klassy−neorganicheskikh−veshchestv−14371/osnovaniia−klassifikatciia−svoistva−poluchenie−13717
4. https://himi4ka.ru/arhiv−urokov/urok−37−osnovanija.html
2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Типичные свойства оснований: взаимодействие их с кислотами, оксидами неметаллов, солями.
Основания − это сложные вещества, в молекулах которых атомы металла соединены с одной или несколькими гидроксильными группами.
Основания − это электролиты, которые при диссоциации образуют в качестве анионов только гидроксид−ионы.
Химические свойства.
1. Кристаллы щелочей при растворении в воде полностью диссоциируют, то есть распадаются на положительно заряженные ионы металла и отрицательно заряженные гидроксид−ионы.
2. Фактически с индикатором взаимодействуют гидроксид−ионы, содержащиеся в растворе любой щёлочи. При этом протекает химическая реакция с образованием нового продукта, признаком протекания которой является изменение окраски вещества.
Фенолфталеин: бесцветный → малиновый.
Лакмус: фиолетовый → синий.
Метилоранж : оранжевый → жёлтый.
3. Щёлочи взаимодействуют с кислотами, образуя соль и воду.
В результате реакции между щелочью и кислотой образуется раствор соли, в котором уже нет ни щелочи, ни кислоты. Такой раствор называется нейтральным. Слово «нейтральный» происходит от греческого «нейтер», что в переводе на русский язык означает «ни тот ни другой».
Реакция между щелочью и кислотой, в результате которой образуется нейтральный раствор, называется реакцией нейтрализации.
4. Щёлочи взаимодействуют с с кислотными оксидами с образованием солей тех кислот, которые соответствуют реагирующим кислотным оксидам. В зависимости от количества щёлочи образуются средние или кислые соли. .
5. Щёлочи могут взаимодействовать с растворимыми в воде солями. Реакции этого типа относятся к реакциям обмена, поскольку в процессе взаимодействия исходные вещества — щелочь и соль — обмениваются своими составными частями. При этом валентность атомов металлов и кислотных остатков не изменяется. Реакция обмена между основанием и солью возможна в том случае, если оба исходных вещества растворимы, а в результате образуется хотя бы одно нерастворимое вещество (выпадает осадок).
?. Вопросы и задания
1. Выберите сильное основание: $NH_{3}*H_{2}O, Cu(OH)_{2}, KOH$.
Ответ:
Сильным основанием является гидроксид калия КОН. В водном растворе диссоциируют практически все его молекулы.
$КОН = К^{+} + OH^{-}$
2. Дайте характеристику гидроксида бария, используя различные признаки классификации оснований.
Ответ:
Гидроксид бария $Ba(OH)_{2}$ – сильное, растворимое, двухкислотное, стабильное основание.
3. Закончите молекулярные уравнения возможных реакций, запишите соответствующие им ионные уравнения:
а) $P_{2}O_{5} + NaOH_{(изб.)}$ ⟶
б) $Fe(OH)_2 + HNO_{3(изб.)}$ ⟶
в) $(NH_{4})_{2}SO_{4} + KOH$ ⟶
г) $Ca(OH)_{2(изб.)} + CO_{2}$ ⟶
д) $Ba(OH)_{2} + Fe(NO_{3})_{3}$ ⟶
е) $KOH + NaNO_{3}$ ⟶
ж) $Mg(OH)_{2} + FeO$ ⟶
з) $CuOH \overset{t}{→}$
Если реакция не будет протекать, укажите причину этого.
Ответ:
а) $P_{2}O_{5} + 6NaOH_{(изб.)} = 2Na_{3}PO_{4} + 3H_{2}O$
$P_{2}O_{5} + 6Na^{+} + 6OH^{-} = 6Na^{+} + 2PO_{4}^{3-} + 3H_{2}O$
$P_{2}O5_{5} + 6OH^{-} = 2PO_{4}^{3-} + 3H_{2}O $
б) $Fe(OH)_{2} + 2HNO_{3(изб.)} = Fe(NO_{3})_{2} + 2H_{2}O$
$Fe(OH)_{2} + 2H^{+} + 2NO^{3-} = Fe^{2+} + 2NO^{3-} + 2H_{2}O$
$Fe(OH)_{2} + 2H^{+} = Fe^{2+} + 2H_{2}O $
в) $ (NH_{4})_{2}SO_{4} + 2KOH = K_{2}SO_{4} +2NH_{3}↑ + 2Н_{2}O $
$2NH_{4}^{+} + SO_{4}^{2-} + 2K^{+} + 2OH^{-} = 2K^{+} + SO_{4}^{2-} + 2NH_{3}↑ + 2Н_{2}O $
$NH4^{+} + OH^{-} = NH_{3}↑ + Н_{2}O$
г) $Ca(OH)_{2(изб.)} + CO_{2} = H_{2}O + CaCO_{3}↓ $
$Ca_{2}^{+} + 2OH^{-} + CO_{2} = H_{2}O + CaCO_{3}↓ $
д) $ 3Ba(OH)_{2} + 2Fe(NO_{3})_{3} = 3Ba(NO_{3})_{2} + 2Fe(OH)_{3}↓$
$3Ba^{2+} + 6OH^{-} + 2Fe^{3+} + 6NO^{3-} = 3Ba^{2+} + 6NO^{3-} + 2Fe(OH)_{3}↓$
$Fe^{3+} + 3OH^{-} = Fe(OH)_{3}↓ $
е) $KOH + NaNO_{3} ⇄ NaOH + KNO_{3}$
Реакция обратимая т. к. не образуется вода, не выделяется газ, не выпадает осадок.
ж) $ Mg(OH)_{2} + FeO$ ⇸
Реакция не идет, т. к. гидроксиды металлов не взаимодействуют с оксидами металлов
з) $2CuOH \overset{t}{=} Cu_{2}O + H_{2}O$
4. Вычислите объём аммиака (н.у.), который выделится при взаимодействии нитрата аммония массой 890 г, содержащего 20% примесей, с раствором гидроксида натрия. Какая масса 20%−го раствора щёлочи потребуется для реакции?
Ответ:
Дано:
m ($NH_{4}NO_{3}$ + присмеси) = 890 г;
ω (примеси) = 20 %;
ω (NaOH) = 20 %;
_____________
V ($NH_{3}$) − ?
$m_{р-ра}(NaOH)$ − ?
Решение:
$NH_{4}NO_{3} + NaOH = NaNO_{3} + H_{2}O + NH_{3}$ ↑;
$ω(NH_{4}NO_{3}) = 100 − ω (примеси) = 100 − 20 = 80$ % или 0,8;
m (вещ−во) = m (р−ра) * ω;
$m (NH_{4}NO_{3}) = m (NH_{4}NO_{3} + примеси) * ω (NH_{4}NO_{3}) = 890 * 0,8 = 712$ г;
$n = \frac{m}{M}$;
M ($NH_{4}NO_{3}$) = 1 * Ar (N) + 4 * Ar (H) + 1 * Ar (N) + 3 * Ar (O) = 1 * 14 + 4 * 1 + 1 * 14 + 3 * 16 = 80 г/моль;
$n (NH_{4}NO_{3}) = \frac{m (NH_{4}NO_{3})}{M(NH_{4}NO_{3})} = \frac{712}{80} = 8,9$ моль;
Запишем уравнение реакции и составим пропорции:
$\underset{1 моль}{\overset{8,9 моль}{NH_{4}NO_{3}}} + \underset{1 моль}{\overset{x}{NaOH}} =NaNO_{3} + H_{2}O+ \underset{1 моль}{\overset{y}{NH_{3}}}↑$;
$x = n (NaOH) = \frac{8,9 * 1}{1} = 8,9 $ моль;
$y = n (NH_{3}) = \frac{8,9 * 1}{1} = 8,9 $ моль;
$V = V_{m} * n$;
$V_{m}$= 22,4 л/моль;
$V (NH_{3}) = V_{m} * n (NH_{3}) = 22,4 * 8,9 = 199,36 $ л.
m = n * M;
M (NaOH) = 1 * Ar (Nа) + 1 * Ar (O) + 1 * Ar (H) = 1 * 23 + 1 * 16 + 1 * 1 = 40 г/моль;
m (NaOH) = n (NaOH) * M (NaOH) = 8,9 * 40 = 356 г;
$ m (р-р) =\frac{m (в-во)}{ω (вещ-во)}$
$m_{р-ра}(NaOH) = \frac{m (NaOH)}{ω (NaOH)} = \frac{356}{20} * 100% = 1780$ г = 1,78 кг.
Ответ. 199,36 л; 1,78 кг.
5. Запишите формулы оксидов, которые соответствуют гидроксидам: $Cu(OH)_{2}, CuOH, Fe(OH)_{2}, NaOH$.
Назовите все вещества
Ответ:
Гидроксид Оксид
$Cu(OH)_{2}$ − гидроксид меди (II) CuO − оксид меди (II)
CuOH − гидроксид меди (I) $Cu_{2}O$ − оксид меди (I)
$Fe(OH)_{2}$ − гидроксид железа (II) FeO − оксид железа (II)
NaOH − гидроксид натрия $Na_{2}O$ − оксид натрия
6. Составьте уравнения реакций, характеризующих химические свойства:
а) гидроксида калия;
б) гидроксида железа (II).
Ответ:
а) Гидроксид калия KOH − сильное основание, щелочь.
1) реакция с кислотным оксидом (образуется соль):
$2KOH + SO_{2} ⟶ K_{2}SO_{3} + H_{2}O $
2) реакция с кислотой. При добавлении соляной кислоты протекает реакция нейтрализации, ионы $Н^{-}$ связываются с ионами $H^{+}$, образуя воду.
$KOH + HCl ⟶ KCl + H_{2}O $
3) обменная реакция с солью (образуется осадок или газ):
$2KOH + CuSO_{4} ⟶ K_{2}SO_{4} + Cu(OH)_{2}↓ $
4) при добавлении к гидроксиду калия фенолфталеин раствор окрашивается в малиновый цвет, указывая на наличие $ОН^{-}$ ионов и щелочную среду:
$KOH ⟶ K^{+} + OH^{-}$
б) Гидроксид железа (II) $Fe(OH)_{2}$ – слабое основание, щелочь
1) реакция с кислотным оксидом:
$3Fe(OH)_{2} + P_{2}O_{5} ⟶ Fe_{3}(PO_{4})_{2} + 3H_{2}O $
2) реакция с кислотой:
$Fe(OH)_{2} + H_{2}SO_{4} ⟶ FeSO_{4} + 2H_{2}O $
3) обменная реакция с солью:
$Fe(OH)_{2} + CuSO_{4} ⟶ FeSO_{4} + Cu(OH)_{2} $
4) разложение при нагревании:
$Fe(OH)_{2} \overset{t}{⟶} FeO + H_{2}O$
5) со временем светло−зеленый осадок $Fe(OH)_{2}$ темнеет, так как в присутствии кислорода происходит окисление железа до степени окисления +3:
$4Fe(OH)_{2} ⟶ FeO + H_{2}O$

