Ответы к §37. Основные положения теории электролитической диссоциации
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. https://ido.tsu.ru/schools/chem/data/res/chemfor/uchpos/text/g173.html
2.https://www.yaklass.ru/p/himija/89−klass/rastvory−58606/elektrolity−i−neelektrolity−88879/re−0bb77687−93a2−4244−8af4−54a10510db05
3. https://stepik.org/lesson/340920/step/3?unit=324488
4. https://www.calc.ru/Kisloty−Soli−I−Osnovaniya−V−Teorii−Elektroliticheskoy−Dissot.html
2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Кислоты, основания и соли в свете теории электролитической диссоциации
С позиций теории электролитической диссоциации к кислотам относятся
вещества, способные диссоциировать в растворе с образованием ионов водорода, а к основаниям − вещества, которые при диссоциации дают гидроксид−ионы.
Наличие в молекулах кислот ионов водорода определяет важнейшие общие
свойства этого класса соединений:
1. Способность взаимодействовать с основаниями с образованием солей.
2. Способность выделять водород при взаимодействии с активными
металлами (Zn, Fe, Mg, AI и др.).
3. Изменение окраски индикаторов.
4. Кислый вкус.
Сильные кислоты полностью диссоциированы на ионы. Слабые кислоты диссоциируют частично: Слабые многоосновные кислоты диссоциируют ступенчато:
Наличие в молекулах оснований гидроксид−ионов обусловливают следующие общие свойства этих соединений:
1. способность взаимодействовать с кислотами с образованием солей;
2. водные растворы оснований изменяют окраску индикаторов;
3. растворы оснований имеют горький вкус и скользкие на ощупь.
Щелочи диссоциируют в водных растворах полностью. Слабые основания диссоциируют частично. Слабые многокислотные основания диссоциируют ступенчато:
В растворах многоосновных кислот, а также оснований, содержащих
несколько гидроксильных групп, устанавливаются ступенчатые равновесия,
отвечающие последовательным стадиям диссоциации.
Соли диссоциируют с образованием катионов металла и анионов кислотного остатка:
При растворении кислых солей в растворе образуются катионы металла, сложные анионы кислотного остатка, а также ионы, являющиеся продуктами диссоциации этого сложного кислотного остатка, в том числе ионы.
?. Вопросы и задания
1. Сравните по строению и свойствам:
а) $Ca^{0}$ и $Ca^{2+}$;
б) $Cu^{2+}_{гидр}$ и $Cu^{2+}_{негидр}$;
в) $H^{0}_{2}$ и $H^{+}$.
Ответ:
а) $Ca^{0}$ − атомы металла кальция, серебристо−белого цвета. На внешнем уровне содержит два электрона, которые участвуют в образовании металлической химической связи. Металл кальций имеет металлическую кристаллическую решётку. Легко взаимодействует с водой с образованием иона $Ca^{2+}$.
Са +20 $)_{2})_{8})_{8})_{2}$
$_{20}Ca^{0}$
$1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}4s^{2}$
$Ca^{2+}$ − ион (катион). На внешнем уровне не содержит электронов. Существует в соединениях (белого цвета) и в растворах (бесцветные) в виде ионов. Соединения $Ca^{2+}$ в большинстве имеют ионную кристаллическую решётку.
$Ca^{2+}$ +20 $)_{2})_{8})_{8}$
$_{20}Ca^{2+}$
$1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}4s^{0}$
б) $Cu^{2+}_{гидр}$ − катион голубого цвета в соединениях и растворе.
$Cu^{2+}_{негидр}$ − катион, бесцветный в соединениях, не связан с молекулами воды.
$Cu^{2+}_{гидр}$ и $Cu^{2+}_{негидр}$ имеют одинаковое электронное строение, однако, ионы $Cu^{2+}_{негидр}$ окружены диполями воды.
$Cu^{2+}$ +29 $)_{2})_{8})_{17}$
$_{29}Cu^{2+}$
$1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{9}4s^{0}$
в) $H^{0}_{2}$ − простое вещество, газ без цвета и запаха, легче воздуха. Имеет неполярную ковалентную связь.
$H^{+}$ − катион, существует в соединениях и растворах, придавая кислотную среду растворам, окрашивая индикаторы в соответствующий цвет. В его электронной оболочке нет электронов, он представляет собой положительно заряженное ядро.
$_{1}H^{+}$ $1s^{0}$
2. Используя таблицу растворимости, приведите примеры пяти веществ, которые в растворах образуют сульфат−ионы $SO^{2-}_4$. Запишите уравнения электролитической диссоциации этих веществ.
Таблица.
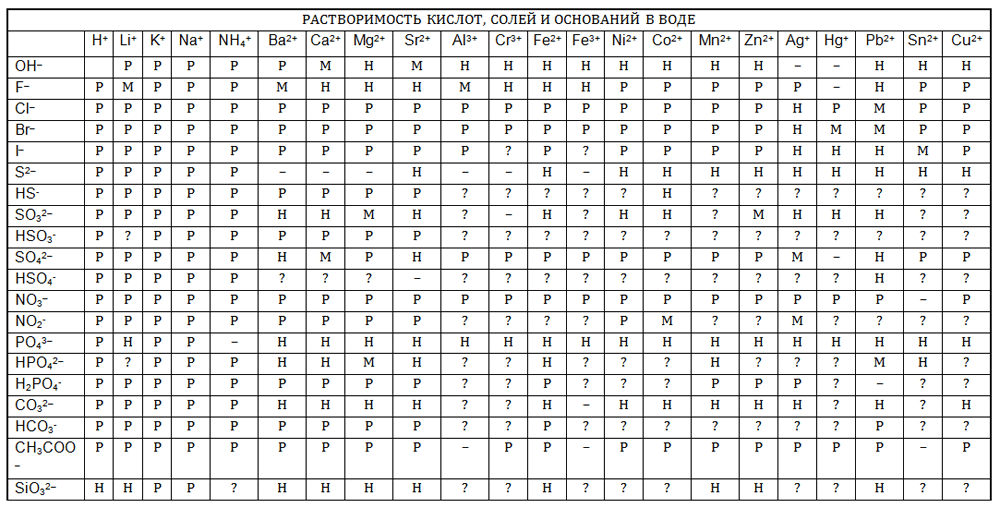
Ответ:
Серная кислота $H_{2}SO_{4} = 2H^{+} + SO_{4}^{2-}$.
Сульфат лития $Li_{2}SO_{4} = 2Li^{+} + SO_{4}^{2-}$.
Сульфат натрия $Na_{2}SO_{4} = 2Na^{+} + SO_{4}^{2-}$.
Сульфат калия $K_{2}SO_{4} = 2K^{+} + SO_{4}^{2-}$.
Сульфат магния $MgSO_{4} = Mg^{2+} + SO_{4}^{2-}$.
3. Какую информацию несёт в себе следующее уравнение:
$Al(NO_{3})_{3}= Al^{3+} + 3NO^{-}_{3}$?
Дайте названия вещества и ионов.
Ответ:
$\underset {нитрат\;алюминия}{Al(NO_{3})_{3}}= \underset {катион\;алюминия}{Al^{3+}} + \underset{нитрат-анион}{3NO^{-}_{3}}$.
Уравнение показывает, что нитрат алюминия диссоциирует на катион алюминия ($Al^{3+}$) и 3 нитрата−аниона ($NO^{3-}$).
4. Запишите уравнения диссоциации: сульфата железа (III), карбоната калия, сульфата аммония, нитрата меди (II), гидроксида бария, соляной кислоты, гидроксида калия, хлорида железа (II). Дайте названия ионов.
Ответ:
$\underset {cульфат\;железа (III)} {Fe_{2}(SO_{4})_{3}} ⇄ \underset {катион\;железа\;(III)}{2Fe^{3+}}+\underset {сульфат-анион}{3SO_{2}^{−4}}$.
$\underset {карбонат\;калия} {K_{2}CO_{3}}⇄\underset {катион\;калия}{2K+}+\underset{карбонат-анион} {CO^{2−}_{3}}$.
$\underset {сульфат\;аммония} {(NH_{4})_{3}PO_{4}}⇄\underset {катион\;аммония} {3NH_{4}^{+}}+\underset {фосфат-анион}{PO_{3}^{-4}}$.
$\underset {нитрат\;меди (II) } {Cu(NO_{3})_{2} }⇄\underset {катион\;меди\;(II)} {Cu^{2+}}+\underset {нитрат-анион}2NO^{−3}$.
$\underset {гидроксида\;бария } {Ba(OH)_{2}}⇄\underset {катион\;бария}{Ba^{2+}} +\underset {гидроксид-анион}{2OH^{-}}$.
$\underset {соляная\;кислота}{ HCl}⇄\underset {катион\;водорода}{H^{+}}+\underset {хлорид-анион}{Cl^{−}}$.
$\underset {гидроксид\;калия} {KOH}⇄\underset {катион\;калия}{K^{+}}+\underset {гидроксид-анион}{OH^{−}}$.
$\underset {хлорид\;железа\;(II) } {FeCl_{2}}⇄\underset{катион\;железа\;(II)}{Fe^{2^+}} +\underset {хлорид-анион}{2Cl^{−}}$.
5. Для каких из перечисленных ниже веществ можно записать уравнения диссоциации: гидроксид железа (II), гидроксид калия, кремниевая кислота, азотная кислота, оксид серы (IV), оксид кремния (IV), сульфид натрия, сульфид железа (II), серная кислота? Почему? Запишите возможные уравнения диссоциации.
Ответ:
Диссоциировать на ионы будут электролиты, растворимые в воде.
$Fe(OH)_{2}$ ⇸ – гидроксид железа (II) – слабое основание, не растворим, поэтому не диссоциирует.
$KOH = K^{+} + OH^{-}$ – гидроксид калия – щелочь.
$H_{2}SiO_{3}$ ≠ – кремниевая кислота – слабая кислота, не растворима, поэтому не диссоциирует.
$HNO_{3} = H^{+} + NO_{3}^{-}$ – азотная кислота – сильная кислота.
$SO_{2} + Н_{2}O = H_{2}SO_{3}$ – оксид серы (IV), растворим в воде с образованием сернистой кислоты, которая диссоциирует.
$H_{2}SO_{3} = 2H^{+} + SO_{3}^{2-}$
$SiO_{2}$ ≠ – оксид кремния (IV) – неэлектролит.
$Na_{2}S = 2Na^{+} + S^{2-}$ – сульфид натрия – растворимая соль сильного основания и слабой кислоты.
FeS ≠ – сульфид железа (II) – нерастворимая соль слабого основания и слабой кислоты, поэтому не диссоциирует.
$H_{2}SO_{4} = 2H^{+} + SO_{4}^{2-} $ – серная кислота – сильная кислота.
6. В записи уравнений ступенчатой диссоциации серной кислоты для первой ступени используют знак равенства, а для второй — знак обратимости. Почему?
Ответ:
Серная кислота − сильный электролит, по первой ступени она диссоциирует практически полностью.
$H_{2}SO_{4} = H^{+} + HSO_{4}^{-}$.
Диссоциация по второй ступени проходит намного слабее, чем по первой, процесс обратим.
$HSO_{4}^{-} ⇄ H^{+} + SO_{4}^{2-}$.

