§35. Оксиды углерода.
1. Одна из пробирок наполнена азотом, а другая – углекислым газом. Как распознать эти газы?
Ответ:
Необходимо в обе пробирки прилить известковую воду, в пробирке с углекислым газом будет наблюдаться помутнение раствора:
Ca(OH)2↓ + CO2 = CaCO3 + H2O
2. Рассмотрите с электронной точки зрения процесс образования молекулы оксида углерода (II) и ионов аммония и гидроксония. Что общего в этих процессах?
Ответ:
Молекула оксида углерода (II) обязуется за счет образования четырёх общих электронных пар между одним атомом углерода и двумя атомами кислорода:
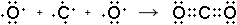
Ион аммония образуется в результате возникновения ковалентной связи между атомом азота, имеющим неподелённую электронную пару, и катионом водорода:

Ион гидроксония образуется аналогично иону аммония.
Общее в данных процессах то, что образуется ковалентная связь за счёт обобществления электронных пар, разница состоит в механизмах образования связей, в оксида углерода (II) он обменный, а в ионах аммония и гидроксония – донорно-акцепторный.
3. Сокращённому ионному уравнению CO2 + 2OH- = H2O + CO32- соответствует химическая реакция между
1) соляной кислотой и карбонатом кальция
2) гидроксидом натрия и оксидом углерода (IV)
3) кремниевой кислотой и карбонатом калия 4) карбонатом натрия и оксидом кремния (IV)
Ответ:
2) гидроксидом натрия и оксидом углерода (IV):
2NaOH + CO2 = H2O + Na2CO3
4. В промышленности оксид углерода (IV) получают
1) обжигом известняка
2) разложением пищевой соды
3) окислением сероуглерода
4) сухой перегонкой дерева
Ответ:
1) обжигом известняка
5. Запишите уравнения реакций взаимодействия оксида углерода (II): а) с WO3; б) с Fe2O3; в) с PbO. Укажите восстановитель, окислитель.
Ответ:
а) 3CO + WO3 ⟶ W + 3CO2
| C+2 - 2ē ⟶ C+4 | |2| | 6 | |3 | восстановитель |
| W+6 + 6ē ⟶ W0 | |6| | |1 | окислитель |
б) 3CO + Fe2O3 ⟶ 2Fe + 3CO2
| C+2 - 2ē ⟶ C+4 | |2| | 6 | |3 | восстановитель |
| Fe+3 + 3ē ⟶ Fe0 | |3| | |2 | окислитель |
в) CO + PbO ⟶ Pb + CO2
| C+2 - 2ē ⟶ C+4 | |2| | 2 | |1 | восстановитель |
| Pb+2 + 2ē ⟶ Fe0 | |2| | |1 | окислитель |
6. Для каких целей применяется «сухой лёд»? В чём его преимущество по сравнению с обычным льдом?
Ответ:
Сухой лёд используется как источник холода для охлаждения пищевых продуктов (например, мороженого) при их транспортировке и хранении без использования холодильных установок. Может быть использован для шоковой заморозки продуктов и лабораторных образцов, газирования напитков, изготовления мороженого, предотвращения таяния ледяных скульптур и так далее.
Сухой лёд, по сравнению с обычным льдом, имеет более низкую температуру, и при таяние не оставляет следов воды.
7. На космическом корабле поглощение оксида углерода (IV) осуществляется сухим гидроксидом лития. Какой объём (л) оксида углерода (IV) (н. у.) поглотится, если в результате реакции образуется 7,4 кг карбоната лития?
Ответ:
Дано:
`m(Li_2CO_3) = 7.4" кг"`
`V(CO_2) = ?`
Решение
`2LiOH + CO_2 = Li_2CO_3 + H_2O`
`n(Li_2CO_3) = (m(Li_2CO_3))/(M(Li_2CO_3)) = 7.4/74 = 0.1" кмоль"`
`n(CO_2) = n(Li_2CO_3) = 0.1" кмоль"`
`V(CO_2) = n(CO_2)*V_m = 0.1*22.4 = 2.24 м^3`
Ответ: `V(CO_2) = 2.24 м^3`.

