§11 Классификация веществ
Вопросы перед параграфом
Задание №1
Как классифицируют вещества по составу?
Ответ
Схема. Классификация веществ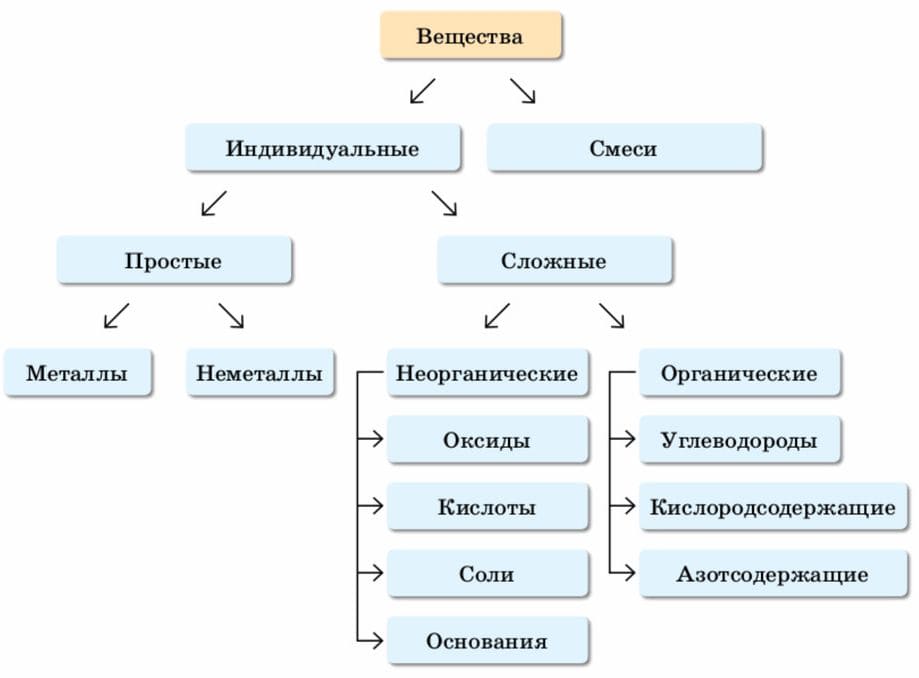
Вещества по составу делят на индивидуальные (чистые) и смеси.
Индивидуальное вещество имеет постоянный состав и характеризуется единственной химической формулой.
В состав смеси входит не менее двух веществ, причём состав смеси может быть переменным.
Задание №2
Каковы основные классы неорганических веществ?
Ответ
Основные классы неорганических веществ:
1/) Оксиды.
2) Кислоты.
3) Соли.
4) Основания.
(стр.72)
Задание №1
Проведём опыт. Налейте в стакан или чашку столовый уксус и опустите туда мел. Что наблюдаете? Растворился ли мел полностью? Можно ли на основании опыта решить, является школьный мел чистым веществом или смесью?
Ответ
Ход работы:
В стакан налили немного уксуса. Мы положили туда мелок. Уксус сильно забурлил. Затем от мела начали откалываться небольшие кусочки. Мел состоит из известняка, который при взаимодействии с кислотой разрушается и выделяется углекислый газ, что мы и увидели при проведении опыта. При взаимодействии уксуса с мелом в ходе реакции выпал осадок.
Вывод: Мел, который продаётся в магазинах не является чистым веществом, так как весь известняк ($CaCO_{3}$) растворился в уксусной кислоте, а сульфат кальция ($CaSO_{4}$) выпал в осадок.
(стр.72)
Задание №1
Какие ещё из известных вам веществ представляют собой смеси?
Ответ
Смеси:
1) Молоко.
2) Гранит.
3) Бензин.
4) Помада.
(стр.75)
Задание №1
Раздел «Занимательные опыты». Для знакомства со способами получения оксидов выполните опыты 2 и 3 (с. 178, 179).
Ответ
Опыт 2. Горение магния.
Возьмите пинцетом кусок магниевой стружки так, чтобы основная часть стружки торчала наружу. Опыт проводите на чистом столе над металлическим противнем с песком. Рядом с противнем на столе поместите подставку под горючее, на неё положите одну таблетку сухого топлива и подожгите её спичкой. Внесите в верхнюю часть пламени магниевую ленту. Как только она загорится, расположите руку с держателем над противнем. Когда лента сгорит и держатель остынет, рассмотрите белый порошок, образовавшийся при горении магния. Это жжёная магнезия − оксид магния MgO. Её добавляют в состав некоторых кремов и мазей. Опыт эффектно наблюдать в темноте. Попробуйте провести его вечером на открытом воздухе.

Опыт 3. Окисление меди.
Возьмите пинцетом медную фольгу и внесите её в пламя спиртовки. В отличие от магния, медь не горит на воздухе, а медленно окисляется, покрываясь чёрным налётом оксида меди. Это говорит о том, что медь − малоактивный металл. Есть и ещё менее активные металлы, такие как золото и серебро. Они кислородом воздуха вообще не окисляются. Медную фольгу, покрытую оксидом меди, оставьте для следующего опыта, поместив её в чашку Петри.

(стр.75)
Задание №1
Какие элементы имеют несколько оксидов? Приведите примеры.
Ответ
1) Сера: $SO_{2}$ (оксид серы IV) и $SO_{3}$ (оксид серы VI)
2) Железо: $FeO$ (оксид железа II) и $Fe_{2}O_{3}$ (оксид железа III)
3) Хром: $Cr_{2}O_{3}$ (оксид хрома III), $CrO_{3}$ (оксид хрома VI) и $CrO$ (оксид хрома II)
4) Углерод: $CO$ (угарный газ, оксид углерода II) и $CO_{2}$ (углекислый газ, оксид углерода IV)
5) Азот: $NO$ (оксид азота II), $NO_{2}$ (оксид азота IV) и $N_{2}O_{5}$ (оксид азота V)
(стр.76)
Задание №1
Используя информационные ресурсы, назовите кислоты, которые присутствуют в организме человека.
Ответ
В организме человека присутствуют:
1) Аскорбиновая кислота − витамин.
2) Фолиевая кислота − витамин.
3) Оротовая кислота − витамин.
4) Никотиновая кислота − витамин.
5) Соляная кислота − находится в желудке.
6) Молочная кислота − образуется в мышцах.
(стр.76)
Задание №1
Многие органические кислоты имеют названия, связанные с источником их получения. Найдите в литературе и запишите формулы следующих кислот: муравьиная, щавелевая, уксусная, молочная, лимонная, яблочная, винная. Как называются соли этих кислот?
Ответ
1) Муравьиная кислота − HCOOH
Формиаты − соли муравьиной кислоты.
2) Щавелевая кислота − HOOC−COOH
Оксалаты − соли щавелевой кислоты.
3) Уксусная кислота − $CH_{3}COOH$
Ацетаты − соли уксусной кислоты.
4) Молочная кислота − $C_{3}H_{6}O_{3}$
Лактаты − соли молочной кислоты.
5) Лимонная кислота − $C_{6}H_{8}O_{7}$
Цитраты − соли лимонной кислоты.
6) Яблочная кислота − $C_{4}H_{6}O_{5}$
Малаты − соли яблочной кислоты.
7) Винная кислота − $C_{4}H_{6}O_{6}$
Тартраты − соли винной кислоты.
(стр.77)
Задание №1
Раздел «Занимательные опыты». Взаимодействие кислот с металлами изучается в опыте 4 (с. 179).
Ответ
Опыт 4. Растворяем металлы в кислотах.
В четыре пробирки поместите кусочек магниевой стружки, гранулу цинка, порошок железа, медную фольгу. В каждую пробирку прилейте по 1 мл соляной кислоты. В каких пробирках происходит выделение газа? Расположите пробирки в штативе так, чтобы скорость выделения газа уменьшалась слева направо. Чем сильнее выделяется газ, тем активнее металл. Газ, который образуется, − водород. Символ водорода вместе с символами металлов помещают в ряд активности металлов. Чем активнее металл, тем левее в ряду расположен символ. Данный металл способен вытеснить все металлы, стоящие в ряду активности правее него, из растворов их солей. Водород вытесняют из кислот лишь металлы, расположенные левее водорода. На основании опыта составьте ряд активности, включив в него четыре взятых вами металла и водород.
Выделение газа происходит во всех пробирка, кроме пробирки с медной фольгой.
Ряд активности на основании опыта:
Mg − Zn − Fe − H − Cu
(стр.78)
Задание №1
Получение известковой воды.
Проведём опыт. Купите в аптеке растворы хлорида кальция и нашатырный спирт. Налейте раствор хлорида кальция в стакан и добавляйте к нему по каплям нашатырный спирт, пока не образуется белая взвесь. Дайте взвеси отстояться. Затем аккуратно слейте прозрачный раствор в другой стакан и нагрейте до кипения. Этот раствор и есть известковая вода. С другим способом получения известковой воды можно познакомиться в разделе «Занимательные опыты» (опыт 1, с. 177)
Ответ

Опыт 1. Приготовление известковой воды.
Для растворения твёрдых веществ будем использовать дистиллированную воду. Такая вода, в отличие от водопроводной, не содержит растворённых солей. Чтобы отмерить необходимое количество воды, надо внимательно смотреть на деления, отмеченные на стакане. Известковой водой называют раствор гашёной извести. Научное название этого соединения − гидроксид кальция $Ca(OH)_{2}$. Поместите два шпателя порошка этого вещества в стакан. Прилейте в стакан 50 мл дистиллированной воды (по делениям на стакане) и хорошо перемешайте стеклянной палочкой. Получился раствор, по внешнему виду похожий на молоко. Его так и называют − известковое молоко. Напоминаем, что пробовать на вкус известковое молоко, как и другие вещества, категорически запрещено! Раствор стал похожим на молоко из−за того, что содержит муть − мелкие частички нерастворившегося гидроксида кальция. Их отделяют, пропуская раствор через фильтр. Способ изготовления фильтра описан в § 14. Воронку с фильтром помещают в стакан. Теперь всё готово к фильтрованию. Для отделения мути используем приготовленный фильтр. С помощью стеклянной палочки прильём мутный раствор на фильтр. Не нужно пытаться сразу перелить на фильтр весь раствор из стакана. Лучше подождать, пока уровень жидкости в воронке понизится, после этого вновь долить в воронку мутный раствор. Обратите внимание, что из воронки капает на дно стакана прозрачный раствор. Его надо сразу же после фильтрования перенести в пустую склянку, приклеив к ней этикетку «Известковая вода».
Задание №2
Раздел «Занимательные опыты». Для знакомства со способами получения и химическими свойствами щелочей выполните опыты 9−11 (с. 181 − 182).
Ответ
Опыт 9. «Розовое молоко».
В пробирку внесём один шпатель порошка гидроксида кальция, добавим 2 мл воды и перемешаем. Получится белая жидкость, похожая на молоко. Добавим в него одну−две капли фенолфталеина − «молоко» станет розовым. Сохраните этот раствор для следующего опыта.
Опыт 10. «Розовое молоко» опять становится прозрачным.
Возьмите пробирку с «розовым молоком», оставшуюся после проведения опыта 9. Внесите в неё 1 мл раствора уксусной кислоты и перемешайте. Что произошло с «молоком»? Оно стало бесцветным и прозрачным. А как нам вернуть раствору розовый цвет? Попробуйте догадаться сами и проверьте свои догадки экспериментально.
Чтобы вернуть окраску раствора ("молока") в розовый необходимо к нему прилить еще известковой воды.
Опыт 11. Известковая вода мутнеет.
Налейте в пробирку 2 мл известковой воды (её мы приготовили в опыте 1), опустите в пробирку соломинку для коктейля или стеклянную трубку и ртом выдувайте воздух (не перепутайте − воздух надо выдувать, а не втягивать, как это происходит, когда вы пьёте коктейль). Как только известковая вода помутнеет, прекратите дуть. Образующаяся муть − это осадок карбоната кальция (мела). Дождитесь, когда осадок опустится на дно и отделится от раствора. Затем с помощью стеклянной палочки аккуратно отберите жидкость над осадком и перенесите её в другую пробирку. Определите рН этой жидкости, пользуясь универсальным индикатором. Какую реакцию среды имеет раствор?
Раствор показывает реакцию щелочной среды.
К осадку прилейте несколько капель соляной кислоты. Выделяющиеся пузыри − это углекислый газ.
§11. проблемный вопрос
Задание №1
Какие признаки, кроме строения и состава, могут быть положены в основу классификации химических веществ?
Ответ
В основе классификации химический веществ могут быть положены их свойства.
Например: металлы и неметаллы; кислотные, основные и амфотерные оксиды.
§11. вопросы и задания
Задание №1
Назовите хотя бы одно индивидуальное вещество в окружающем мире. Какова его формула?
Ответ
Индивидуальные вещества в окружающем мире:
1) Карбонат натрия (мел) − $CaCO_{3}$.
2) Хлорид натрия (соль) − NaCl.
3) Гелий − He.
Задание №2
Почему простых веществ известно в несколько раз больше, чем химических элементов?
Ответ
Многие химические элементы образуют не одно, а несколько простых веществ.
Примеры: Химический элемент кислород образует два простых вещества: кислород и озон, а химический элемент углерод − несколько простых веществ: алмаз, графит, фуллерен.
Задание №3
Почему сложных веществ известно во много раз больше, чем простых?
Ответ
Атомы химических элементов соединяются между собой в самых разнообразных сочетаниях и количественных соотношениях. Очевидно, что таких сочетаний образуется значительно больше из атомов различных химических элементов сложного вещества, чем из атомов одного химического элемента простого вещества.
Задание №4
Оксидами каких элементов являются: вода, ржавчина, углекислый газ, глинозём, магнитный железняк, негашёная известь?
Ответ
Вода является оксидом водорода, ржавчина − это оксид железа, углекислый газ − оксид углерода, глинозём − оксид алюминия, магнитный железняк − оксид железа, негашёная известь − оксид кальция.
Задание №5
Приведите примеры кислот, используемых в быту. Какие из них относятся к органическим, а какие — к неорганическим?
Ответ
Уксусная кислота, лимонная кислота, щавелевая кислота, аскорбиновая кислота, ацетилсалициловая кислота − органические кислоты.
Фосфорная кислота, борная кислота − неорганические кислоты.
Задание №6
Как вы думаете, можно ли считать воду кислотой? Попадает ли она под определение кислот?
Ответ
Кислоты − это сложные вещества, состоящие из атомов водорода, которые могут замещаться на атомы металла, и кислотных остатков.
Но ведь и вода содержит атомы водорода, которые могут замещаться атомами металла:
2$H_{2}O$ + 2Na = 2NaOH + $H_{2}$
Значит, воду можно отнести к кислотам, так как она подходит под определение. Но вот другое определение кислот (более точное):
кислотой является водородсодержащее соединение, водный раствор которого обладает следующими свойствами: проводит электрический ток, при реакции с металлическим цинком выделяет водород, окрашивает лакмус в красный цвет, имеет кислый вкус.
Вода под это определение не подходит.
Задание №7
Определите по названиям, какие из перечисленных веществ относятся к солям: сульфат магния (английская соль), оксид железа (III), гидрокарбонат натрия (питьевая сода), лимонная кислота, глюконат кальция.
Ответ
К солям относятся: сульфат магния, гидрокарбонат натрия, глюконат кальция.
Оксид железа (III) − относится к оксидам.
Лимонная кислота − относится к кислотам.
Задание №8
Выясните из курса биологии, какие соли входят в состав организма человека.
Ответ
В состав организма человека входят хлорид натрия и фосфат кальция.

