§19 Углекислый газ
Вопросы перед параграфом
Задание №1
Каковы свойства углекислого газа?
Ответ
Физические свойства:
Углекислый газ — бесцветный, он не имеет запаха, но обладает кисловатым вкусом. Углекислый газ примерно в 1,5 раза тяжелее воздуха. Углекислый газ умеренно растворим в воде — примерно 1:1 по объёму при температуре 25°С. Однако эту растворимость можно заметно увеличить при повышении давления.
Химические свойства:
С химической точки зрения углекислый газ — довольно инертное и безопасное вещество. Он является продуктом горения и сам горения не поддерживает.
Задание №2
Как в природе образуется $CO_{2}$ и во что он превращается?
Ответ
Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений.
Задание №3
Опасен ли углекислый газ для человека?
Ответ
Углекислый газ сам по себе не ядовит, однако, так как он не поддерживает дыхания, находиться в атмосфере с повышенным его содержанием небезопасно (табл. 8). При длительном нахождении в помещении необходимо время от времени его проветривать. Однако все неприятные явления, вызванные избыточным содержанием $CO_{2}$, обратимы и исчезают на свежем воздухе.
Таблица 8. Допустимое время нахождения в атмосфере с повышенным содержанием углекислого газа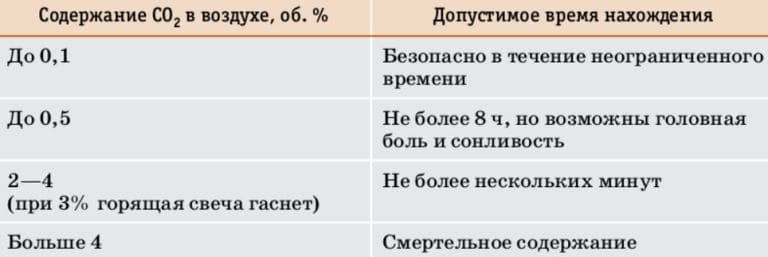
(стр.123)
Задание №1
Формула этилена − $C_{2}H_{4}$. Напишите уравнение горения этого газа в кислороде.
Ответ
При горении этилена в кислороде выделяется углекислый газ и вода:
$C_{2}H_{4}$ + 3$O_{2}$= 2$CO_{2}$ + 2$H_{2}O$
(стр.124)
Задание №1
Проведём опыт. Приобрести «сухой лёд» можно у продавцов мороженого или заказать с доставкой по интернету. Для опытов нужно небольшое количество вещества.
1. Поместите немного «сухого льда» внутрь воздушного шарика и завяжите шарик. Наблюдайте за изменением объёма. Можете измерить, при каком исходном количестве льда шарик лопнет.
Ответ
Со временем объём шарика увеличится, так как будет выделятся углекислый газ, который будет наполнять шар. Если поместить в шарик слишком много «сухого льда», то он лопнет.
Задание №2
Проведём опыт. Приобрести «сухой лёд» можно у продавцов мороженого или заказать с доставкой по интернету. Для опытов нужно небольшое количество вещества.
2. Опустите кусок «сухого льда» в горячую воду, содержащую мыльный раствор. Опишите происходящие изменения.
Ответ
Когда вы бросаете кусочек «сухого льда» в миску с мыльной водой, то выделяется газ. Тонкий слой мыльной пленки, натянутой по краю чаши, задерживает выделяющийся газ, создавая большой мыльный пузырь.
(стр.125)
Задание №1
Раздел «Занимательные опыты». Со свойствами углекислого газа можно познакомиться в опыте 7 (с.180−181).
Ответ
Опыт 7. Изучаем газировку
Для опыта вам потребуется бутылка с газированной водой и с такой же водой, но без газа. Определите кислотность среды и сделайте вывод, как углекислый газ влияет на величину pH. Углекислый газ $CO_{2}$ − кислотный оксид, при взаимодействии с водой он образует слабую угольную кислоту. Налейте газированную воду в пробирку и прокипятите. Растворимость газов уменьшается при нагревании. При кипячении угольная кислота разложится, а углекислый газ улетит. Как изменится при этом pH раствора? Сделайте предположение и подкрепите его экспериментально.
Газированная вода имела кислотную среду, а вода без газа была с щелочной средой. После кипичения pH газированной воды увеличилось.
(стр.130)
Задание №1
Раздел «Занимательные опыты». Со свойствами известковой воды вы можете познакомиться, проделав опыты 11−14 (с.181−182).
Ответ
Опыт 11. Известковая вода мутнеет
Налейте в пробирку 2 мл известковой воды (её мы приготовили в опыте 1), опустите в пробирку соломинку для коктейля или стеклянную трубку и ртом выдувайте воздух (не перепутайте − воздух надо выдувать, а не втягивать, как это происходит, когда вы пьёте коктейль). Как только известковая вода помутнеет, прекратите дуть. Образующаяся муть − это осадок карбоната кальция (мела). Дождитесь, когда осадок опустится на дно и отделится от раствора. Затем с помощью стеклянной палочки аккуратно отберите жидкость над осадком и перенесите её в другую пробирку. Определите pH этой жидкости, пользуясь универсальным индикатором. Какую реакцию среды имеет раствор? Данный раствор имеет нейтральную среду.
К осадку прилейте несколько капель соляной кислоты. Выделяющиеся пузыри − это углекислый газ.
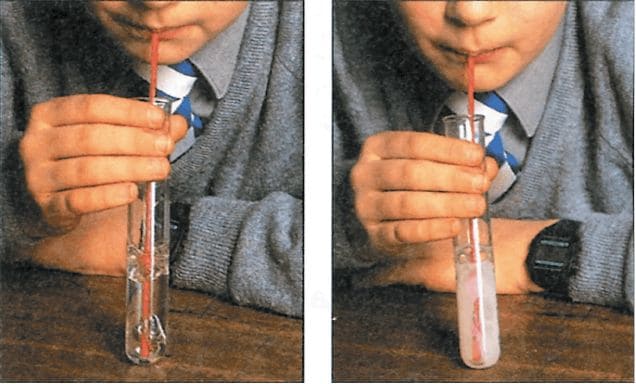
Опыт 12. Известковая вода сначала мутнеет, а потом становится прозрачной
Повторите начало предыдущего опыта. Налейте в пробирку 2 мл известковой воды (её мы приготовили в опыте 1), опустите в пробирку соломинку для коктейля или стеклянную трубку и ртом выдувайте воздух (не перепутайте − воздух надо выдувать, а не втягивать, как это про исходит, когда вы пьёте коктейль). Однако, когда известковая вода помутнеет, упорно продолжайте дуть. Через некоторое время муть растворится. Мел взаимодействует с избытком углекислого газа и водой с образованием другой соли − гидрокарбоната кальция. Полученный раствор гидрокарбоната кальция используйте для следующего опыта.
Опыт 13. Муть появляется снова и не исчезает
Поместите пробирку с раствором гидрокарбоната кальция в держатель и нагрейте её на пламени. Что наблюдаете?
При нагревании гидрокарбоната натрия выделяется водяной пар, углекислый газ и карбонат кальция.
$Ca(HCO_{3})_{2}$ = $CaCO_{3}$ + $H_{2}O$ + $CO_{2}$
Образующийся осадок − это мел (карбонат кальция).
Опыт 14. Опять выпадает мел
Повторите опыт 12, а к полученному прозрачному раствору добавьте известковую воду. Вы получите осадок мела уже при комнатной температуре.
§19. проблемный вопрос
Задание №1
Является ли повышенное содержание углекислого газа в атмосфере угрозой для человечества; проблемой?
Ответ
Сам по себе углекислый газ не вреден для окружающей среды. Наоборот, он является одним из главных элементов процесса жизнедеятельности растений. Они поглощают $CO_{2}$, перерабатывают его и выделяют в атмосферу кислород. Но если диоксида углерода становится слишком много, он начинает играть роль тепловой изоляции для планеты. Излучение Солнца свободно проходит через атмосферу, но вот обратно, в космос, уходит тем меньше тепловой энергии, чем больше парниковых газов в газовой оболочке Земли. Поверхность планеты начинает нагреваться. Тают льды, изменяются климат и видовой состав флоры и фауны.
Природа будет развиваться, эволюционировать и дальше, изменение климата − проблема, прежде всего, для человечества, которое тысячи лет живет в относительно комфортных условиях. Если уровень Мирового океана значительно изменится, начнутся катастрофы, проблемы будут не у отдельно взятых людей, а у целых государств.
§19. вопросы и задания
Задание №1
Горение древесины можно упрощённо описать схемой: $C_{6}H_{10}O_{5}$ + $O_{2}$ → $CO_{2}$ + $H_{2}O$. Расставьте коэффициенты и запишите уравнение реакции.
Ответ
При горении древесины образуется углекислый газ и вода:
$C_{6}H_{10}O_{5}$ + 6$O_{2}$ = 6$CO_{2}$ + 5$H_{2}O$
Задание №2
Составьте уравнение реакции сгорания глюкозы $C_{6}H_{12}O_{6}$ до углекислого газа и воды. Сравните с уравнением реакции сгорания древесины. Чем различаются эти уравнения и что в них общего?
Ответ
Сгорание глюкозы:
$C_{6}H_{12}O_{6}$ + 6$O_{2}$ = 6$CO_{2}$ + 6$H_{2}O$
Сгорание древесины:
$C_{6}H_{10}O_{5}$ + 6$O_{2}$ = 6$CO_{2}$ + 5$H_{2}O$
Уравнения различаются числом молекул воды: при сгорании 1 молекулы древесины образуется 5 молекул воды, а при сгорании 1 молекулы глюкозы − 6 молекул воды.
Общее в них то, что в результате реакции образуется углекислый газ и вода, причем в обоих случаях на 1 молекулу веществ расходуется 6 молекул кислорода и образуется 6 молекул углекислого газа.
Задание №3
Сколько весит молекула $CO_{2}$?
Ответ
Дано:
m (C) = 12 а.е.м.
m (O) = 16 а.е.м.
Найти:
m ($CO_{2}$) = ?
Решение:
m($CO_{2}$)= m (C) +2 * m(O) = 12 а.е.м. + 2 * 16 а.е.м. = 44 а.е.м.
Ответ: m ($CO_{2}$) = 44 а.е.м.
Задание №4
Как вы думаете, почему на экзамены и олимпиады не разрешают приносить газированную воду?
Ответ
При открытии бутылки с газированной водой выделяющийся углекислый газ увлекает за собой воду, которая может залить бланки.
Задание №5
Отличается ли по вкусу газированная питьевая вода от негазированной?
Ответ
Отличается, т.к. газированная питьевая вода на вкус немного кислая из−за того, что в ее растворе образуется неустойчивая угольная кислота:
$H_{2}O$ + $CO_{2}$ = $H_{2}CO_{3}$
Задание №6
Сколько литров углекислого газа содержится в $1м^3$ воздуха?
Ответ
Дано:
V(возд.) = $1м^3$ =1000 л
w($CO_{2}$) = 0,04%
Найти:
V($CO_{2}$) − ?
Решение:
V($CO_{2}$) = $\frac{w(CO_{2})\;* \;V(возд.)}{100}$ = $\frac{0,04\;*\;1000}{100}$ = 0,4 л
Ответ: V($CO_{2}$) = 0,4 л.
Задание №7
Какие парниковые газы, кроме $CO_{2}$, вы знаете? Если не знаете, найдите информацию в сети Интернет.
Ответ
Парниковый газ − это газ, который поглощает и излучает лучистую энергию в тепловом инфракрасном диапазоне, вызывая парниковый эффект.
Основными парниковыми газами в атмосфере Земли являются водяной пар ($H_{2}O$), углекислый газ ($CO_{2}$), метан ($CH_{4}$), закись азота ($N_{2}O$) и озон ($O_{3}$).
Задание №8
Назовите основную область применения углекислого газа.
Ответ
Углекислый газ является продуктом горения и сам горения не поддерживает. Именно поэтому его широко используют при тушении пожаров. Будучи тяжелее воздуха, $CO_{2}$ оседает на горящей поверхности и перекрывает доступ кислорода к ней. Горючие жидкости и электрические приборы нужно тушить только пеной с углекислым газом!
Задание №9
Каково безопасное содержание $CO_{2}$ в воздухе?
Ответ
Безопасное содержание $CO_{2}$ в воздухе − до 0,1% по объёму.
Таблица 8. Допустимое время нахождения в атмосфере с повышенным содержанием углекислого газа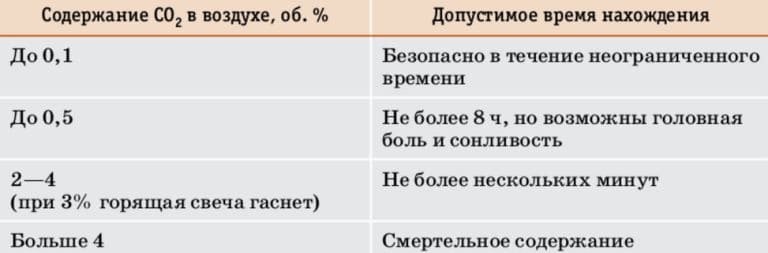
Задание №10
Назовите по два процесса, приводящих к выделению $CO_{2}$ в атмосферу и к его удалению из неё.
Ответ
Горение и дыхание ― процессы, приводящие к выделению $CO_{2}$ в атмосферу. Одна часть углекислого газа из атмосферы поглощается растениями и водорослями, превращаясь в процессе фотосинтеза в кислород, а другая часть ― растворяется в Мировом океане.
Задание №11
Какие из перечисленных ниже свойств соответствуют углекислому газу при обычных условиях?
1) легче воздуха
2) не поддерживает дыхания
3) не поддерживает горения
4) ядовит
5) нерастворим в воде
Ответ
При обычных условиях углекислый газ:
2) не поддерживает дыхания
3) не поддерживает горения
Задание №12
Придумайте свои эксперименты с «сухим льдом».
Ответ
Эксперимент №1.
1. Поместите в банку обычную свечку и подожгите.
2. Насыпьте по краям небольшое количество «сухого льда» – через пару секунд газ заполнит банку, и свечка потухнет.
3. Попытайтесь поджечь свечу заново – это невозможно, так как углекислый газ не горит, а кислорода в банке больше нет.
Эксперимент №2
1. Положите в глубокую и широкую кастрюлю кусочек «сухого льда» и подождите, пока она наполнится газом.
2. Надуйте обычные мыльные пузыри и пускайте их в кастрюлю – пузырики будут красиво, словно живые, парить и танцевать над газом.
Эксперимент №3
1. Приготовьте небольшую пластиковую бутылку с крышкой.
2. Положите в нее немного «сухого льда» и слегка полейте его горячей водой.
3. Проткните бутылку недалеко от крышки и плотно вставьте пластмассовую трубочку.
4. Подготовьте в небольшой емкости густой мыльный раствор.
5. Смочите конец трубки мылом – надуется белый пузырик, который можно брать в руки, если надеть на них шерстяные варежки.

