§16 Выпаривание и кристаллизация
Вопросы перед параграфом
Задание №1
Какие смеси разделяют выпариванием?
Ответ
Выпариванием разделяют однородные смеси − растворы.
Задание №2
Когда из раствора выделяются кристаллы?
Ответ
Кристаллы выделяются при охлаждении раствора.
§16. проблемный вопрос
Задание №1
Образование кристаллов из раствора − физическое или химическое явление?
Ответ
Образование кристаллов из раствора − это физическое явление, так как новых веществ при этом не образуется.
§16. вопросы и задания
Задание №1
Какую операцию называют выпариванием? Как её осуществляют?
Ответ
Выпаривание − процесс испарения растворителя из раствора. Выпаривание происходит при нагревании раствора до температуры кипения.
Задание №2
Расскажите, как можно вырастить в домашних условиях крупные кристаллы поваренной соли.
Ответ
Для получения крупных кристаллов поваренной соли в домашних условиях в раствор соли опускают хлопчатобумажную нить. Воду выпаривают лишь частично, а затем раствор оставляют открытым в течение длительного времени. Вода медленно испаряется, и поваренная соль выделяется на нити в виде крупных кристаллов.
Задание №3
Как можно превратить мелкие кристаллы калийной селитры в крупные?
Ответ
Растворите в стакане с горячей (почти кипящей) водой две ложечки калийной селитры, дождитесь полного растворения кристаллов. Вытрите стакан снаружи сухой тряпкой, поставьте его на электроплитку и вновь нагрейте. Перемешивайте раствор стеклянной палочкой. Выключите плитку. Не снимая стакан с плитки, дайте ему постепенно охладиться до комнатной температуры. Кристаллы будут крупными, если раствор охлаждать постепенно, перед этим выпарив половину воды.
Задание №4
При выпаривании 120г раствора поваренной соли получили 6г твёрдого остатка. Определите массовую долю соли в исходном растворе.
Ответ
Дано:
m(раствора) = 120 г
m(NaCl) = 6 г
Найти:
w(NaCl) = ?
Решение:
Вычисляем массовую долю поваренной соли в растворе:
w(NaCl) = $\frac{m(NaCl)}{m(раствора)}$ * 100% = $\frac{6г}{120г}$ * 100% = 5%
Ответ: w(NaCl) = 5%
Задание №5
В каком случае удастся получить больше твёрдого остатка: при выпаривании 230г 7%−го раствора поваренной соли или 150г 10%−го раствора калийной селитры?
Ответ
Дано:
w (NaCl) = 7%
m(р−ра NaCl) = 230 г
w ($KNO_{3}$) = 10%
m(р−ра $KNO_{3}$) = 150 г
Найти:
m(NaCl) − ?
m($KNO_{3}$) − ?
Решение:
Вычисляем массы поваренной соли и калийной селитры:
m(NaCl) = $\frac{m(р-ра NaCl) * w(NaCl)}{100}$ = $\frac{230 * 7}{100}$ = 16,1 г
m($KNO_{3}$) = $\frac{m(р-ра KNO_{3}) * w(KNO_{3})}{100}$ = $\frac{150 * 10}{100}$ = 15 г
m($KNO_{3}$) < m($NaCl$)
Ответ: Твёрдого остатка получится больше при выпаривании поваренной соли NaCl.
Задание №6
Используя данные о растворимости поваренной соли из приложения (с.190), определите, можно ли растворить при комнатной температуре две столовые ложки поваренной соли в 1л воды. Одна столовая ложка без горки вмещает 25г соли.
Ответ
Приложение. Растворимость некоторых солей в воде (г безводной соли и 100 г воды)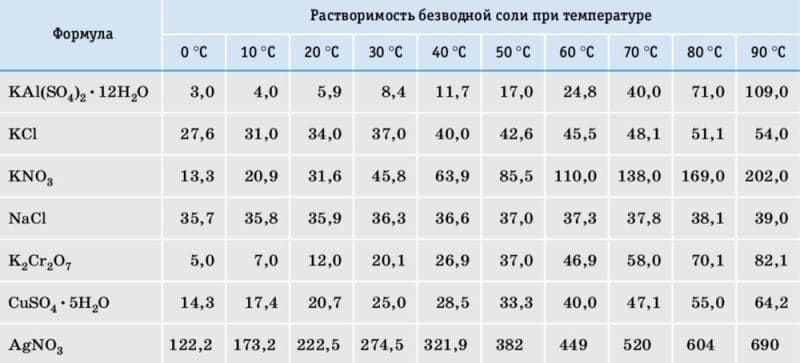
Дано:
V($H_{2}O$) = 1л
m ($NaCl$) = 25г 2= 50 г
Решение:
По таблице растворимости в 100 мл воды при комнатной температуре можно растворить не более 35,9 г поваренной соли NaCl, или, другими словами, в 1 л − 359 г.
Две столовые ложки поваренной соли имеют массу 25 г * 2=50 г, а 50 г<359 г, следовательно, их можно растворить в 1 литре воды.
Ответ: Да, в 1л воды можно растворить две столовые ложки поваренной соли.

