Глава 2. Экспериментальная работа с веществами
§13 Растворение
Вопросы перед параграфом
Задание №1
Как получить раствор из двух веществ?
Ответ
Для растворения понадобятся как минимум два вещества. Одно из них— растворитель. Второе вещество, которое мы переводим в раствор, может быть любым. Главное, чтобы при растворении оно не вступало с водой (или другим растворителем) в химическую реакцию. Иначе мы либо вообще не получим никакого раствора, либо получим раствор не исходного, а другого вещества. Для получения раствора необходимо внести порцию вещества в растворитель и перемешивать до тех пор, пока жидкость не станет прозрачной (рис. 64).
Рис. 64. Растворение вещества в воде
Задание №2
Что такое растворимость и от чего она зависит?
Ответ
Растворимость количественно выражается максимальной массой вещества, которую можно перевести в раствор, используя 100 г растворителя.
§13. проблемный вопрос
Задание №1
Почему одни вещества хорошо смешиваются друг с другом, а другие нет?
Ответ
Вещество лучше растворяется в жидкости, если оно обладает той же полярностью и сходными прочими характеристиками.
Всем известно, что масло и вода не смешиваются: если мы добавим каплю масла в стакан с водой, с этой каплей ничего не произойдет, она не растворится. С другой стороны, если в воду капнуть этанол (спирт) капля сразу исчезнет, потому что она растворилась. Такое поведение веществ объясняют эмпирическим правилом «подобное растворяется в подобном».
Дело в том, что вода — полярная молекула. Электроны в молекуле воды большую часть времени проводят около кислорода, и, хотя суммарный электрический заряд всей молекулы равен нулю, молекула воды со стороны водорода становится положительно заряженной. Молекула этанола также полярная, и поэтому между молекулами воды и этанола могут образовываться водородные связи.
С другой стороны, масло состоит из неполярных молекул, поэтому между ними и молекулами воды нет связей. Масло не «подобно» воде и не растворяется в ней.
§13. вопросы и задания
Задание №1
Приведите примеры веществ, растворимых и нерастворимых в воде.
Ответ
Растворимые в воде вещества: поваренная соль (хлорид натрия), сахар, калийная селитра (нитрат калия), лимонная кислота, этанол (этиловый спирт).
Нерастворимые в воде вещества: оксид алюминия, мел (карбонат кальция), подсолнечное масло.
Вопрос №2
Как изменяется растворимость большинства твёрдых веществ при нагревании? Что произойдёт, если насыщенный при 70°С раствор калийной селитры охладить до комнатной температуры?
Ответ
При нагревании растворимость большинства твёрдых веществ увеличивается.
Если насыщенный при 70°С раствор калийной селитры охладить до комнатной температуры, то образуется осадок и раствор станет мутным.
Задание №3
Глядя на рисунок 68, определите, какой из растворов медного купороса имеет наибольшую концентрацию.
Рис. 68. Растворы медного купороса разной концентрации
Ответ
Наибольшую концентрацию медного купороса имеет раствор под буквой в), так как у него самый насыщенный цвет.
Задание №4
Какую массу калийной селитры и какой объём воды нужно взять для приготовления 300г 4%−го раствора?
Ответ
Дано:
w($KNO_{3}$) = 4%
m(раствора) = 300 г
p($H_{2}O$) = 1$\frac{г}{мл}$ (плотность воды является постоянной величиной)
Найти::
m($KNO_{3}$) − ?
V($H_{2}O$) − ?
Решение:
1. Вычисляем массу калийной селитры:
m($KNO_{3}$) = $\frac{m(раствора)\; * \;w(KNO_{3})}{100}$ = $\frac{300\;*\;4%}{100}$ = 12 г
2. Рассчитываем массу воды:
m($H_{2}O$) = m(раствора) − m($KNO_{3}$) = 300 г – 12 г = 288 г
V($H_{2}O$) = $\frac{m(H_{2}O)}{p(H_{2}O)}$ = $\frac{288}{1}$ = 288 мл
Ответ: m($KNO_{3}$) = 12 г, V($H_{2}O$) = 288 мл.
Задание №5
Растворимость калийной селитры в воде при комнатной температуре равна 31,6 г в 100 г воды. Определите массовую долю селитры в насыщенном растворе.
Ответ
Дано:
m($H_{2}O$)=100 г
m($KNO_{3}$)=31,6 г
Найти:
$w$($KNO_{3}$) − ?
Решение:
1. Рассчитываем массу раствора:
m(раствора) = m($KNO_{3}$) + m($H_{2}O$) = 31,6 г + 100 г = 131,6 г
2. Вычисляем массовую долю калийной селитры в растворе:
$w$($KNO_{3}$) = $\frac{m(KNO_{3})}{m(раствора)}$100% = $\frac{31,6 г}{131,6 г}$100% = 24%
Ответ: $w$($KNO_{3}$) = 24%
Задание №6
В каком объёмном соотношении нужно смешать уксусную кислоту и воду для получения 9%−го раствора?
Ответ
Дано:
$w$($CH_{3}COOH$) = 9%
$p$($H_{2}O$) = 1$\frac{г}{мл}$
$p$($CH_{3}COOH$) = 1,05 $\frac{г}{мл}$
Найти:
V($CH_{3}COOH$) : V($H_{2}O$)−?
Решение:
Допустим, что масса раствора 100 г.
1. Вычисляем массу уксусной кислоты:
m($CH_{3}COOH$) = $\frac{m(раствора)\;* \;w(CH_{3}COOH)}{100}$ = $\frac{100\;*\;9}{100}$ = 9 г
2. Рассчитываем массу воды в растворе:
m($H_{2}O$) = m(раствора) − m($CH_{3}COOH$) = 100 г − 9 г = 91 г
3. Вычисляем объёмы уксусной кислоты и воды:
V($CH_{3}COOH$) = $\frac{m(CH_{3}COOH)}{p(CH_{3}COOH)}$ = $\frac{9}{1,05}$ = 8,57 мл
V($H_{2}O$) = $\frac{m(H_{2}O)}{p(H_{2}O)}$ = $\frac{91}{1}$ = 91 мл
4. Определяем соотношение объёмом:
V($CH_{3}COOH$) : V($H_{2}O$) = 8,57мл : 91мл = 1мл : 10,6мл
Ответ: Для получения 9%−го раствора нужно смешать 1мл уксусной кислоты и 10,6 мл воды.
Задание №7
Пользуясь кривой растворимости (см. рис. 67), предложите способ очистки сахарного песка от случайно попавшей в него поваренной соли.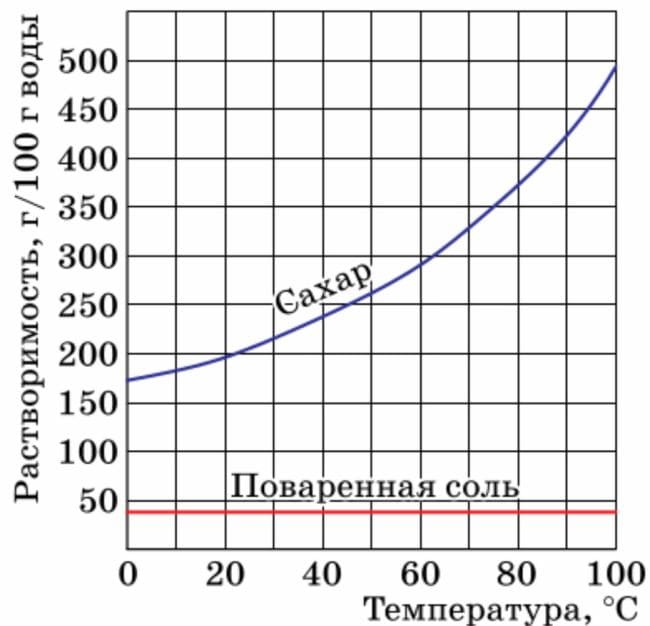
Рис. 67. Кривые растворимости сахара (сахарозы) и поваренной соли
Ответ
1. Растворим эту смесь в воде.
2. Кристаллизацией раствора получим кристаллы соли (воду выпаривают лишь частично, а затем раствор оставляют открытым в течение длительного времени или охлаждают, вода медленно испаряется, и растворённое вещество выделяется в виде крупных кристаллов).
3. Фильтрованием получаем кристаллики соли.
4. Выпариванием фильтрата (раствора, прошедшего через фильтр) получаем сахарный песок.

