§5 Изотопы
Вопросы перед параграфом
Задание №1
Одинаковы ли атомы одного и того же химического элемента?
Ответ
У одного и того же химического элемента атомы разные, но с одинаковым зарядом ядра.
Водород − первый элемент Периодической системы химических элементов Д. И. Менделеева. Его порядковый номер 1 означает, что заряд ядра атома водорода Z= +1, ядро содержит один протон, а вокруг ядра движется один электрон. Число нейтронов и массовое число у изотопов водорода различаются. Самый лёгкий и самый распространённый изотоп водорода − протий вообще не содержит нейтронов, его ядро состоит из одного протона. В ядре атома дейтерия содержатся один протон и один нейтрон, атомы дейтерия в два раза тяжелее атомов протия. Самый тяжёлый изотоп водорода − тритий. В его ядре три частицы − один протон и два нейтрона. Независимо от массы атомы всех изотопов водорода содержат по одному электрону и не имеют электрического заряда (табл. 3).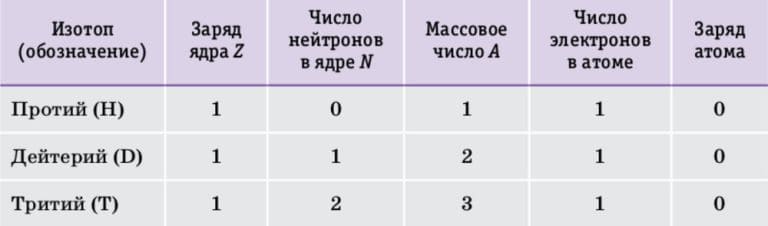
Таблица 3. Сравнительный состав изотопов водорода
Задание №2
В чём различие атомов одного и того же химического элемента?
Ответ
Атомы одного и того же химического вещества различаются атомной массой.
Проблемный вопрос
Задание №1
Изотопы отличаются друг от друга массой. Различаются ли они химическими свойствами?
Ответ
Химические свойства определяются строением внешнего электронного уровня. У изотопов его строение абсолютно одинаково, поэтому и свойства одинаковы.
Вопросы и задания
Задание №1
Что общего у изотопов одного и того же элемента и чем они различаются?
Ответ
Сходства: заряд ядра атома, число протонов, число электронов.
Различия: число нейтронов и, соответственно, массовое число (или масса).
Задание №2
Запишите в символьном виде обозначения изотопов:
1) гелий−4
2) азот−14
3) фтор−19
4) хлор−35
Ответ
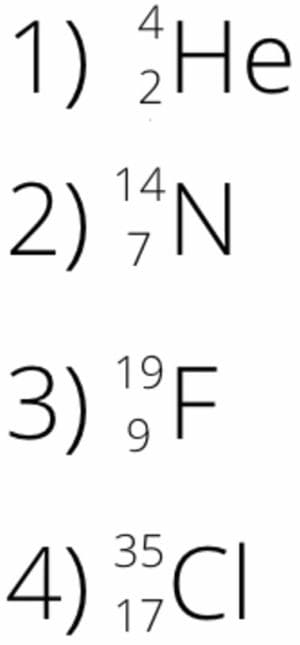
Задание №3
Используя рисунок 24, опишите строение атома углерода−13.
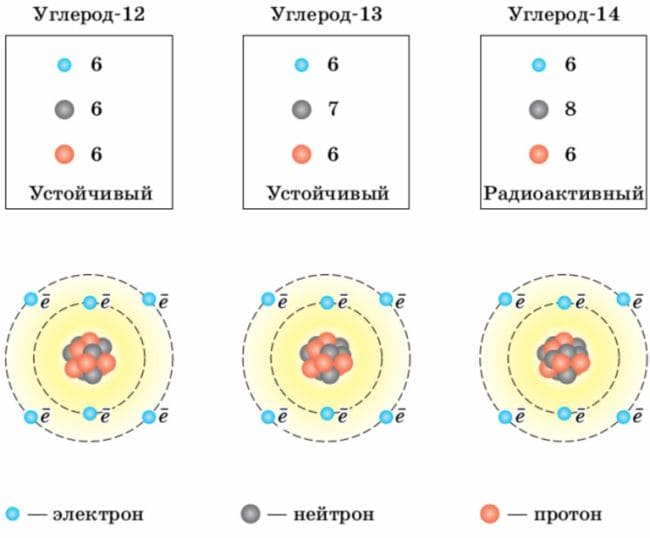 Рис.24. Строение изотопов углерода
Рис.24. Строение изотопов углерода
Ответ
Атом углерода−13 состоит из ядра, в состав которого входят 6 протонов и 7 нейтронов, вокруг которого находятся 6 электронов (2 электрона на внутренней оболочке и 4 на внешней).
Задание №4
Для трёх изотопов углерода составьте таблицу, аналогичную таблице 3.
Таблица 3. Сравнительный состав изотопов водорода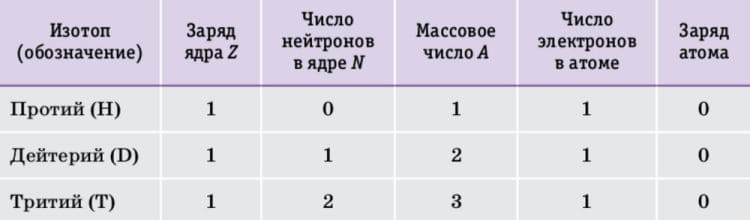 Ответ
Ответ
Изотоп (обозначение) Заряд ядра, Z Число нейтронов в ядре, N Массовое число, A Число электронов в атоме Заряд атома
Углерод − 12 6 12 − 6 = 6 12 6 0
Углерод − 13 6 13 − 6 = 7 13 6 0
Углерод − 14 6 14 − 6 = 8 14 6 0
Задание №5
В составе какого из изотопов гелия ( Z = 2 ) столько же нейтронов, сколько в составе дейтерия? Назовите и запишите его полное обозначение, указав массовое число
Ответ
В составе Гелий−3 столько же нейтронов, сколько в составе дейтерия.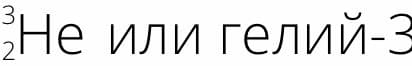
Ядро дейтерия содержит один нейтрон ( N = 1 ) и один протон ( Z = 1 ), следовательно, ядро изотопа гелия будет содержать 2 протона ( Z = 2 ) и 1 нейтрон ( N = 1 ), поэтому его массовое число равно А = Z + N= 2 + 1 = 3
Задание №6
В каких из перечисленных атомов число протонов, нейтронов и электронов одинаково: кислород−16, фтор−19, натрий−23, магний−24, фосфор−31, сера−32?
Ответ
Число протонов, нейтронов и электронов одинаково в Кислороде−16, Магние−24 и Сере−32
Изотоп Массовое число, A Число протонов, Z Число нейтронов, N Число электронов
Кислород−16 16 8 16 − 8 = 8 8
Фтор−19 19 9 19 − 9 = 10 9
Натрий−23 23 11 23 − 11 = 12 11
Магний−24 24 12 24 − 12 = 12 12
Фосфор−31 31 15 31 − 15 = 16 15
Сера−32 32 16 32 − 16 = 16 16
Задание №7
Атом хлора содержит нейтронов на три больше, чем протонов. Назовите этот изотоп, запишите его полное обозначение.
Ответ
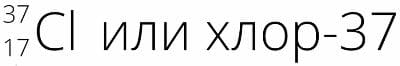
Атом хлора содержит 17 протонов ( Z = 17 ) (равно его порядковому номеру), поэтому изотоп будет содержать 20 нейтронов ( N = 17 + 3 = 20 ), а его массовое число равно A = Z + N = 17 + 20 = 37

