§12. Щелочные металлы
Лабораторный опыт №14
Окрашивание пламени солями щелочных металлов
Возьмите лучинку, закрепите на ней петельку или спираль из нихромовой проволоки. Обмакните петельку в соляную кислоту и прокалите в пламени спиртовки (пламя должно быть бесцветным). Затем погрузите петельку в раствор или сухую соль натрия и внесите её в пламя. В какой цвет оно окрашивается?
Повторите все операции и для соли калия. Для наблюдения цвета пламени, окрашенного солями калия, желательно использовать синий светофильтр, поглощающий жёлтый цвет. Если в кабинете химии имеются соли лития, повторите опыт и для этих соединений.
Ответ:
Окрашивание пламени солями щелочных металлов
Взяли лучинку, закрепили на ней петельку или спираль из нихромовой проволоки. Обмакнули петельку в соляную кислоту и прокалили в пламени спиртовки (пламя должно быть бесцветным). Затем погрузили петельку в раствор или сухую соль натрия и внесли её в пламя.
Соли натрия окрашивают пламя в желтый цвет, калия – в фиолетовый, лития – в карминово−красный.
i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Chem ege".
2) Сайт "Prime Chemical Group".
3) Сайт "Studarium".
2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Строение атомов щелочных металлов
Щелочные металлы расположены в главной подгруппе первой группы периодической системы химических элементов Д.И. Менделеева. Название происходит от продукта взаимодействия этих веществ с водой, в результате которой образуется щелочь.
Химические свойства элементов напрямую зависят от строения атома. Атом любого элемента состоят из ядра, имеющего положительный заряд и электронов, образующих энергетически облака вокруг ядра. У всех щелочных металлов имеется только 1 электрон на внешнем энергетическом уровне. Поэтому металлические свойства у них выражены наиболее ярко.
?
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а)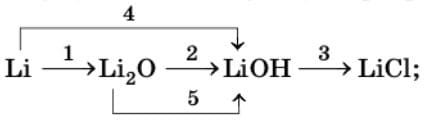
б)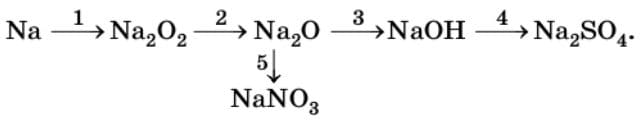
Ответ:
а)
1) $4Li + O_{2} = 2Li_{2}O$
2) $Li_{2}O + H_{2}O = 2LiOH$
3) $LiOH + HCl = LiCl + H_{2}O$
4) $2Li + 2H_{2}O = 2LiOH + H_{2}↑$
5) $Li_{2}O + 2HCl = 2LiCl + H_{2}O$
б)
1) $2Na + O_{2} = Na_{2}O_{2}$
2) $Na_{2}O_{2} + 2Na = 2Na_{2}O$
3) $Na_{2}O + H_{2}O = 2NaOH$
4) $2NaOH + H_{2}SO_{4} = Na_{2}SO_{4} + 2H_{2}O$
5) $Na_{2}O + 2HNO_{3} = 2NaNO_{3} + H_{2}O$
2. Вычислите объём водорода (н. у.), который может быть получен при растворении в воде 11,5 г натрия, содержащего 2% примесей, если выход водорода составляет 95% от теоретически возможного.
Ответ:
Дано:
$m_{техн}$ (Na) = 11,5 г
ω (примесей) = 2%
η = 95%
Найти:
$V_{практ}$ ($H_{2}$) − ?
Решение:
$2Na + 2H_{2}O = NaOH + H_{2}$
$ω_{чист}$ (Na) = 100 − ω (примесей) = 100% − 2% = 98%
m (Na) = $m_{техн}$ (Na) * $ω_{чист}$ (Na) = 11,5 * 0,98 = 11,27 г
n (Na) = $\frac{m}{M}$ = $\frac{11,27}{23}$ = 0,5 моль
n ($H_{2}$) = $\frac{n (Na)}{2}$ = $\frac{0,5}{2}$ = 0,25 моль
$V_{теор}$ ($H_{2}$) = n * $V_{m}$ = 0,25 * 22,4 = 5,6 л
$V_{практ}$ ($H_{2}$) = $V_{теор}$ ($H_{2}$) * η = 5,6 * 0,95 = 5,32 л
Ответ: $V_{практ}$ ($H_{2}$) = 5,32 л.
3. Прочитайте сочинение, написанное ученицей 9 класса 531−й школы Москвы Наташей Фроловой (1991).
Добрый Литий
В большом семиэтажном доме, в подъезде щелочных металлов, на втором этаже жил Литий – самый лёгкий и беззаботный металл. Он, как и все щелочные металлы, очень активно взаимодействовал с кислородом, неметаллами, водородом и водой. Как и все, защищался от кислорода, но носил не керосиновую, а вазелиновую "шубу", так как был очень лёгким и всплывал в керосине.
Но всё же Литий не был во всех отношениях похожим на своих собратьев: он был добр, щедр и прост. Он с охотой отдавал свои электроны и кислороду, и азоту, и многим другим элементам. Из−за этих−то особенностей Литий страдал, так как другие щелочные металлы, особенно такие хитрые, как Калий и Натрий, не давали ему прохода. Дело было в том что, когда щелочные металлы горели в кислороде, каждые их два атома отдавали одной молекуле Кислорода два своих электрона – каждому атому по одному. Остальные электроны они припрятывали до поры до времени.
$2Na + O_{2} = Na_{2}O_{2}$
Литий же был честен – отдавал молекуле Кислорода в два раза больше электронов, чем остальные металлы: на четыре атома Лития – четыре электрона.
$4Li + O_{2} = 2Li_{2}O$
Да и с Азотом Литий взаимодействовал спокойно, при обычной температуре, не то что другие – при нагревании. И решили Натрий и Калий допытаться у Лития: почему он так поступает? Нет ли в его поведении каких−либо скрытых выгод? Спрашивает Натрий: "Почему ты, брат Литий, все свои электроны Кислороду отдаёшь? Не лучше ли делать так, как мы?" Отвечал Литий: "Я всегда рад помочь другим, не то что вы – жадничаете. Я рад, что в моём оксиде Кислород имеет свою обычную степень окисления −2, не то что −1 в ваших странных, ни на что не похожих пероксидах". Сказал так и ушёл восвояси. Долго стояли Натрий и Калий в раздумье, но так ничего и не поняли. И сейчас с Кислородом продолжают пероксиды образовывать. А оксиды состава $M_{2}O$ дают лишь тогда, когда их силой заставят, т. е. создадут соответствующие условия – нагреют пероксид ($Na_{2}O_{2}$) с таким же металлом – "жадиной" (Na)". Какие химические понятия использовала в художественной форме Наташа?
Ответ:
Наташа использовала в художественной форме такие химичсекие понятия:
1) Семиэтажный дом: Наташа имела в виду Периодическую таблицу Д. И. Менделеева;
2) Подъезд щелочных металлов: Наташа имела в виду IА группа в Периодической таблице;
3) Вазелиновая "шуба": Наташа имела в виду то, что литий хранится в толще вазелина.
4. Напишите сочинение о щелочных металлах, положив в основу сюжета превращения этих металлов или один из химических процессов.
Ответ:
Щелочные металлы расположены в главной подгруппе первой группы периодической системы химических элементов Д.И. Менделеева. Название происходит от продукта взаимодействия этих веществ с водой, в результате которой образуется щелочь.
Химические свойства элементов напрямую зависят от строения атома. Атом любого элемента состоят из ядра, имеющего положительный заряд и электронов, образующих энергетически облака вокруг ядра. У всех щелочных металлов имеется только 1 электрон на внешнем энергетическом уровне. Отдавая его, атомы щелочных металлов превращаются в положительно заряженные ионы − катионы с зарядом +1.
5. В 100 г кураги содержится 2,034 г калия. Сколько граммов кураги нужно съесть, чтобы получить суточную норму калия?
Ответ:
Дано:
m (кураги) = 100 г
m (K) = 2,034 г
$m_{суточ}$ (K) = 2,5 г
Найти:
$m_{суточ}$ (кураги) − ?
Решение:
Составим пропорцию:
100 г кураги − 2,034 г K
$m_{суточ}$ (кураги) − 2,5 г суточная норма калия
$m_{суточ}$ (кураги) = $\frac{100\;*\;2,5}{2,034}$ = 123 г
Ответ: $m_{суточ}$ (кураги) = 123 г.

