§15. Железо
Лабораторный опыт №17
Взаимодействие железа с соляной кислотой
В пробирку поместите немного порошка восстановленного железа и прилейте 2−3 мл соляной кислоты. Что наблюдаете? Докажите, что в результате реакции образуются хлорид железа (II) и водород. Выпишите уравнение реакции и рассмотрите окислительно−восстановительные процессы.
Ответ:
Взаимодействие железа с соляной кислотой
В пробирку поместили немного порошка восстановленного железа и прилили 2−3 мл соляной кислоты.
Наблюдаем выделение газа:
$Fe + 2HCl = FeCl_{2} + H_{2}↑$
$2H^{+} + 2ē ⟶ H_{2}^{0}$ − окислитель
$Fe^{0} - 2ē ⟶ Fe^{+2}$ − восстановитель
Докажем выделение водорода можно с помощью нагретой медной проволоки покрытой черным оксидом меди (II). Водород восстановит медь из оксида, образуется красный налет на проволоке.
$CuO + H_{2} = Cu + H_{2}O$
$2H^{+} + 2ē ⟶ H_{2}^{0}$ − окислитель
$Fe^{0} - 2ē ⟶ Fe^{+2}$ − восстановитель
Доказать наличие двухвалентного железа можно с помощью красной кровяной соли, в результате реакции выпадает осадок гексацианоферрата (III) калия−железа (II) темно−синего цвета:
$FeCl_{2} + K_{3}[Fe(CN)_{6}] = KFe[Fe(CN)_{6}]↓ + 2KCl$.
Лабораторный опыт №18
Получение гидроксидов железа (II) и (III) и изучение их свойств
Налейте в две пробирки по 2 мл растворов сульфата (или хлорида) железа (II) и (III). Добавьте в каждую по 1−2 мл раствора щёлочи. Что наблюдаете? Как изменяется цвет осадка в пробирке, в которой находился раствор соли железа (II)? Почему? Добавьте к полученным осадкам раствор серной кислоты до их полного растворения. Запишите уравнение проделанных реакций в молекулярной и ионной формах. Докажите, что полученные растворы содержат катионы $Fe^{2+}$ и $Fe^{3+}$.
Ответ:
Получение гидроксидов железа (II) и (III) и изучение их свойств
Налили в две пробирки по 2 мл растворов сульфата (или хлорида) железа (II) и (III). Добавили в каждую по 1−2 мл раствора щёлочи.
В первой пробирке наблюдаем образование осадка серо−зеленого цвета:
$FeCl_{2} + 2NaOH = 2NaCl + Fe(OH)_{2}↓$
$Fe^{2+} + 2Cl^{-} + 2Na^{+} + 2OH^{-}$ ⟶ $2Na^{+} + 2Cl^{-} + Fe(OH)_{2}↓$
$Fe^{2+} + 2OH^{-} ⟶ Fe(OH)_{2}↓$
Во второй пробирке наблюдаем образования осадка бурого цвета:
$FeCl_{3} + 3NaOH = 3NaCl + Fe(OH)_{3}↓$
$Fe^{3+} + 2Cl^{-} + 3Na^{+} + 3OH^{-}$ ⟶ $3Na^{+} + 3Cl^{-} + Fe(OH)_{3}↓$
$Fe^{3+} + 3OH^{-} ⟶ Fe(OH)_{3}↓$
Добавили к полученным осадкам раствор серной кислоты до их полного растворения:
$Fe(OH)_{2} + H_{2}SO_{4} = FeSO_{4} + 2H_{2}O$
$Fe(OH)_{2} + 2H^{+} + SO_{4}^{2-} ⟶ Fe^{2+} + SO_{4}^{2-} + 2H_{2}O$
$Fe(OH)_{2} + 2H^{+} ⟶ Fe^{2+} + 2H_{2}O$
$2Fe(OH)_{3} + 3H_{2}SO_{4} = Fe_{2}(SO_{4})_{3} + 6H_{2}O$
$2Fe(OH)_{3} + 6H^{+} + 3SO_{4}^{2-} ⟶ 2Fe^{3+} + 3SO_{4}^{2-} + 6H_{2}O$
$Fe(OH)_{3} + 3H^{+} ⟶ Fe^{3+} + 3H_{2}O$
Доказать наличие $Fe^{2+}$ можно с помощью красной кровяной соли, в результате реакции выпадает осадок темно−синего цвета:
$FeSO_{4} + K_{3}[Fe(CN)_{6}] = K_{2}SO_{4} + KFe[Fe(CN)_{6}]↓$
Доказать наличие $Fe^{3+}$ можно с помощью желтой кровяной соли, в результате реакции выпадает осадок темно−синего цвета:
$Fe_{2}(SO_{4})_{3} + 2K_{4}[Fe(CN)_{6}] = 3K_{2}SO_{4} + 2KFe[Fe(CN)_{6}]↓$
i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Chemege".
2) Сайт "Chem".
3) Сайт "100urokov".
2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Строение атома железа
Железо Fe − элемент побочной подгруппы VIII группы 4−го периода Периодической системы Д. И. Менделеева.
Строение электронной оболочки атомов железа несколько отличается от строения электронных оболочек атомов элементов главных подгрупп. Как и положено элементу 4−го периода, атомы железа имеют четыре энергетических уровня, но заполняется у них не последний, а предпоследний, третий от ядра, уровень. На последнем же уровне атомы железа содержат два электрона. На предпоследнем уровне, который может вместить 18 алектронов, у атома железа находятся 14 электронов. Следовательно, распределение электронов по уровням в атомах желева таково:
$_{26}Fe$ 2e; 8e; 14e; 2e.
Подобно всем металлам, атомы железа проявляют восстановительные свойства, отдавая при химических взаимодействиях не только два электрона с последнего уровня и приобретая степень окисления +2, но часто и электрон с предпоследнего уровня, при этом степень окисления атома повышается до +3.
?
1. Напишите уравнения реакций, иллюстрирующих генетические ряды соединений $Fe^{2+}$ и $Fe^{3+}$. Первые реакции каждого ряда охарактеризуйте с позиций окисления−восстановления, а реакции с участием электролитов запишите также в ионном виде.
Ответ:
$Fe ⟶ FeCl_{2} ⟶ Fe(OH)_{2} ⟶ FeO$
$Fe + 2HCl = FeCl_{2} + H_{2}↑$
$2H^{+} + 2ē ⟶ H_{2}^{0}$ − окислитель
$Fe^{0} - 2ē ⟶ Fe^{+2}$ − восстановитель
$FeCl_{2} + 2NaOH = 2NaCl + Fe(OH)_{2}↓$
$Fe^{2+} + 2Cl^{-} + 2Na^{+} + 2OH^{-} ⟶ 2Na^{+} + 2Cl^{-} + Fe(OH)_{2}↓$
$Fe^{2+} + 2OH^{-} ⟶ Fe(OH)_{2}↓$
$Fe(OH)_{2} = FeO + H_{2}O$
$Fe ⟶ FeCl_{3} ⟶ Fe(OH)_{3} ⟶ Fe_{2}O_{3}$
$2Fe + 3Cl_{2} = 2FeCl_{3}$
$Cl_{2}^{0} + 2ē ⟶ 2Cl^{-}$ − окислитель
$Fe^{0} - 3ē ⟶ Fe^{+3}$ − восстановитель
$FeCl_{3} + 3NaOH = 3NaCl + Fe(OH)_{3}↓$
$Fe^{3+} + 3Cl^{-} + 3Na^{+} + 3OH^{-} ⟶ 3Na^{+} + 3Cl^{-} + Fe(OH)_{3}↓$
$Fe^{3+} + 3OH^{-} ⟶ Fe(OH)_{3}↓$
$2Fe(OH)_{3} = Fe_{2}O_{3} + 3H_{2}O$
2. Напишите по два молекулярных уравнения, соответствующих следующим сокращённым ионным уравнениям:
а) $K^{+} + Fe^{2+} + [Fe(CN)_{6}]^{3-} ⟶ KFe[Fe(CN)_{6}]↓$;
б) $K^{+} + Fe^{3+} + [Fe(CN)_{6}]^{4-} ⟶ KFe[Fe(CN)_{6}]↓$;
в) $Fe^{3+} + SCN^{-} ⇄ FeSCN^{2+}$.
Как называют эти реакции? Напишите названия реактивов.
Ответ:
а) $K^{+} + Fe^{2+} + [Fe(CN)_{6}]^{3-} ⟶ KFe[Fe(CN)_{6}]↓$
1) $3FeSO_{4} + 2K_{3}[Fe(CN)_{6}] = 3K_{2}SO_{4} + KFe[Fe(CN)_{6}]↓$
2) $FeCl_{2} + K_{3}[Fe(CN)_{6}] = 2KCl + KFe[Fe(CN)_{6}]↓$
б) $K^{+} + Fe^{3+} + [Fe(CN)_{6}]^{4-} ⟶ KFe[Fe(CN)_{6}]↓$
1) $Fe(NO_{3})_{3} + K_{4}[Fe(CN)_{6}] = 3KNO_{3} + KFe[Fe(CN)_{6}]↓$
2) $FeBr_{3} + K_{4}[Fe(CN)_{6}] = 3KBr + KFe[Fe(CN)_{6}]↓$
в) $Fe^{3+} + SCN^{-} ⇄ FeSCN^{2+}$
1) $Fe_{2}(SO_{4})_{3} + 6KSCN ⇄ 3K_{2}SO_{4} + 2Fe(SCN)_{3}$
2) $FeCl_{3} + 3KSCN ⇄ 3KCl + Fe(SCN)_{3}$
3. Используя дополнительную литературу (словари русского языка, химические словари и др.), подготовьте рассказ о происхождении названий реактивов и продуктов качественных реакций на $Fe^{2+}$ и $Fe^{3+}$.
Ответ:
Происхождение названий реактивов и продуктов качественных реакций на $Fe^{2+}$ и $Fe^{3+}$
Красная кровяная соль является реактивом для проведения качественной реакции на $Fe^{2+}$. Продуктом этой реакции является соль ярко−синего цвета $KFe[Fe(CN)_ {6}]$.
Происхождение названия желтой кровяной соли началось с того, что ее применяли для окраски тканей. При этом для получения данной соли использовали кровь скота и другие отходы со скотобоен, отсюда и название «кровяная». А поскольку ее кристаллы желтого цвета – то «желтая» кровяная соль.
Желтая кровяная соль является реактивом для проведения качественной реакции на $Fe^{3+}$. Продуктом этой реакции является соль ярко−синего цвета $KFe[Fe(CN)_ {6}]$.
Красная кровяная соль была получена в 1822 году. Немецкий химик Л. Гмелин провел реакцию между желтой кровяной солью и хлором, в результате которой получил соль, представленную кристаллами красного цвета: $K_{3}[Fe(CN)_ {6}]$ . По аналогии с исходным реагентом, продукт реакции также назвали «кровяной» солью, а по цвету – «красной».
4. Составьте уравнения реакций, с помощью которых можно осуществить следующие превращения:
Рассмотрите два превращения (по выбору) с позиций окисления−восстановления. Реакции с участием электролитов напишите в молекулярной и ионных формах.
Ответ:
1) $Fe + 2HCl = FeCl_{2} + H_{2}↑$
$2H^{+} + 2ē ⟶ H_{2}^{0}$ − окислитель
$Fe^{0} - 2ē ⟶ Fe^{+2}$ − восстановитель
2) $FeCl_{2} + 2NaOH = 2NaCl + Fe(OH)_{2}↓$
$Fe^{2+} + 2Cl^{-} + 2Na^{+} + 2OH^{-} ⟶ 2Na^{+} + 2Cl^{-} + Fe(OH)_{2}↓$
$Fe^{2+} + 2OH^{-} ⟶ Fe(OH)_{2}$
3) $4Fe(OH)_{2} + O_{2} + 2H_{2}O = 4Fe(OH)_{3}$
$O_{2}^{0} + 4ē ⟶ 2O^{2-}$ − окислитель
$Fe^{+2} - 1ē ⟶ Fe^{+3}$ − восстановитель
4) $2Fe(OH)_{3} = Fe_{2}O_{3} + 3H_{2}O$
5) $Fe_{2}O_{3} + 3CO = 2Fe + 3CO_{2}$
$Fe^{+3} + 3ē ⟶ Fe^{0}$ − окислитель
$C^{+2} - 2ē ⟶ C^{+4}$ − восстановитель
6) $Fe_{2}O_{3} + 6HCl = 2FeCl_{3} + 3H_{2}O$
$Fe_{2}O_{3} + 6H^{+} + 6Cl^{-} ⟶ 2Fe^{3+} + 6Cl^{-} + 3H_{2}O$
$Fe_{2}O_{3} + 6H^{+} ⟶ 2Fe^{3+} + 3H_{2}O$
7) $FeCl_{3} + 3NaOH = 3NaCl + Fe(OH)_{3}↓$
$Fe^{3+} + 3Cl^{-} + 3Na^{+} + 3OH^{-} ⟶ 3Na^{+} + 3Cl^{-} + Fe(OH)_{3}↓$
$Fe^{3+} + 3OH^{-} ⟶ Fe(OH)_{3}↓$
8) $2FeCl_{3} + 3Zn = 3ZnCl_{2} + 2Fe$
$Fe^{+3} + 3ē ⟶ Fe^{0}$ − окислитель
$Zn^{0} - 2ē ⟶ Zn^{+2}$ − восстановитель
5. Напишите три уравнения реакций железа с разбавленной азотной кислотой, в которых продуктом восстановления кислоты будет соответственно $N_{2}, NO, NH_{4}NO_{3}$. Для расстановки коэффициентов в уравнениях химических реакций используйте метод электронного баланса. Определите окислитель и восстановитель и этих реакциях.
Ответ:
1) $5Fe + 12HNO_{3} = 5Fe(NO_{3})_{2} + N_{2}↑ + 6H_{2}O$
$2N^{+5} + 10ē ⟶ N_{2}^{0}$ − окислитель
$Fe^{0} - 2ē ⟶ Fe^{+2}$ − восстановитель
2) $Fe + 4HNO_{3} = Fe(NO_{3})_{3} + NO↑ + 2H_{2}O$
$N^{+5} + 3ē ⟶ N^{+2}$ − окислитель
$Fe^{0} - 3ē ⟶ Fe^{+3}$ − восстановитель
3) $8Fe + 30HNO_{3} = 8Fe(NO_{3})_{3} + 3NH_{4}NO_{3} + 9H_{2}O$
$N^{+5} + 8ē ⟶ N^{-3}$ − окислитель
$Fe^{0} - 3ē ⟶ Fe^{+3}$ − восстановитель
6. Вычислите объём оксида углерода (II) (н. у.), который потребуется для восстановления железа из 2,32 т магнитного железняка, содержащего 5% пустой породы. Вычислите количество вещества железа, которое при этом получится, если выход его составляет 80% от теоретически возможного.
Ответ:
Дано:
m (магнетита) = 2,32 т = 2320 кг
ω (примесей) = 5%
η (Fe) = 80%
Найти:
V (CO) − ?
$n_{практ}$ (Fe) − ?
Решение:
$Fe_{3}O_{4} + 4CO = 3Fe + 4CO_{2}$
ω ($Fe_{3}O_{4}$) = 100% − ω (примесей) = 100% − 5% = 95%
m ($Fe_{3}O_{4}$) = m (магнетита) * ω ($Fe_{3}O_{4}$) = 2320 * 0,95 = 2204 кг
n ($Fe_{3}O_{4}$) = $\frac{m}{M}$ = $\frac{2204}{232}$ = 9,5 кмоль
n (CO) = 4 * n ($Fe_{3}O_{4}$) = 4 * 9,5 = 38 кмоль
V (CO) = n * $V_{m}$ = 38 * 22,4 = 851,2 $м^{3}$
$n_{теор}$ (Fe) = 3 * n ($Fe_{3}O_{4}$) = 3 * 9,5 = 28,5 кмоль
$n_{практ}$ (Fe) = $n_{теор}$ (Fe) * η (Fe) = 28,5 кмоль * 0,8 = 22,8 кмоль
Ответ: V (CO) = 851,2 $м^{3}$; $n_{практ}$ (Fe) = 22,8 кмоль.
7. Используя свои знания по химии железа, напишите сочинение на тему «Художественный образ вещества или химического процесса».
Ответ:
Художественный образ железа
Железо − серебристо−белый блестящий металл с температурой плавления 1539 °С.
Очень пластичный, поэтому легко обрабатывается, куётся, прокатывается, штампуется. Железо обладает способностыо намагничиваться и размагничиваться, поэтому применяется в качестве сердечников электромагнитов в различных электрических машинах и аппаратах. Ему можно придать большую прочность и твёрдость методами термического и механического воздействия, например с помощью закалки и прокатки.
Различают технически чистое и химически чистое железо. Технически чистое железо представляет собой низкоуглеродистую сталь, оно содержит 0,02−0,04% углерода, а кислорода, серы, азота и фосфора − ещё меньше. Химически чистое железо содержит менее 0,01% примесей.
Из технически чистого железа сделаны, например, канцелярские скрепки и кнопки. Такое железо легко корродирует, в то время как химически чистое железо почти не подвергается коррозии.
Первые образцы железа, попавшего в руки человека, по−видимому, были метеоритного происхождения. О знакомстве человека в древности с железом космического происхождения говорит факт наличия у жителей Гренландии, не имевших никакого понятия о железной руде, изделий из железа.
Темы для дискуссии
1. Сплав − это химическое соединение или смесь веществ? Обоснуйте свою точку зрения на конкретных примерах.
Ответ:
Сплав − это материалы с металлической кристаллической решеткой, обладающие характерными свойствами и состоящие из двух и более компонентов. Таким образом, сплав − это смесь веществ.
Например: чугун − это сплав на основе железа, содержащий от 2 до 4,5% углерода, а также марганец, кремний, фосфор и серу.
2. Какие металлы и сплавы вы предложили бы использовать в искусстве и архитектуре и почему?
Ответ:
В искусстве и архитектуре я бы предложила использовать мельхиор и бронзу, так как они обладают нужными для этого характеристиками.
Мельхиор − это сплав, содержащий около 80% меди и 20% никеля, похож по внешнему виду на серебро. Используется для изготовления художественных изделий.
Бронза − сплав на основе меди с добавлением олова. Используется в художественном литье.
3. Выберите из известных вам или предложите альтернативный и при этом наиболее эффективный способ защиты металлов от коррозии.
Ответ:
Способы борьбы с коррозией:
1) Нанесение защитных покрытий на поверхности предохраняемого от коррозии металла. Для этого часто используют масляные краски, эмали, лаки. Эти неметаллические покрытия дешёвые, но обычно недолговечные. Раз в два года, а иногда и чаще их требуется обновлять. Так, например, красят Эйфелеву башню в Париже.
Предохраняемый металл можно покрыть слоем другого металла: золота, серебра, хрома, никеля, олова, цинка и др. Один из самых старых способов − это лужение, или покрытие железного листа слоем олова. Такое железо называют белой жестью.
2) Использование нержавеющих сталей, содержащих специальные добавки. Например, «нержавейка», из которой изготавливают столовые приборы, содержит до 12% хрома и до 10% никеля. Лёгкие нержавещие сплавы включают алюминий или титан. Всякий, кто был во Всероссийском выставочном центре, видел перед входом обелиск «Покорителям космоса», облицованный пластинками из титанового сплава. На его блестящей поверхности нет ни одного пятнышка ржавчины.
3) Введение в рабочую среду, где находятся металлические детали, веществ, которые в десятки и сотни раз уменьшают агрессивность среды.
Такие вещества называют ингибиторами коррозии. Ингибиторы коррозии вводят в замкнутые системы охлаждения, в нефтепродукты и даже впрыскивают в газопроводы для снижения коррозии труб изнутри. Для предотвращения коррозии железа в серной кислоте к ней добавляют в качестве ингибитора азотную кислоту.
4) Создание контакта с более активным металлом протектором. Например, для защиты стальных корпусов морских судов обычно используют цинк. На суше металлические конструкции линии электропередачи (ЛЭП) и трубопроводов соединяют с листом или куском более активного металла. С этой же целью к деталям конструкции мостов приваривают куски цинка.
ХИМИЧЕСКИЙ ПРАКТИКУМ №1. Свойства металлов и их соединений
Практическая работа №1
Вариант 1
Осуществление цепочки и химических
Проведите реакции, в которых осуществляются предложенные ниже химические превращения (по вариантам). Составьте уравнения соответствующих реакций. Реакции ионного обмена запишите также в ионной форме.
$MgCO_{3} ⟶ MgCl_{2} ⟶ Mg(OH)_{2} ⟶ MgSO_{4}$
Ответ:
$MgCO_{3} ⟶ MgCl_{2} ⟶ Mg(OH)_{2} ⟶ MgSO_{4}$
1) $MgCO_{3} + 2HCl = MgCl_{2} + H_{2}O + CO_{2}↑$
$MgCO_{3} + 2H^{+} + 2Cl^{-} ⟶ Mg^{2+} + 2Cl^{-} + H_{2}O + CO_{2}↑$
$MgCO_{3} + 2H^{+} ⟶ Mg^{2+} + H_{2}O + CO_{2}↑$
2) $MgCl_{2} + 2NaOH = 2NaCl + Mg(OH)_{2}↓$
$Mg^{2+} + 2Cl^{-} + 2Na^{+} + 2OH^{-} ⟶ 2Na^{+} + 2Cl^{-} + Mg(OH)_{2}↓$
$Mg^{2+} + 2OH^{-} ⟶ Mg(OH)_{2}↓$
3) $Mg(OH)_{2} + H_{2}SO_{4} = MgSO_{4} + 2H_{2}O$
$Mg(OH)_{2} + 2H^{+} + SO_{4}^{2-} ⟶ Mg^{2+} + SO_{4}^{2-} + 2H_{2}O$
$Mg(OH)_{2} + 2H^{+} ⟶ Mg^{2+} + 2H_{2}O$
Вариант 2
Осуществление цепочки и химических
Проведите реакции, в которых осуществляются предложенные ниже химические превращения (по вариантам). Составьте уравнения соответствующих реакций. Реакции ионного обмена запишите также в ионной форме.
$CuSO_{4} ⟶ Cu(OH)_{2} ⟶ CuO ⟶ Cu$
Ответ:
$CuSO_{4} ⟶ Cu(OH)_{2} ⟶ CuO ⟶ Cu$
1) $CuSO_{4} + 2NaOH = Na_{2}SO_{4} + Cu(OH)_{2}↓$
$Cu^{2+} + SO_{4}^{2-} + 2Na^{+} + 2OH^{-}$ ⟶ $2Na^{+} + SO_{4}^{2-} + Cu(OH)_{2}↓$
$Cu^{2+} + 2OH^{-} ⟶ Cu(OH)_{2}↓$
2) $Cu(OH)_{2} = CuO + H_{2}O$
3) $CuO + H_{2} = Cu + H_{2}O$
Вариант 3
Осуществление цепочки и химических
Проведите реакции, в которых осуществляются предложенные ниже химические превращения (по вариантам). Составьте уравнения соответствующих реакций. Реакции ионного обмена запишите также в ионной форме.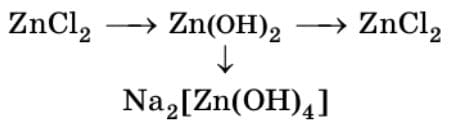
Ответ:
1) $ZnCl_{2} + 2NaOH = 2NaCl + Zn(OH)_{2}↓$
$Zn^{2+} + 2Cl^{-} + 2Na^{+} + 2OH^{-} ⟶ 2Na^{+} + 2Cl^{-} + Zn(OH)_{2}↓$
$Zn^{2+} + 2OH^{-} ⟶ Zn(OH)_{2}↓$
2) $Zn(OH)_{2} + 2HCl = ZnCl_{2} + 2H_{2}O$
$Zn(OH)_{2} + 2H^{+} + 2Cl^{-} ⟶ Zn^{2+} + 2Cl^{-} + 2H_{2}O$
$Zn(OH)_{2} + 2H^{+} ⟶ Zn^{2+} + 2H_{2}O$
3) $Zn(OH)_{2} + 2NaOH = Na_{2}[Zn(OH)_{4}]$
$Zn(OH)_{2} + 2Na^{+} + 2OH^{-} ⟶ 2Na^{+} + [Zn(OH)_{4}]^{2-}$
$Zn(OH)_{2} + 2OH^{-} ⟶ [Zn(OH)_{4}]^{2-}$
Практическая работа №2
Задание 1
В математике действует правило — «от перемены мест слагаемых сумма не меняется». Справедливо ли оно для химии? Проверьте это на примере следующего опыта.
Получите гидроксид алюминия по реакции обмена и докажите его амфотерный характер. Для этого вы можете использовать следующую реакцию:
$AlCl_{3} + 3NaOH ⟶ Al(OH)_{3}↓ + 3NaCl$.
Проведите эту реакцию в двух вариантах, используя в каждом варианте одинаковые объёмы исходных веществ: сначала к раствору одного из исходных веществ (реагенту) прибавляйте по каплям раствор другого реагента, затем поменяйте последовательность введения в реакцию реагентов. Наблюдайте, в каком случае выпадет осадок, а в каком – нет.
Объясните результаты и запишите уравнения проведённых реакций в молекулярной и ионной формах.
Ответ:
В математике действует правило — «от перемены мест слагаемых сумма не меняется». Однако, для химии оно неверное. Проверим это на примере следующего опыта.
Получили гидроксид алюминия по реакции обмена и докажем его амфотерный характер. Для этого мы использовали следующую реакцию:
$AlCl_{3} + 3NaOH = Al(OH)_{3}↓ + 3NaCl$.
При добавлении раствора щелочи в раствор хлорида алюминия образуется белый осадок гидроксида алюминия, так как щелочь в недостатке:
$AlCl_{3} + 3NaOH = 3NaCl + Al(OH)_{3}↓$
$Al^{3+} + 3Cl^{-} + 3Na^{+} + 3OH^{-} ⟶ 3Na^{+} + 3Cl^{-} + Al(OH)_{3}↓$
$Al^{3+} + 3OH^{-} ⟶ Al(OH)_{3}↓$
При добавлении раствора хлорида алюминия в раствор щелочи осадок не образуется, так как щелочь в избытке, поэтому она вступает в реакцию с гидроксидом алюминия:
$4NaOH + AlCl_{3} = 3NaCl + Na[Al(OH)_{4}]$
$4Na^{+} + 4OH^{-} + Al3^{+} + 3Cl^{-} ⟶ 3Na^{+} + 3Cl^{-} + Na^{+} + [Al(OH)_{4}]^{-}$
$Al^{3+} + 4OH^{-} ⟶ [Al(OH)_{4}]^{-}$
Докажем амфотерный характер гидроксида алюминия: он реагирует и с кислотами, и с щелочами.
С щелочами:
$Al(OH)_{3} + NaOH = Na[Al(OH)_{4}]$
$Al(OH)_{3} + Na^{+} + OH^{-} ⟶ Na^{+} + [Al(OH)_{4}]^{-}$
$Al(OH)_{3} + OH^{-} ⟶ [Al(OH)_{4}]^{-}$
С кислотами:
$Al(OH)_{3} + 3HCl = AlCl_{3} + 3H_{2}O$
$Al(OH)_{3} + 3H^{+} + 3Cl^{-} ⟶ Al^{3+} + 3Cl^{-} + 3H_{2}O$
$Al(OH)_{3} + 3H^{+} ⟶ Al^{3+} + 3H_{2}O$
Задание 2
Проведите реакции, подтверждающие качественный состав хлорида кальция. Запишите уравнения реакций в молекулярной и ионной формах.
Ответ:
Качественной реакцией на катион кальция $Ca^{2+}$ является реакция с карбонатом:
$CaCl_{2} + Na_{2}CO_{3} = 2NaCl + CaCO_{3}↓$
$Ca^{2+} + 2Cl^{-} + 2Na^{+} + CO_{3}^{2-} ⟶ 2Na^{+} + 2Cl^{-} + CaCO_{3}↓$
$Ca^{2+} + CO_{3}^{2-} ⟶ CaCO_{3}↓$
Качественной реакцией на анион хлора $Cl^{-}$ является реакция с солью серебра:
$CaCl_{2} + 2AgNO_{3} = Ca(NO_{3})_{2} + 2AgCl↓$
$Ca^{2+} + 2Cl^{-} + 2Ag^{+} + 2NO_{3}^{-} ⟶ Ca^{2+} + 2NO_{3}^{-} + 2AgCl↓$
$Ag^{+} + Cl^{-} ⟶ AgCl↓$
Задание 3
Осуществите превращения согласно следующей схеме:
$Fe ⟶ FeCl_{2} ⟶ FeCl_{3}$.
Напишите уравнения соответствующих реакций и рассмотрите их с позиций окисления−восстановления. Проведите качественные реакции, подтверждающие наличие продуктов реакций. Запишите уравнения реакций в молекулярной и ионной формах.
Ответ:
$Fe ⟶ FeCl_{2} ⟶ FeCl_{3}$:
1) $Fe + 2HCl = FeCl_{2} + H_{2}↑$
$2H^{+} + 2ē ⟶ H_{2}^{0}$ − окислитель
$Fe^{0} - 2ē ⟶ Fe^{+2}$ − восстановитель
2) $2FeCl_{2} + Cl_{2} = 2FeCl_{3}$
$Cl_{2}^{0} + 2ē ⟶ 2Cl^{-}$ − окислитель
$Fe^{+2} - 1ē ⟶ Fe^{+3}$ − восстановитель
Качественные реакции:
1) На ион $Fe^{2+}$ проведем реакцию с красной кровяной солью:
$3FeCl_{2} + 2K_{3}[Fe(CN)_{6}] = 6KCl + Fe_{3}[Fe(CN)_{6}]_{2}↓$
$3Fe^{2+} + 6Cl^{-} + 6K^{+} + [Fe(CN)_{6}]^{3-}$ ⟶ $6K^{+} + 6Cl^{-} + Fe_{3}[Fe(CN)_{6}]_{2}↓$
$3Fe^{2+} + [Fe(CN)_{6}]^{3-} = Fe_{3}[Fe(CN)_{6}]_{2}↓$
2) На ион $Fe^{3+}$ проведем реакцию с желтой кровяной солью:
$4FeCl_{3} + 3K_{4}[Fe(CN)_{6}] = 12KCl + Fe_{4}[Fe(CN)_{6}]_{3}↓$
$4Fe^{3+} + 12Cl^{-} + 12K^{+} + [Fe(CN)_{6}]^{4-}$ ⟶ $12K^{+} + 12Cl^{-} + Fe_{4}[Fe(CN)_{6}]_{3}↓$
$4Fe^{3+} + [Fe(CN)_{6}]^{4-} = Fe_{4}[Fe(CN)_{6}]_{3}↓$
Задание 4
Получите сульфат железа (II) не менее чем тремя способами. Уравнения реакций ионного обмена запишите в ионной и молекулярной формах, а реакции замещения рассмотрите с позиций окисления−восстановления.
Ответ:
1 способ:
$CuSO_{4} + Fe = FeSO_{4} + Cu$
$Cu^{+2} + 2ē ⟶ Cu^{0}$ − окислитель
$Fe^{0} - 2ē ⟶ Fe^{+2}$ − восстановитель
2 способ:
$FeO + H_{2}SO_{4} = FeSO_{4} + H_{2}O$
$FeO + 2H^{+} + SO_{4}^{2-} ⟶ Fe^{2+} + SO_{4}^{2-} + H_{2}O$
$FeO + 2H^{+} ⟶ Fe^{2+} + H_{2}O$
3 способ:
$Fe(OH)_{2} + H_{2}SO_{4} = FeSO_{4} + 2H_{2}O$
$Fe(OH)_{2} + 2H^{+} + SO_{4}^{2-} ⟶ Fe^{2+} + SO_{4}^{2-} + 2H_{2}O$
$Fe(OH)_{2} + 2H^{+} ⟶ Fe^{2+} + 2H_{2}O$
Задание 5
Проведите реакции, подтверждающие качественный состав сульфата железа (II). Запишите уравнения соответствующих реакций в молекулярной и ионной формах.
Ответ:
Качественной реакцией на катион железа $Fe^{2+}$ является реакция с основанием:
$FeSO_{4} + 2NaOH = Na_{2}SO_{4} + Fe(OH)_{2}↓$
$Fe^{2+} + SO_{4}^{2-} + 2Na^{+} + 2OH^{-} ⟶ 2Na^{+} + SO_{4}^{2-} + Fe(OH)_{2}↓$
$Fe^{2+} + 2OH^{-} ⟶ Fe(OH)_{2}↓$
Качественной реакцией на анион $SO_{4}^{2-}$ является реакция с солью бария:
$FeSO_{4} + BaCl_{2} = FeCl_{2} + BaSO_{4}↓$
$Fe^{2+} + SO_{4}^{2-} + Ba^{2+} + 2Cl^{-}$ ⟶ $Fe^{2+} + 2Cl^{-} + BaSO_{4}↓$
$Ba^{2+} + SO_{4}^{2-} ⟶ BaSO_{4}↓$
Практическая работа №3
Вариант 1
В выданных вам трёх пробирках (варианты 1, 2 или 3) содержатся твёрдые вещества, а в трёх других (вариант 4) – растворы веществ.
а) гидроксид натрия;
б) карбонат калия;
в) хлорид бария.
Опытным путём определите, в какой пробирке находится каждое из выданных вам веществ. Напишите уравнения соответствующих реакций в молекулярном и ионном видах.
Ответ:
Распознаем вещества с помощью серной килоты:
а) $2NaOH + H_{2}SO_{4} = Na_{2}SO_{4} + 2H_{2}O$
$2Na^{+} + 2OH^{-} + 2H^{+} + SO_{4}^{2-} ⟶ 2Na^{+} + SO_{4}^{2-} + 2H_{2}O$
$2Na^{+} + SO_{4}^{2-} ⟶ H_{2}O$
В результате реакции нет видимых изменений.
б) $K_{2}CO_{3} + H_{2}SO_{4} = K_{2}SO_{4} + H_{2}O + CO_{2}↑$
$2K^{+} + CO_{3}^{2-} + 2H^{+} + SO_{4}^{2-} ⟶ 2K^{+} + SO_{4}^{2-} + H_{2}O + CO_{2}↑$
$2H^{+} + CO_{3}^{2-} ⟶ H_{2}O + CO_{2}↑$
В результате реакции выделяется бесцветный газ.
в) $BaCl_{2} + H_{2}SO_{4} = 2HCl + BaSO_{4}↓$
$Ba^{2+} + 2Cl^{-} + 2H^{+} + SO_{4}^{2-} ⟶ 2H^{+} + 2Cl^{-} + BaSO_{4}↓$
$Ba^{2+} + SO_{4}^{2-} ⟶ BaSO_{4}↓$
В результате реакции выпадает осадок белого цвета.
Вариант 2
В выданных вам трёх пробирках (варианты 1, 2 или 3) содержатся твёрдые вещества, а в трёх других (вариант 4) – растворы веществ.
а) карбонат кальция;
б) сульфат натрия;
в) хлорид калия.
Опытным путём определите, в какой пробирке находится каждое из выданных вам веществ. Напишите уравнения соответствующих реакций в молекулярном и ионном видах.
Ответ:
а) Карбонат кальция отличим с помощью воды, это соль нерастворимая в воде.
Получим растворы сульфата натрия и хлорида калия:
б) Сульфат отличим с помощью соли бария.
$Na_{2}SO_{4} + BaNO_{3} = 2NaNO_{3} + BaSO_{4}↓$
$2Na^{+} + SO_{4}^{2-} + Ba^{2+} + NO_{3}^{-} ⟶ 2Na^{+} + 2NO_{3}^{-} + BaSO_{4}↓$
$Ba^{2+} + SO_{4}^{2-} ⟶ BaSO_{4}↓$
В результате реакци выпадает осадок белого цвета.
в) $KCl + BaNO_{3}$ ≠
Реакция не идет.
Вариант 3
В выданных вам трёх пробирках (варианты 1, 2 или 3) содержатся твёрдые вещества, а в трёх других (вариант 4) – растворы веществ.
а) нитрат бария;
б) сульфат натрия;
в) карбонат кальция.
Опытным путём определите, в какой пробирке находится каждое из выданных вам веществ. Напишите уравнения соответствующих реакций в молекулярном и ионном видах.
Ответ:
а) $BaNO_{3} + BaCl_{2}$ ≠
Реакция не идет.
б) Сульфат отличим с помощью соли бария.
$Na_{2}SO_{4} + BaCl_{2} ⟶ 2NaCl + BaSO_{4}↓$
$2Na^{+} + SO_{4}^{2-} + Ba^{2+} + 2Cl^{-} ⟶ 2Na^{+} + 2Cl^{-} + BaSO_{4}↓$
$Ba^{2+} + SO_{4}^{2-} ⟶ BaSO_{4}↓$
В результате реакци выпадает осадок белого цвета.
в) Карбонат кальция отличим с помощью воды, это соль нерастворимая в воде. Получим растворы сульфата натрия и нитрата калия.
Вариант 4
В выданных вам трёх пробирках (варианты 1, 2 или 3) содержатся твёрдые вещества, а в трёх других (вариант 4) – растворы веществ.
а) хлорид натрия;
б) хлорид алюминия;
в) хлорид железа (III).
Опытным путём определите, в какой пробирке находится каждое из выданных вам веществ. Напишите уравнения соответствующих реакций в молекулярном и ионном видах.
Ответ:
а) Распознаем вещества с помощью гидроксида натрия:
$NaCl + NaOH$ ≠
Реакция не идет.
б) $AlCl_{3} + 3NaOH ⟶ 3NaCl + Al(OH)_{3}↓$
$Al^{3+} + 3Cl^{-} + 3Na^{+} + 3OH^{-} ⟶ 3Na^{+} + 3Cl^{-} + Al(OH)_{3}↓$
$Al^{3+} + 3OH^{-} ⟶ Al(OH)_{3}↓$
В результате реакции выпал серо−зеленый осадок.
в) $FeCl_{3} + 3NaOH ⟶ 3NaCl + Fe(OH)_{3}↓$
$Fe^{3+} + 3Cl^{-} + 3Na^{+} + 3OH^{-} ⟶ 3Na^{+} + 3Cl^{-} + Fe(OH)_{3}↓$
$Fe^{3+} + 3OH^{-} ⟶ Fe(OH)_{3}↓$
В результате реакции выпал бурый осадок.
Задача 1
Докажите опытным путём, что железный купорос, образец которого вам выдан, содержит примесь сульфата железа (III). Напишите уравнения соответствующих реакций в молекулярном и ионном видах.
Ответ:
Для распознавания ионов железа $Fe^{3+}$ используем желтую кровяную соль:
$2Fe_{2}(SO_{4})_{3} + 3K_{4}[Fe(CN)_{6}] = 6K_{2}SO_{4} + Fe_{4}[Fe(CN)_{6}]_{3}↓$
$4Fe^{3+} + 6SO_{4}^{2-} + 12K^{+} + 3[Fe(CN)_{6}]^{4-}$ ⟶ $12K^{+} + 6SO_{4}^{2-} + Fe_{4}[Fe(CN)_{6}]_{3}↓$
$4Fe^{3+} + 3[Fe(CN)_{6}]^{4-} ⟶ Fe_{4}[Fe(CN)_{6}]_{3}↓$
Задача 2
Получите оксид железа (III), исходя из хлорида железа (III). Напишите уравнения соответствующих реакций, а уравнение реакции с участием электролита и в ионном виде.
Ответ:
Получим оксид железа (III), исходя из хлорида железа (III). Сначала получим гидроксид железа, а затем в реакции разложения получим нужный оксид.
1) $FeCl_{3} + 3NaOH = 3NaCl + Fe(OH)_{3}↓$
$Fe^{3+} + 3Cl^{-} + 3Na^{+} + 3OH^{-} ⟶ 3Na^{+} + 3Cl^{-} + Fe(OH)_{3}↓$
$Fe^{3+} + 3OH^{-} ⟶ Fe(OH)_{3}↓$
2) $2Fe(OH)_{3} = Fe_{2}O_{3} + 3H_{2}O$
Задача 3
Получите раствор алюмината натрия, исходя из хлорида алюминия. Запишите уравнения проделанных реакций в молекулярном и ионном виде.
Ответ:
Получим раствор алюмината натрия, исходя из хлорида алюминия.
Сначала получим гидроксид алюминия, а затем в реакции с гидроксидом натрия получим нужную соль.
1) $AlCl_{3} + 3NaOH = 3NaCl + Al(OH)_{3}↓$
$Al^{3+} + 3Cl^{-} + 3Na^{+} + 3OH^{-} ⟶ 3Na^{+} + 3Cl^{-} + Al(OH)_{3}↓$
$Al^{3+} + 3OH^{-} ⟶ Al(OH)_{3}↓$
2) $Al(OH)_{3} + NaOH = Na[Al(OH)_{4}]$
$Al(OH)_{3} + Na^{+} + OH^{-} ⟶ Na^{+} + [Al(OH)_{4}]^{-}$
$Al(OH)_{3} + OH^{-} ⟶ [Al(OH)_{4}]^{-}$
Задача 4
Получите сульфат железа (II), исходя из железа. Запишите уравнения проделанных реакций и разберите окислительно−восстановительные процессы.
Ответ:
Получим сульфат железа (II), исходя из железа.
$CuSO_{4} + Fe = FeSO_{4} + Cu$
$Cu^{+2} + 2ē ⟶ Cu^{0}$ − окислитель
$Fe^{0} - 2ē ⟶ Fe^{+2}$ − восстановитель

