§30. Фосфор и его соединения
Лабораторный опыт №34
Горение фосфора на воздухе и в кислороде
Наберите в ложечку для сжигания веществ немного красного фосфора и подожгите его. Каков характер пламени? Как изменится пламя, если ложечку с горящим фосфором внести в колбу с кислородом (с этой целью получите его из пероксида водорода, используя оксид марганца (IV))? Запишите уравнение реакции, рассмотрите окислительно−восстановительные процессы.
Ответ:
Горение фосфора на воздухе и в кислороде
Набрали в ложечку для сжигания веществ немного красного фосфора и подожгли его. Красный фосфор горит ярко−желтым пламенем, с выделением белого дыма.
Если ложечку с горящим фосфором внести в колбу с кислородом, то фосфор будет гореть ослепительно ярким пламенем.
$4P + 5O_{2} = 2P_{2}O_{5}$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$P^{0} - 5ē ⟶ P^{+5}$ − восстановитель
Лабораторный опыт №35
Распознавание фосфатов
Налейте в пробирку 1−2 мл раствора фосфата натрия или калия. С помощью пипетки добавьте к нему несколько капель раствора нитрата серебра. Что наблюдаете? Запишите молекулярное и ионное уравнения. Можно ли считать эту реакцию качественной на фосфат−ион? Добавьте к содержимому пробирки азотную кислоту до растворения осадка. Почему это происходит?
Ответ:
Распознавание фосфатов
Налили в пробирку 1−2 мл раствора фосфата натрия. С помощью пипетки добавили к нему несколько капель раствора нитрата серебра.
Наблюдаем образование осадка желтого цвета.
$Na_{3}PO_{4} + 3AgNO_{3} ⟶ 3NaNO_{3} + Ag_{3}PO_{4}↓$
$3Na^{+} + PO_{4}^{3-} + 3Ag^{+} + 3NO_{3}^{-}$ ⟶ $3Na^{+} + 3NO_{3}^{-} + Ag_{3}PO_{4}↓$
$3Ag^{+} + PO_{4}^{3-} ⟶ Ag_{3}PO_{4}↓$
Эту реакцию можно считать качественной на фосфат−ион.
Добавили к содержимому пробирки азотную кислоту до растворения осадка. Это происходит, так как азотная кислота сильнее фосфорной.
$Ag_{3}PO_{4} + 3HNO_{3} ⟶ 3AgNO_{3} + H_{3}PO_{4}$
$Ag_{3}PO_{4} + 3H^{+} + 3NO_{3}^{-} ⟶ 3Ag^{+} + 3NO_{3}^{-} + H^{+} + H_{2}PO_{4}^{-}$
$Ag_{3}PO_{4} + 2H^{+} ⟶ 3Ag^{+} + H_{2}PO_{4}^{-}$
i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Химическая энциклопедия онлайн".
2) Сайт "Science journals".
3) Сайт "Химия и жизнь".
2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Строение атома фосфора
Фосфор − представитель главной подгруппы V группы Периодической системы Д. И. Менделеева элемент−неметалл. Атомы фосфора по сравнению с атомами азота имеют больший радиус, меньшее значение электроотрицательности, а значит, более выраженные восстановительные свойства. Соединения со степенью окисления −3 атома фосфора встречаются реже, чем у азота (только в фосфидах − соединениях фосфора с металлами). Чаще фосфор проявляет в соединениях степень окисления +5. А в его соединении с водородом − ковалентная связь между атомами разных элементов малополярна в силу того, что значения электроотрицательности фосфора и водорода почти одинаковы.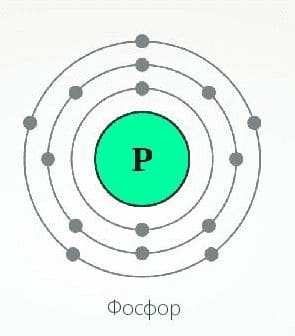
?
1. Напишите формулы трёх видов солей натрия и фосфорной кислоты, назовите их и запишите уравнения их диссоциации.
Ответ:
$Na_{3}PO_{4}$ – фосфат натрия
$Na_{3}PO_{4}$ = $3Na^{+} + PO_{4}^{3-}$
$Na_{2}HPO_{4}$ – гидрофосфат натрия
$Na_{2}HPO_{4}$ = $2Na^{+} + H^{+} + PO_{4}^{3-}$
$NaH_{2}PO_{4}$ – дигидрофосфат натрия
$NaH_{2}PO_{4} = Na^{+} + 2H^{+} + PO_{4}^{3-}$
2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
$P$ $\overset{1}{⟶}$ $Mg_{3}P_{2}$ $\overset{2}{⟶}$ $PH_{3}$ $\overset{3}{⟶}$ $H_{3}PO_{4}$ $\overset{4}{⟶}$ $Na_{3}PO_{4}$ $\overset{5}{⟶}$ $Ca_{3}(PO_{4})_{3}$.
Рассмотрите окислительно−восстановительные процессы там, где они имеют место.
Ответ:
$P$ $\overset{1}{⟶}$ $Mg_{3}P_{2}$ $\overset{2}{⟶}$ $PH_{3}$ $\overset{3}{⟶}$ $H_{3}PO_{4}$ $\overset{4}{⟶}$ $Na_{3}PO_{4}$ $\overset{5}{⟶}$ $Ca_{3}(PO_{4})_{3}$
1) $3Mg + 2P = Mg_{3}P_{2}$
$P^{0} + 3ē ⟶ P^{-3}$ − окислитель
$Mg^{0} - 2ē ⟶ Mg^{+2}$ − восстановитель
2) $Mg_{3}P_{2} + 6H_{2}O = 3Mg(OH)_{2} + 2PH_{3}$↑
3) $PH_{3} + 2O_{2} = H_{3}PO_{4}$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$P^{-3} - 8ē ⟶ P^{+5}$ − восстановитель
4) $H_{3}PO_{4} + 3NaOH = Na_{3}PO_{4} + 3H_{2}O$
5) $2Na_{3}PO_{4} + 3CaCl_{2} = 6NaCl + Ca_{3}(PO_{4})_{2}↓$
3. Используя метод электронного баланса, составьте уравнение реакции, протекающей по схеме:
$P + HNO_{3} + H_{2}O ⟶ H_{3}PO_{4} + NO↑$
Ответ:
$3P + 5HNO_{3} + 2H_{2}O = 3H_{3}PO_{4} + 5NO↑$
$N^{+5} + 3ē ⟶ N^{+2}$ − окислитель
$P^{0} - 5ē ⟶ P^{+5}$ − восстановитель
4. В промышленности фосфор получают прокаливанием смеси фосфата кальция с песком и коксом согласно уравнению:
$Ca_{3}(PO_{4})_{2} + 3SiO_{2} + 5C ⟶ 3CaSiO_{3} + 2P + 5CO↑$.
Рассмотрите окислительно−восстановительные процессы. Придумайте и решите задачу на определение массы фосфора при известном выходе его от теоретически возможного, в условии задачи укажите массу исходного фосфата кальция и долю примесей в нём.
Ответ:
$Ca_{3}(PO_{4})_{2} + 3SiO_{2} + 5C ⟶ 3CaSiO_{3} + 2P + 5CO↑$
$P^{+5} + 5ē ⟶ P^{0}$ − окислитель
$C^{0} - 2ē ⟶ C^{+2}$ − восстановитель
Задача: Определите массу фосфора, который образовался в результате разложения 140 г фосфата кальция, содержащего 13% примесей, если выход продукта составил 90% от теоретически возможного.
Дано:
$m_{техн}$ ($Ca_{3}(PO_{4})_ {2}$) = 120 г
ω (примесей) = 13%, или 0,13
η = 90%
Найти:
m (P) − ?
Решение:
$Ca_{3}(PO_{4})_ {2} + 3SiO_{2} + 5C ⟶ 3CaSiO_{3} + 2P + 5CO↑$
m (примесей) = $m_{техн}$ ($Ca_{3}(PO_{4})_ {2}$) * ω (примесей) = 120 г * 0,13 = 15,6 г
m ($Ca_{3}(PO_{4})_{2}$) = $m_{техн}$ ($Ca_{3}(PO_{4})_ {2}$) − m (примесей) = 120 − 15,6 = 104,4 г
n ($Ca_{3}(PO_{4})_ {2}$) = $\frac{m}{M}$ = $\frac{104,4}{310}$ = 0,34 моль
n (P) = 2 * n ($Ca_{3}(PO_{4})_{2}$) = 2 * 0,34 = 0,68 моль
$m_{теор}$ (P) = n * M = 0,68 * 31 = 21,08 г
$m_{практ}$ (P) = $m_{теор}$ (P) * η = 21,08 * 0,9 = 19 г
Ответ: $m_{практ}$ (P) = 19 г.
5. Расчитайте массу 80%−й фосфорной кислоты, которую можно получить из 31 кг фосфора, содержащего 5% примесей?
Ответ:
Дано:
ω ($H_{3}PO_{4}$) = 80%
$m_{техн}$ (P) = 31 кг
ω (примесей) = 5%
Найти:
m ($H_{3}PO_{4}$) − ?
Решение:
m (примесей) = $m_{техн}$ (P) * ω (примесей) = 31 * 0,05 = 1,55 кг
m (P) = $m_{техн}$ (P) − m (примесей) = 31 − 1,55 = 29,45 кг
n (P) = $\frac{m}{M}$ = $\frac{29,45}{31}$ = 0,95 кмоль
n ($H_{3}PO_{4}$) = n (P) = 0,95 кмоль
m ($H_{3}PO_{4}$) = n * M = 0,95 * 98 = 93 кг
$m_{р-ра}$ = m ($H_{3}PO_{4}$) : ω ($H_{3}PO_{4}$) = 93 : 0,8 = 116 кг
Ответ: m ($H_{3}PO_{4}$) = 116 кг.
6. В 980 г 5%−го раствора фосфорной кислоты растворили 152 г оксида фосфора (V). Вычислите массовую долю фосфорной кислоты в полученном растворе.
Ответ:
Дано:
m (р−ра) = 980 г
ω = 5%
m ($P_{2}O_{5}$) = 152 г
Найти:
$ω_{1}$ ($H_{3}PO_{4}$) − ?
Решение:
$P_{2}O_{5} + 2H_{2}O = 2H_{3}PO_{4}$
n ($P_{2}O_{5}$) = $\frac{m}{M}$ = $\frac{152}{142}$ = 1,07 моль
n ($H_{3}PO_{4}$) = 2 * n ($P_{2}O_{5}$) = 2 * 1,07 = 2,14 моль
$m_{обр}$ ($H_{3}PO_{4}$) = n * M = 2,14 * 98 = 210 г
$m_{1}$ ($H_{3}PO_{4}$) m (р−ра) * ω = 980 * 0,05 = 49 г
$m_{1}$ ($H_{3}PO_{4}$) = $m_{обр}$ ($H_{3}PO_{4}$) + $m_{1}$ ($H_{3}PO_{4}$) = 210 + 49 = 259 г
$m_{2}$ (р−ра) = m (р−ра) + m ($P_{2}O_{5}$) = 980 + 152 = 1132 г
$ω_{1}$ ($H_{3}PO_{4}$) = $m_{1}$ ($H_{3}PO_{4}$) : $m_{2}$ (р−ра) * 100% = 259 : 1132 * 100% = 23%
Ответ: $ω_{1}$ ($H_{3}PO_{4}$) = 23%.
7. "…Да! Это была собака, огромная, чёрная, как смоль. Но такой собаки ещё никто из нас, смертных, не видывал. Из её отверстой пасти вырывалось пламя, глаза метали искры, по морде и загривку мерцал переливающийся огонь. Ни в чьём воспалённом мозгу не могло возникнуть видение более страшное, более омерзительное, чем это адское существо, выскочившее на нас из тумана… Страшный пёс, величиной с молодую львицу. Его огромная пасть всё ещё светилась голубоватым пламенем, глубоко сидящие дикие глаза были обведены огненными кругами. Я дотронулся до этой светящейся головы и, отняв руку, увидел, что мои пальцы тоже засветились в темноте.
– Фосфор, – сказал я".
В этом отрывке из повести "Собака Баскервилей" Л. Конан Дойл допустил существенную химическую ошибку. Назовите её.
Ответ:
Ошибка заключается в том, что светится может только белый фосфор, однако белый фосфор при контакте с кожей легко самовоспламеняется, вызывая серьёзные ожоги.

