§46. Начальные сведения об органических соединениях
?
1. Для этанола верны следующие утверждения:
1) молекула содержит два атома углерода, пять атомов водорода и один атом кислорода
2) молекула содержит два атома углерода, шесть атомов водорода и один атом кислорода
3) это соединение относится к многоатомныем спиртам
4) это соединение относится к одноатомным спиртам
5) плохо растворимо и воде
Ответ:
Для этанола верны следующие утверждения:
1) молекула содержит два атома углерода, пять атомов водорода и один атом кислорода
2) молекула содержит два атома углерода, шесть атомов водорода и один атом кислорода
3) это соединение относится к многоатомныем спиртам
4) это соединение относится к одноатомным спиртам
5) плохо растворимо и воде
Ответ: 2, 4.
Молекула этанола содержит два атома углерода, шесть атомов водорода и один атом кислорода и это соединение относится к одноатомным спиртам.
2. Кислородсодержащими органическими соединениями являются
1) метан
2) этан
3) глицерин
4) хлорметан
5) этанол
Ответ:
Кислородсодержащими органическими соединениями являются
1) метан
2) этан
3) глицерин
4) хлорметан
5) этанол
Ответ: 3, 5.
Кислородсодержащими органическими соединениями являются глицерин и этанол.
3. Для этилена верны следующие утверждения:
1) вступает в реакции полимеризации
2) вступает в реакции замещения
3) гидролизуется
4) вступает в реакции присоединения
5) дает качественную реакцию со свежеполученным $Ca(OH)_{2}$
Ответ:
Для этилена верны следующие утверждения:
1) вступает в реакции полимеризации
2) вступает в реакции замещения
3) гидролизуется
4) вступает в реакции присоединения
5) дает качественную реакцию со свежеполученным $Ca(OH)_{2}$
Ответ: 1, 4.
Этилен вступает в реакции полимеризации и вступает в реакции присоединения.
4. Две и более функциональные группы содержат молекулы:
1) этилена
2) глицерина
3) глицина
4) этана
5) этанола
Ответ:
Две и более функциональные группы содержат молекулы:
1) этилена
2) глицерина
3) глицина
4) этана
5) этанола
Ответ: 2, 3.
Две и более функциональные группы содержат молекулы глицерина и глицина.
5. Раствор $KMnO_{4}$, обесцвечивают
1) оливковое масло
2) этан
3) уксусная кислота
4) этиловый спирт
5) этилен
Ответ:
Раствор $KMnO_{4}$, обесцвечивают
1) оливковое масло
2) этан
3) уксусная кислота
4) этиловый спирт
5) этилен
Ответ: 1, 5.
Раствор $KMnO_{4}$, обесцвечивают оливковое масло, этилен.
6. Гидролизу подвергаются
1) жиры
2) глюкоза
3) уксусная кислота
4) глицерин
5) белки
Ответ:
Гидролизу подвергаются
1) жиры
2) глюкоза
3) уксусная кислота
4) глицерин
5) белки
Ответ: 1, 5.
Гидролизу подвергаются жиры и белки.
7. Реакции полимеризации относится к реакциям
1) горения
2) присоединения
3) замещения
4) обмена
5) соединения
Ответ:
Реакции полимеризации относится к реакциям
1) горения
2) присоединения
3) замещения
4) обмена
5) соединения
Ответ: 2, 5.
Реакции полимеризации относится к реакциям присоединения, соединения.
8. Степени окисления и валентности атомов химических элементов численно равны в молекулах
1) этилена
2) этана
3) метана
4) хлорметана
5) углекислого газа
Ответ:
Степени окисления и валентности атомов химических элементов численно равны в молекулах
1) этилена
2) этана
3) метана
4) хлорметана
5) углекислого газа
Ответ: 3, 4, 5.
Степени окисления и валентности атомов химических элементов численно равны в молекулах метана, хлорметана, углекислого газа.
9. И соляная, и уксусная кислоты взаимодействуют
1) с медью, магнием и цинком
2) с оксидом, гидроксидом и карбонатом кальция
3) с водородом, кислородом и хлором
4) с водой, спиртом, щелочью
5) с гидроксидом натрия, магния и алюминия
Ответ:
И соляная, и уксусная кислоты взаимодействуют
1) с медью, магнием и цинком
2) с оксидом, гидроксидом и карбонатом кальция
3) с водородом, кислородом и хлором
4) с водой, спиртом, щелочью
5) с гидроксидом натрия, магния и алюминия
Ответ: 2, 5.
И соляная, и уксусная кислоты взаимодействуют с оксидом, гидроксидом и карбонатом кальция и с гидроксидом натрия, магния и алюминия.
10. Для белков верны следующие утверждения:
1) гидролизуются с образованием молекул углекислого газа и воды
2) гидролизуются с образованием молекул аминокислот
3) являются природными полимерами, образованными взаимодействием множества молекул карбоновых кислот
4) являются природными полимерами, образованными взаимодействием множества молекул аминокислот
5) горят с образованием углекислого газа и воды
Ответ:
Для белков верны следующие утверждения:
1) гидролизуются с образованием молекул углекислого газа и воды
2) гидролизуются с образованием молекул аминокислот
3) являются природными полимерами, образованными взаимодействием множества молекул карбоновых кислот
4) являются природными полимерами, образованными взаимодействием множества молекул аминокислот
5) горят с образованием углекислого газа и воды
Ответ: 2, 4.
Белки гидролизуются с образованием молекул аминокислот и являются природными полимерами, образованными взаимодействием множества молекул аминокислот.
ПРОЕКТНАЯ ДЕЯТЕЛЬНОСТЬ
1. Периодический закон и Периодическая система в учебниках различных стран.
Ответ:
Тема проекта: Периодический закон и Периодическая система в учебниках различных стран.
Цель: изучить Периодический закон и Периодическую систему в учебниках различных стран и выяснить сходства и различия.
Задачи:
1) Выяснить, что такое Периодический закон.
2) Изучить Периодические системы в учебниках разных стран.
Гипотеза исследования: Периодический закон и Периодическая система в учебниках различных стран отличаются друг от друга.
План исследования:
1) Что такое таблица Д. И. Менделеева.
2) Периодический закон.
3) Периодическая система химических элементов в России.
4) Периодическая система химических элементов в США.
Исследование:
Таблица Д. И. Менделеева демонстрирует, что все химические элементы, образующие вещества окружающего нас мира, взаимосвязаны и подчиняются закономерностям, т.е. представляют собой единую систему химических элементов. Поэтому в современной науке таблицу Д. И. Менделеева называют Периодической системой химических элементов. Используется понятие «периодическая», так как общие закономерности в изменении свойств атомов, простых и сложных веществ, образованных химическими элементами, повторяются в этой системе через определённые интервалы − периоды.
Таким образом, все существующие в мире химические элементы подчиняются единому, объективно действующему в природе Периодическому закону, графическим отображением которого и является Периодическая система элементов. Этот закон и система носят имя великого русского химика Д. И. Менделеева.
Д. И. Менделеев пришёл к открытию Периодического закона, проведя сопоставление свойств и относительных атомных массе химических элементов. Для этого Д. И. Менделеев для каждого химического элемента на карточке записал: символ элемента, значение относительной атомной массы (во времена Д. И. Менделеева эту величину назвали атомным весом), формулы и характер высшего оксида и гидроксида. Он расположил 63 известных к тому времени химических элемента в одну цепочку в порядке возрастания их относительных атомных масс и проанализировал эту совокупность элементов.
Периодическая система химических элементов Д. И. Менделеева в России: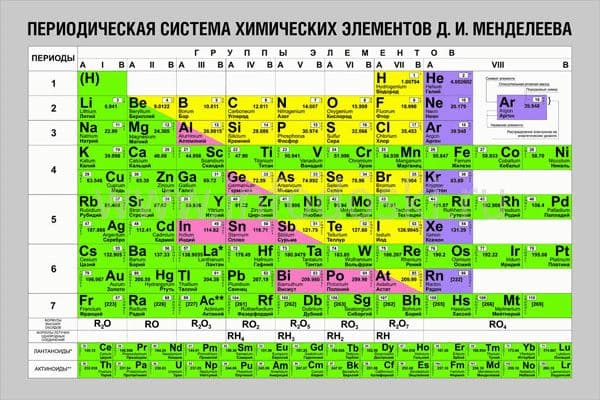
Периодическая система химических элементов Д. И. Менделеева в США: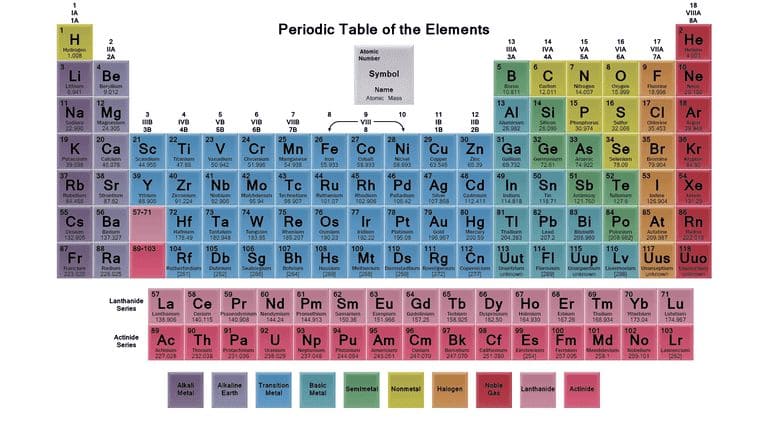
Выводы: Периодический закон и Периодическая система Д. И. Менделеева в учебниках разных стран одинакова, различия лишь в оформлении и языке.
Список литературы:
1) Сайт "Инфоурок".
2) Барагузина, В.В. Общая и неорганическая химия: Учебное пособие / В.В. Барагузина, И.В. Богомолова, Е.В. Федоренко. − М.: ИЦ РИОР, 2017. − 272 c.
3) Богомолова, И.В. Неорганическая химия: Учебное пособие / И.В. Богомолова. − М.: Альфа−М, НИЦ ИНФРА−М, 2016. − 336 c.
2. «Периодическому закону будущее не грозит разрушением...»
Ответ:
Тема проекта: «Периодическому закону будущее не грозит разрушением...»
Цель: изучить Периодический закон и рассмотреть его развитие в будущем.
Задачи:
1) Выяснить, что такое Периодический закон.
2) Выяснить значение Периодического закона.
Гипотеза исследования: Периодический закон играет огромную роль в развитии химии.
План исследования:
1) Таблица Д. И. Менделеева.
2) Периодический закон.
3) Значение ПСХЭ Д. И. Менделеева.
4) Значение Периодического закона.
Исследование:
Все существующие в мире химические элементы подчиняются единому, объективно действующему в природе Периодическому закону, графическим отображением которого и является Периодическая система элементов. Этот закон и система носят имя великого русского химика Д. И. Менделеева.
Д. И. Менделеев пришёл к открытию Периодического закона, проведя сопоставление свойств и относительных атомных масе химических элементов. Для этого Д. И. Менделеев для каждого химического элемента на карточке записал: символ элемента, значение относительной атомной массы (во времена Д. И. Менделеева эту величину назвали атомным весом), формулы и характер высшего оксида и гидроксида. Он расположил 63 известных к тому времени химических элемента в одну цепочку в порядке возрастания их относительных атомных масс и проанализировал эту совокупность элементов, пытаясь найти в ней определенную закономерности. В результате напряженного творческого труда он обнаружил, что в этой цепочке имеются интервалы − периоды, в котоых свойства элементов и образованных ими веществ изменяются сходным образом.
Систематизируя химические элементы на основе их относительных атомных масс, Д. И. Менделеев уделял большое внимание также свойствам элементов и образованных ими веществ, распределяя элементы со сходными свойствами в вертикальные столбцы − группы. Иногда в нарушение выявленной им закономерности он ставил более тяжелые элементы перед элементами с меньшими значениями относительных атомных масс.
Например, он записал в свою таблицу кобальт перед никелем, теллур перед йодом, а когда были открыты инертные (благородные) газы, аргон − перед калием.
Такой порядок расположения Д. И. Менделеев считал необходимым потому, что иначе эти элементы попали бы в группы несходных с ними по свойствам элементов.
Так, в частности, щелочной металл калий попал бы в группу инертных газов, а инертный газ аргон − в группу щелочных металлов
Благодаря Периодической системе Д.И.Менделеева:
1) сложилось современное понятие о химическом элементе;
2) были уточнены представления о простых веществах и соединениях;
3) появление Периодической системы открыло новую, научную эру в истории химии и ряде смежных наук, появилась стройная система, на основе которой стало возможным обобщать, делать выводы, предвидеть;
4) подтвердились наиболее общие законы развития природы;
5) данные легли в основу решения современных задач химической науки и промышленности;
6) она стала основой для естествознания и для многих других наук.
Периодический закон:
1) обобщил большое число природных закономерностей;
2) в таблицу, графически представляющую закон, включаются не только все известные элементы, но и те, которые открывают до сих пор;
3) все новые открытия не повлияли на актуальность закона и таблицы;
4) таблица совершенствуется и изменяется, но ее суть осталась неизменной;
5) позволил уточнить атомные веса и другие характеристики некоторых элементов, предсказать существование новых элементов;
6) химики получили надежную подсказку, как и где искать новые элементы − это послужило научной базой прогнозирования в химии;
7) позволяет с высокой долей вероятности заранее определять свойства еще неоткрытых элементов;
8) сыграл огромную роль в развитии неорганической химии в 19−м веке;
9) основа современной химии. Химия стала единой целостной наукой. Перестала быть описательной наукой;
10) его открытие дало мощнейший толчок в развитии физических и химических знаний;
11) были разработаны теории строения атома и химической связи.
Выводы: Периодический закон имеет огромное значение в мире химии, поэтому со времен его актуальность не теряется.
Список литературы:
1) Сайт "School science".
2) Сайт "Pandia".
3) Барагузина, В.В. Общая и неорганическая химия: Учебное пособие / В.В. Барагузина, И.В. Богомолова, Е.В. Федоренко. − М.: ИЦ РИОР, 2017. − 272 c.
4) Богомолова, И.В. Неорганическая химия: Учебное пособие / И.В. Богомолова. − М.: Альфа−М, НИЦ ИНФРА−М, 2016. − 336 c.
3. Аллотропия металлов.
Ответ:
Тема проекта: Аллотропия металлов.
Цель: изучить понятие аллотропии.
Задачи:
1) Выяснить, что такое аллотропия.
2) Выяснить значение аллотропии.
Гипотеза исследования: для некоторых металлов характерна аллотропия.
План исследования:
1) Понятие аллотропии.
2) Аллотропия металлов.
3) Пример аллотропии олова.
Исследование:
Аллотропией, или полиморфизмом, называют способность металла в твердом состоянии иметь различные кристаллические формы. Процесс перехода из одной кристаллической формы в другую называют аллотропическим превращением. При нагреве чистого металла такое превращение сопровождается поглощением тепла и происходит при постоянной температуре, что связано с необходимостью затраты определенной энергии на перестройку кристаллической решетки. Аллотропические превращения имеют многие металлы: железо, олово, титан и др.
Характерным примером является аллотропия олова. При температуре ниже 18 °С устойчива модификация α−олова (Snα), называемая серым оловом, а выше 18 °С – модификация β−олова (Snβ), называемая белым оловом.
Решетка белого олова более компактна, чем серого олова, и превращение Snβ → Snα идет со значительным увеличением объема. Поэтому при образовании на белом олове бугорка серого олова последнее, вследствие больших объемных изменений, рассыпается в порошок. Это явление получило название «оловянной чумы», превращение необратимо.
Выводы: Основной причиной полиморфных или аллотропических превращений является стремление любого вещества обладать минимальным запасом свободной энергии. Если у металла при достижении какой−то определенной температуры изменение типа кристаллической решетки обеспечивает уменьшение запаса свободной энергии, то такой металл претерпевает полиморфное превращение.
Список литературы:
1) Сайт "Stud files".
2) Барагузина, В.В. Общая и неорганическая химия: Учебное пособие / В.В. Барагузина, И.В. Богомолова, Е.В. Федоренко. − М.: ИЦ РИОР, 2017. − 272 c.
3) Богомолова, И.В. Неорганическая химия: Учебное пособие / И.В. Богомолова. − М.: Альфа−М, НИЦ ИНФРА−М, 2016. − 336 c.
4. Аморфные вещества и материалы в природе, технике и быту.
Ответ:
Тема проекта: Аморфные вещества и материалы в природе, технике и быту.
Цель: изучить применение аморфных веществ и материалов в природе, технике и быту.
Задачи:
1) Выяснить, что такое аморфные вещества.
2) Рассмотреть сферы применения аморфных веществ.
Гипотеза исследования: Аморфные вещества и материалы имеют огромный спектр применения.
План исследования:
1) Аморфные и твердые вещества.
2) Использование аморфных тел в медицине.
3) Аморфные тела в метрологии.
4) Полимеры.
Основная часть:
Твердые тела можно разделить на две группы, которые существенно отличаются по своим свойствам. Одну группу образуют кристаллические тела, другую – аморфные. В природе аморфные тела встречаются значительно реже по сравнению с кристаллическими. Некоторые вещества при одних условиях можно получить в аморфном состоянии, при других – в кристаллическом. Например, расплавлением кристаллов кварца и последующим их охлаждением можно легко добыть аморфное кварцевое стекло. Степень упорядоченности аморфного тела во многом зависит от технологии его образования.
Использование аморфных веществ наиболее активно осуществляется в области медицины. Многие люди получили возможность самостоятельно передвигаться после тяжелых травм. Дело в том, что вещество аморфной структуры является отличным биоматериалом для имплантации в кости. Полученные специальные винты, пластины, штифты, штифты вставляются в случае серьезных переломов. Ранее в хирургии для таких целей использовались сталь и титан. Только позже было замечено, что аморфные вещества очень медленно разлагаются в организме, и это удивительное свойство позволяет восстановить костную ткань. Впоследствии вещество заменяется костью.
Точная механика основана именно на точности, и поэтому ее так и называют. Особенно важную роль в этой отрасли, а также в метрологии играют ультраточные индикаторы измерительных приборов, которые могут быть достигнуты при использовании аморфных тел в приборах. Благодаря точным измерениям в институтах в области механики и физики проводятся лабораторные и научные исследования, получены новые лекарства и улучшены научные знания.
Другим примером использования аморфных веществ являются полимеры. Они могут медленно переходить из твердого состояния в жидкость, в то время как кристаллические полимеры характеризуются температурой плавления, а не температурой размягчения. Каково физическое состояние аморфных полимеров? Если эти вещества обеспечить низкой температурой, можно заметить, что они будут в стеклообразном состоянии и будут проявлять свойства твердых веществ. Постепенный нагрев помогает полимерам начать переходить в состояние повышенной упругости.
Выводы: Аморфные вещества, благодаря их уникальным свойствам, имеют широкое применение в различных сферах жизнедеятельности.
Список литературы:
1) Золотухин И. В. Физические свойства аморфных металлических материалов. М.: Металлургия, 1986. 176 с.
2) Б. В.Некрасов, Основы общей химии, М.:Химия, 1973.
3) Барагузина, В.В. Общая и неорганическая химия: Учебное пособие / В.В. Барагузина, И.В. Богомолова, Е.В. Федоренко. − М.: ИЦ РИОР, 2017. − 272 c.
4) Богомолова, И.В. Неорганическая химия: Учебное пособие / И.В. Богомолова. − М.: Альфа−М, НИЦ ИНФРА−М, 2016. − 336 c.
5. Минералы и горные породы как основа литосферы.
Ответ:
Тема проекта: Минералы и горные породы как основа литосферы.
Цель: изучить минералы и горные породы.
Задачи:
1) Выяснить, что такое минералы и горные породы.
2) Рассмотреть строение литосферы.
Гипотеза исследования: Минералы и горные породы входят в состав литосферы.
План исследования:
1) Что такое геосфера.
2) Понятие литосферы.
3) Строение литосферы.
4) Горные породы.
Исследование:
Геосферы − географические концентрические оболочки (сплошные или прерывистые), из которых состоит планета Земля.
Выделяются следующие геосферы: атмосфера, гидросфера, литосфера, земная кора, мантия и ядро Земли. Ядро Земли делится на внешнее ядро (жидкое) и центральное − субъядро (твёрдое).
Литосферой называют твердую земную оболочку, которая полностью покрывает планету, защищая ее от достигающей 60000 °С температуры раскаленного ядра. Литосфера расположена между атмосферой и гидросферой сверху и астеносферой снизу. Толщина твердой оболочки Земли не однородна, и на различных участках составляет от десятков до нескольких сотен километров.
К литосфере относятся: земная кора, переходный слой и самый верхний, вязкий слой мантии. Литосфера, о которой мы ведем сейчас речь — это всего лишь около 1% от радиуса земли, но именно этот 1% позволяет существовать жизни на планете.
Земная кора — самый верхний слой литосферы. В неоднородности земной коры можно убедиться, стоя на берегу и глядя на обрыв скромной реки, где слои различных пород находятся друг над другом. Найденные при раскопках полезные ископаемые (нефть, газ, железная руда, алмазы) рассказывают ученым о процессах, происходящих на планете миллионы лет назад. Земная кора — не только самый верхний слой литосферы, но и самый тонкий — ее размер составляет от 80 километров на горных участках планеты до 30 км на равнинных. По типу земная кора делится на океаническую и материковую. Такое деление характерно только для Земли, на остальных планетах такого разделения нет, если верить показаниям космических зондов и планетоходов. В коре материкового типа выделяют три слоя пород: осадочный — сформирован породами осадочного и вулканического происхождения; гранитный — сформирован породами метаморфического горного происхождения, которые представлен кварцем и полевым шпатом; базальтовый — в формировании участвовали магматические породы. Океаническая кора состоит из осадочного и базальтового слоев. Под земной корой, в точности повторяя ее очертания, и отделяя ее от мантии, расположен пограничный слой.
Расположение горных пород в земной коре зависят от их происхождения. По происхождению различают магматические, метаморфические и осадочные породы.
Магматические горные породы – это породы, образовавшиеся из магмы при её остывании и затвердевании.
Осадочные породы – это породы, образующиеся при осаждении и отложении различного обломочного материала.
Метаморфические породы образуются из магматических или осадочных при существенном изменении их минерального состава и структуры под воздействием высоких температур, большого давления и высокотемпературных водных растворов.
Выводы: Согласно научным исследованиям, учёным удалось установить, что литосфера состоит из:
Кислорода – 49%;
Кремния – 26%;
Алюминия – 7%;
Железа – 5%;
Кальция – 4%
В состав литосферы входит немало минералов, самые распространённые – шпат и кварц.
Список литературы:
1) Сайт "Ros uhebnik".
2) Барагузина, В.В. Общая и неорганическая химия: Учебное пособие / В.В. Барагузина, И.В. Богомолова, Е.В. Федоренко. − М.: ИЦ РИОР, 2017. − 272 c.
3) Богомолова, И.В. Неорганическая химия: Учебное пособие / И.В. Богомолова. − М.: Альфа−М, НИЦ ИНФРА−М, 2016. − 336 c.
6. Исследование жёсткости воды и способы её устранения.
Ответ:
Тема проекта: Жесткость воды и способы ее устранить.
Цель: исследовать жесткость воды и способы ее устранения.
Задачи:
1) Выяснить, что такое жесткость воды.
2) Рассмотреть способы устранения жесткости воды.
Гипотеза исследования: Жесткость воды можно регулировать.
План исследования:
1) Мягкая и жесткая вода.
2) Временная и постоянная жесткость воды.
3) Мыла.
4) Способы изменение жесткости воды.
Исследование:
Вода, прежде чем попасть в колодец или водопроводную сеть, просачивается сквозь почву и насыщается в ней растворимыми солями.
Природные воды содержат сульфаты и бикарбонаты кальция и магния, т.е. катионы $Ca^{2+}$ и $Mg^{2+}$, анионы $SO_{4}^{2-}$ и $HCO_{3}^{-}$. Вода, в которой содержание ионов $Ca^{2+}$ и $Mg^{2+}$ незначительно, называется мягкой, вода с повышенным содержанием их − жесткой.
При кипячении жесткой воды бикарбонаты разлагаются, образуя нерастворимые карбонаты, например:
$Ca^{2+} + 2HCO_{3}^{-} = CaCO_{3}↓ + H_{2}O + CO_{2}↑$
Карбонаты осаждаются, и жесткость воды уменьшается. Жесткость, вызываемая содержанием в воде бикарбонатов кальция и магния, называется карбонатной или временной. Жесткость, обусловленная присутствием прочих солей кальция и магния и сохраняющаяся после кипячения воды, называется некарбонатной или постоянной.
Широко известно, что в жесткой воде мыло плохо мылится. Изучим это явление на опыте, взяв в качестве искусственной жесткой воды, например, раствор гипса. Нальем в бюретку разбавленный раствор мыла и будем приливать его понемногу, порция за порцией, к жесткой воде, сильно встряхивая после каждого приливания стакан с жесткой водой. Первые порции мыла будут затрачиваться на образование хлопьевидного осадка, и пены при встряхивании получаться не будет. Только после того, как прекратится образование осадка, появится пена.
Мыла − это натриевые (иногда калиевые) соли органических кислот, и их состав можно условно выразить формулой NaR или KR, где R − кислотный остаток. Анионы R− образуют с катионами кальция и магния нерастворимые соли $CaR_{2}$ и $MgR_{2}$. На образование этих нерастворимых солей и расходуется бесполезно мыло. Таким образом, при помощи мыльного раствора мы можем оценить общую жесткость воды, общее содержание в ней ионов кальция и магния.
Для хозяйственно−бытовых нужд требуется вода с незначительной жесткостью. При кипячении жесткой воды образуется накипь. В жесткой воде плохо развариваются мясо, овощи, крупа. При стирке тканей жесткой водой образующиеся нерастворимые соединения осаждаются на поверхности нитей и постепенно разрушают волокна.
При питании паровых котлов жесткой водой образуется накипь. Накипь затрудняет нагревание воды, вызывает увеличение расхода топлива, ускоряет изнашивание стенок котла.
Для понижения жесткости воды применяют различные методы. Перед направлением в паровой котел воду предварительно нагревают, чем устраняют временную жесткость. Для питания котлов высокого давления в настоящее время часто применяют перегнанную (дистиллированную) воду. Для понижения жесткости воды используют химические методы, приводящие к переводу ионов кальция и магния в состав нерастворимых солей, обычно в карбонаты.
Карбонатную жесткость устраняют добавлением известкового молока:
$Ca(HCO_{3})_{2} + Ca(OH)_{2} = 2CaCO_{3}↓ + 2H_{2}O$
Некарбонатная жесткость устраняется добавкой соды:
$CaSO_{4} + Na_{2}CO_{3} = CaCO_{3}↓ + Na_{2}SO_{4}$
Природную воду, содержащую ионы кальция $Ca^{2+}$ и магния $Mg^{2+}$, можно смягчить, освободить от этих ионов, заменив их, например, ионами натрия, при помощи ионообмена. Для этого воду на станциях водоочистки пропускают через ионнообменную колонку с катионитом, содержащим подвижные ионы $Na^{+}$.
Выводы: Жёсткую воду перед употреблением целесообразно умягчить. Наша вода, применяемая для питья, легко умягчается кипячением.
Вода, поступающая в стиральные, посудомоечные машины, в газовые котлы для отопления, обязательно должна умягчаться специальными химическими фильтрами.
При стирке белья в стиральной машине необходимо добавлять в стиральный порошок средства для умягчения воды.
Список литературы:
1) В. И. Аксенов, Химия воды; Аналитическое обеспечение лабораторного практикума, 2014 г, 142
2) Барагузина, В.В. Общая и неорганическая химия: Учебное пособие / В.В. Барагузина, И.В. Богомолова, Е.В. Федоренко. − М.: ИЦ РИОР, 2017. − 272 c.
3) Богомолова, И.В. Неорганическая химия: Учебное пособие / И.В. Богомолова. − М.: Альфа−М, НИЦ ИНФРА−М, 2016. − 336 c.с.
7. Оксиды и соли как строительные материалы.
Ответ:
Тема проекта: Оксиды и соли как строительные материалы.
Цель: изучить оксиды и соли и их применение в качестве строительных материалов.
Задачи:
1) Выяснить, что такое оксиды и соли.
2) Рассмотреть способы их использования в строительстве.
Гипотеза исследования: оксиды и соли обладают свойствами исключительно важными в строительстве.
План исследования:
1) Что такое соли.
2) Что такое оксиды.
3) Строительные материалы.
Исследование:
Соли − это сложные вещества, молекулы которых состоят из атомов металла и кислотного остатка.
Карбонат кальция не растворим в воде, и является основой всех природных камней, в частности известняка и мрамора. Сульфат кальция, или гипс, и сульфат магния являются прекрасными вяжущими веществами. Однако при контакте с кислотами они превращаются в легко растворимые в воде соли, что может привести к существенным проблемам, таким как откалывание или намывание материала.
Оксиды − это сложные вещества, состоящие из двух химических элементов, одним из которых является кислород.
Оксид кремния (IV) $SiO_{2}$ в виде кварцевого песка используется в производстве стекла и бетона. Вместе с оксидом свинца (II) PbO он применяется для изготовления полудрагоценных камней и украшений ( «кристаллы Сваровски»). Оксид кальция CaO под названием «негашеная известь» применяют при изготовлении различных строительных материалов. Оксиды некоторых других металлов находят применение в производстве красок.
К строительным материалам, которые создаются на основе природных оксидов и солей, относятся:
1) керамические материалы
2) вяжущие строительные матералы
3) стекло.
Вяжущие строительные материалы представляют собой вещества или смеси веществ, способные при смешивании с водой образовывать вязкую массу.
Выводы: Оксиды и соли обладают вяжущими, сцепляющими свойвами, что важно в строительстве.
Список литературы:
1) Сайт "Impoled".
2) Сайт "Infourok".
3) Барагузина, В.В. Общая и неорганическая химия: Учебное пособие / В.В. Барагузина, И.В. Богомолова, Е.В. Федоренко. − М.: ИЦ РИОР, 2017. − 272 c.
4) Богомолова, И.В. Неорганическая химия: Учебное пособие / И.В. Богомолова. − М.: Альфа−М, НИЦ ИНФРА−М, 2016. − 336 c.
8. Многоликий карбонат кальция: в природе, промышленности и быту.
Ответ:
Тема проекта: Многоликий карбонат кальция: в природе, промышленности и быту.
Цель: изучить применение карбоната кальция.
Задачи:
1) Рассмотреть особенности карбоната кальция.
2) Рассмотреть способы его применения.
Гипотеза исследования: карбонат кальция имеет широкий спектр применения.
План исследования:
1) Физические свойства карбоната кальция.
2) Карбонат кальция в быту.
3) Применение в пищевой промышленности.
4) Карбонат кальция в сельском хозяйстве.
Исследование:
Карбонат кальция (обычное название − кальцит) состоит из солей угольной кислоты и кальция.
Производители и любители домашнего вина используют $CaCO_{3}$ в критических ситуациях, когда сусло или конечный продукт слишком кислые и непригодны для употребления. После добавления небольшого количества карбоната кальция вино приобретает свой отчетливый естественный вкус.
В пищевой промышленности карбонат кальция известен как добавка Е170. Среди прочего, используется для приготовления кондитерских изделий, жевательных резинок, некоторых видов хлебобулочных изделий, чипсов и печенья.
Реакция получения карбоната кальция относительно проста, быстра и экономична, поэтому $CaCO_{3}$ также находит применение в косметической промышленности. Белый сухой порошок используют для изготовления пудр, присыпок, теней для век или косметических основ. Ввиду своего отбеливающего эффекта карбонат кальция также является очень распространенным ингредиентом зубных паст.
Карбонат кальция широко используют в сельском хозяйстве и животноводстве − известковое удобрение удобряет бесплодную почву, а смеси с добавлением Calcium Carbonate прекрасно дополняют рацион животных. Содержание карбоната кальция в почве − это показатель, который многое говорит о качестве почвы − чем меньше в ней содержится карбоната кальция, тем менее плодороден и стабилен грунт.
Выводы: Очищенный от примесей, карбонат кальция широко используется в бумажной и пищевой промышленности, в качестве наполнителя при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве.
Список литературы:
1) Сайт "Studwork".
2) Общая и неорганическая химия: учебное пособие / Под ред. Денисова В.В., Таланова В.М.. − Рн/Д: Феникс, 2018. − 144 c.
3) Барагузина, В.В. Общая и неорганическая химия: Учебное пособие / В.В. Барагузина, И.В. Богомолова, Е.В. Федоренко. − М.: ИЦ РИОР, 2017. − 272 c.
4) Богомолова, И.В. Неорганическая химия: Учебное пособие / И.В. Богомолова. − М.: Альфа−М, НИЦ ИНФРА−М, 2016. − 336 c.
9. Виртуальное моделирование различных химических производств.
Ответ:
Тема проекта: Виртуальное моделирование различных химических производств.
Цель: Рассмотреть виртуальное моделирование в химическом производстве.
Задачи:
1) Рассмотреть принцип химического производства.
2) Представить модель химического производства.
Гипотеза исследования: Виртуальное моделирование быстро развивается и дает новые возможности для развития химии.
План исследования:
1) Развитие цифровых технологий.
2) Цифровой двойник.
3) Типы цифровых двойников.
Исследование:
B настояшее время, когда интенсивно развиваются цифровые технологии, растет степень использования компьютерных разработок на существующих промышленных предприятиях и производствах.
Цифровой двойник − это динамическая виртуальная копия физической сущности или процесса в реальном времени, которая используется для понимания, изучения и обновления процессов производства.
В настоящее время единого определения термина «Цифровой двойник»
нет. Однако, чаще всего так именуют цифровую копию живой или неживой физической сущности, представляющей собой динамическую модель в виртуальном мире, которая идентична своему физическому объекту в реальном мире, с возможностью моделирования и пародирования всего жизненного цикла, своиств и производительности.
Существует несколько типов цифровых двойников, три основных из них
приведены ниже:
1) Модель содержит информационные наборы, необходимые для описания и создания физической версии. Эти цифровые наборы включают в себя, но не ограничиваются требованиями, спецификациями процессов и услуг, регламентом.
2) Двойник описывает конкретный физический объект, с которым он напрямую связан, на протяжении всего срока службы продукта. Этот тип двойника может содержать в зависимости от способов использования следующие наборы данных: 3D модели, описывающие геометрию и физические свойства объектов, список операций, выполненных при создании этого физического объекта, вместе с результатами измерений или испытаний над экземпляром, а также рабочее состояние, полученное с помощью датчиков.
3) К этому типу относят объединение ранее указанных типов двойников. Он имеет доступ ко всем прототипам и может запрашивать информацию обо всех объектах. Также данный цифровой двойник постоянно мониторит показания датчиков и сопоставляет данные показания с теми, которые зафиксировал во время сбоя.
Создаваемое нами виртуальное пространство цифрового двойника, есть ничто иное, как 3D модель описывающая технологию и все основные процессы в химическом производстве. Цифровой двойник, разрабатывается путем выполнения большого числа операций, благодаря которым удается создать копию химического производства с учетом технологических норм, регламента и спецификации.
Выводы: При помощи подобных виртуальных тренажеров, базирующихся на
основе цифровых реальных производств, сотрудники могут полностью освоить сущность всех протекающих процессов, ознакомиться с технологией, а также приобрести соответствующую квалификацию, без угрозы при этом для исправности оборудования и здоровья сотрудников.
Список литературы:
1) Сайт "School science".
2) Барагузина, В.В. Общая и неорганическая химия: Учебное пособие / В.В. Барагузина, И.В. Богомолова, Е.В. Федоренко. − М.: ИЦ РИОР, 2017. − 272 c.
3) Богомолова, И.В. Неорганическая химия: Учебное пособие / И.В. Богомолова. − М.: Альфа−М, НИЦ ИНФРА−М, 2016. − 336 c.
10. Исследование туалетного мыла различных торговых марок.
Ответ:
Тема проекта: Исследование туалетного мыла различных торговых марок.
Цель: изучить состав и применение мыла.
Задачи:
1) Выяснить, что входит в состав мыла.
2) Рассмотреть мыла разных торговых марок.
Гипотеза исследования: мыла разных торговых марок имеют различный состав.
План исследования:
1) Что в ходит в состав мыла.
2) Способ применения мыла.
3) Получение мыла.
4) Состав мыла разных торговых марок.
Основная часть:
В химическом отношении основным компонентом твердого мыла является смесь растворимых солей высших жирных кислот. Обычно это натриевые, реже − калиевые и аммониевые соли таких кислот, как стеариновая, пальмитиновая, миристиновая, лауриновая и олеиновая.
Дополнительно в составе мыла могут быть и другие вещества, обладающие моющим действием, а также ароматизаторы, красители и порошки. Также в мыло часто добавляют бактерициды (антибиотики). Они помогают убить микробов, однако получается так, что эти соединения в составе мыла часто приносят больше вреда, чем пользы.
Например, триклозан убивает не всех микробов, «выживают» при действии бактерицида, как правило, самые устойчивые бактерии, которые оказываются способными вызвать у человека различные заболевания.
Для того чтобы сделать руки по−настоящему стерильными, следует использовать теплую воду и хозяйственное мыло, а не бактерициды. В качестве сырья для получения основного компонента мыла могут использоваться животные и растительные жиры, жирозаменители (синтетические жирные кислоты, канифоль, нафтеновые кислоты, талловое масло).
Получение мыла основано на реакции омыления − гидролиза сложных эфиров жирных кислот (в частности жиров) со щелочами, в результате которого образуются соли щелочных металлов и спирты.
В специальных емкостях (варочных котлах) нагретые жиры омыляют едкой щелочью (обычно гидроксидом натрия). В результате реакции в варочных котлах образуется однородная вязкая жидкость, густеющая при охлаждении, − мыльный клей, состоящий из мыла и глицерина. Содержание жирных кислот в мыле, полученном непосредственно из мыльного клея, составляет обычно 40−60 %. Такой продукт называется «клеевое мыло».
Химический состав туалетного мыла «Весна»:
1) натриевые соли жирных кислот пищевых жиров, пальмового и кокосового масел;
2) вода;
3) парфюмерная композиция;
4) хлорид натрия;
5) гидроксид натрия;
6) антал П−2;
7) диоксид титана;
8) синтетический краситель красного цвета.
Химический состав туалетного мыла Дивный сад «Лимон»:
1) натриевые соли жирных кислот животных жиров и растительных масел;
2) вода;
3) парфюмерная композиция;
4) диоксид титана;
5) динатриевая соль ЭДТА;
6) диэтиленгликоль;
7) борная кислота;
8) бензойная кислота;
9) лимонная кислота;
10) триэтаноламин;
11) хлорид натрия.
Выводы: Рассмотрев составы мыла различных торговых марок, мы можем сделать вывод, что мыла разных торговых марок имеют различные составы.
Список литературы:
1) Сайт "Pandia".
2) Сайт "Him 1sept".
3) Барагузина, В.В. Общая и неорганическая химия: Учебное пособие / В.В. Барагузина, И.В. Богомолова, Е.В. Федоренко. − М.: ИЦ РИОР, 2017. − 272 c.
4) Богомолова, И.В. Неорганическая химия: Учебное пособие / И.В. Богомолова. − М.: Альфа−М, НИЦ ИНФРА−М, 2016. − 336 c.
11. Исследование факторов окружающей среды, влияющих на коррозию металлов; способы защиты от коррозии.
Ответ:
Тема проекта: Исследование факторов окружающей среды, влияющих на коррозию металлов; способы защиты от коррозии.
Цель: изучить факторы, влияющие на коррозию, рассмотреть способы защиты от коррозии.
Задачи:
1) Рассмотреть способы защиты от коррозии.
2) Рассмотреть факторы коррозии.
Гипотеза исследования: факторы, влияющие на коррозию, могут как ускорять ее, так и замедлять.
План исследования:
1) Что такое коррозия.
2) Способы борьбы с коррозией.
Исследование:
Коррозией называют самопроизвольное разрушение изделий из металла и сплавов под влиянием окружающей среды.
При контакте железа с более активным цинком последний, разрушаясь, защищает железо от коррозии.
Если же разрушение металлов происходит в результате только химического взаимодействия с веществами окружающей среды, то происходит химическая коррозия. Так, например, корродируют щелочные и щёлочноземельные металлы, поэтому их хранят под слоем керосина, а литий − под вазелиновым маслом.
Для борьбы с коррозией существует много способов.
Некоторые из них:
1) Нанесение защитных покрытий на поверхности предохраняемого от коррозии металла. Для этого часто используют масляные краски, эмали, лаки. Эти неметаллические покрытия дешёвые, но обычно недолговечные. Раз в два года, а иногда и чаще их требуется обновлять. Так, например, красят Эйфелеву башно в Париже.
Предохраняемый металл можно покрыть слоем другого металла: золота, серебра, хрома, никеля, олова, цинка и др. Один из самых старых способов − это лужение, или покрытие железного листа слоем олова. Такое железо называют белой жестью.
2) Использование нержавеющих сталей, содержащих специальные добавки. Например, «нержавейка», из которой изготавливают столовые приборы, содержит до 12% хрома и до 10% никеля. Лёгкие нержавеющие сплавы включают алюминий или титан. Всякий, кто был во Всероссийском выставочном центре, видел перед входом обелиск «Покорителям космоса», облицованный пластинками из титанового сплава. На его блестящей поверхности нет ни одного пятнышка ржавчины.
3) Введение в рабочую среду, где находятся металлические детали, веществ, которые в десятки и сотни раз уменьшают агрессивность среды.
Такие вещества называют ингибиторами коррозии.
Ингибиторы коррозии вводят в замкнутые системы охлаждения, в нефтепродукты и даже впрыскивают в газопроводы для снижения коррозии труб изнутри. Для предотвращения коррозии железа в серной кислоте к ней добавляют в качестве ингибитора азотную кислоту.
4) Создание контакта с более активным металлом протектором. Например, для защиты стальных корпусов морских судов обычно используют цинк.
На суше металлические конструкции линии электропередачи (ЛЭП) и трубопроводов соединяют с листом или куском более активного металла. С этой же целью к деталям конструкции мостов приваривают куски цинка.
Выводы: В природе химическая коррозия распространена практически повсеместно. Может возникать как на открытом воздухе, так и под землей, в водоемах и близи них. Мы выяснили, что коррозия зависит от множества факторов, которые могут ее как ускорять, так и замедлять.
Список литературы:
1) Воробьева Г. Я. Коррозионная стойкость материалов в агрессивных средах химических производств. Изд. 2−е пер. и доп. М, «Химия», 1975. 816 с.
2) Малахов А.И., Жуков А.П. Основы металловедения и теории коррозии: Учебник для машиностроительных техникумов — М.: Высшая школа, 1978. — 192 с., ил.
3) Барагузина, В.В. Общая и неорганическая химия: Учебное пособие / В.В. Барагузина, И.В. Богомолова, Е.В. Федоренко. − М.: ИЦ РИОР, 2017. − 272 c.
4) Богомолова, И.В. Неорганическая химия: Учебное пособие / И.В. Богомолова. − М.: Альфа−М, НИЦ ИНФРА−М, 2016. − 336 c.
12. Благородные не значит инертные.
Ответ:
Тема проекта: Благородные не значит инертные.
Цель: изучить благородные газы.
Задачи:
1) Рассмотреть расположение благородных газов в таблице Д.И. Менделеева.
2) Рассмотреть строение атомов благородных газов.
Гипотеза исследования: благородные газы способны вступать в химичсекие реакции.
План исследования:
1) Понятие инертности.
2) Благородные газы.
3) Свойства благородных газов.
4) Благородные не значит инертные.
Исследование:
Слово "инертный" имеет значение "неактивный, пассивный" или "безынициативный", если мы говорим о человеке.
Благородные газы были ранее известны как инертные из−за предполагаемого отсутствия участия в каких−либо химических реакциях. Причина этого заключается в том, что их крайняя электронная оболочка (валентная оболочка) полностью заполнена.
Благородные газы − группа элементов в таблице Менделеева, обладающих однотипными свойствами. Все эти вещества − одноатомные газы, с большим трудом взаимодействующие с другими веществами. К благородным газам относятся: гелий Не, неон Ne, аргон Ar, криптон Kr, ксенон Xe, радон Rn. Они относятся к VIII группе, главной подгруппе Периодической системы химических элементов Д. И. Менделеева.
Благородные газы обладают более высокой электропроводностью по сравнению с другими газами и при прохождении через них тока ярко светятся: гелий ярко−жёлтым светом, потому что в его сравнительно простом спектре двойная жёлтая линия преобладает над всеми другими; неон огненно−красным светом, так как самые яркие его линии лежат в красной части спектра.
Благородные газы могут вступать в химические реакции при определенных условиях.
Первое синтезированное соединение благородных газов − гексафтороплатинат ксенона:
$Xe[PtF_{6}]$.
$Xe + PtF_{6} = Xe[PtF_{6}]$.
Только с фтором могут взаимодействовать криптон, ксенон и радон, причём их химическая активность возрастает от криптона к радону.
Прямым взаимодействием криптона, ксенона и радона с фтором при и нагревании или в электрическом разряде получены фториды:
$KrF_{2}, XeF_{2}, KrF_{4}, XeF_{4}, RnF_{4}$.
$Kr + F_{2} = KrF_{2}$
$Xe + F_{2} = XeF_{2}$
$Kr + 2F_{2} = KrF_{4}$
$Xe + 2F_{2} = XeF_{4}$
$Rn + 2F_{2} = RnF_{4}$
Выводы: Благородные газы не справедливо связывать с понятием "инертный", потому что могут создавать химические связи, хотя для этого и требуются экстремальные условия, поскольку эти атомы или соединения состоят из самых внешних оболочек, которые полностью заполнены электронами.
Список литературы:
1) Сайт "PC group".
2) Барагузина В.В. Общая и неорганическая химия: Учебное пособие / В.В. Барагузина, И.В. Богомолова, Е.В. Федоренко. − М.: ИЦ РИОР, 2017. − 272 c.
3) Богомолова И.В. Неорганическая химия: Учебное пособие / И.В. Богомолова. − М.: Альфа−М, НИЦ ИНФРА−М, 2016. − 336 c.
13. Металлы как материал для производства произведений искусства.
Ответ:
Тема проекта: Металлы как материал для производства произведений искусства.
Цель: изучить металлы как материал для производства произведений искусства.
Задачи:
1) Рассмотреть химические свойства металлов.
2) Рассмотреть способы применения металлов.
Гипотеза исследования: металлы используют как материал для производства произведений искусства.
План исследования:
1) Значение металлов.
2) Применение железа.
3) Применение олова.
4) Применение меди.
Исследование:
Различные металлы использовались в искусстве с давних времен. Они создавались как для практических, так и для эстетических целей. В основном, использовались такие металлы и сплавы, как бронза, серебро, золото, олово, медь, свинец, латунь и железо. Большинство сокровищ и артефактов в Древнем Египте − это разновидности металлических работ. Они включают статуи, украшения и монеты. Великолепные скульптуры, сохранившиеся сегодня в Греции и Риме, были сделаны из бронзы, а древние американские цивилизации, инки, майя и ацтеки, делали топоры и церемониальные орудия из меди.
Железо использовалось еще древними мастерами и в настоящее время не утратило своей привлекательности. Все виды железных работ основаны на использовании трех его видов:
1) Чугун. В основном используется для декоративных каминов и облицовок, принадлежностей для каминов и традиционных печей.
2) Сталь. Используется для изысканных столовых приборов, лестничных перил, декоративного оборудования и украшений.
3) Кованое железо. Используется для изготовления садовой мебели, наружных украшений, садовых скульптур, каминных накладок, перил и балюстрады.
Олово применяется для создания фигурных скульптур, подвесных украшений, бюстов, декоративных значков, водных сосудов, декоративных ваз и подсвечников.
Медь используется как для декоративно−прикладного искусства, так и для повышения прочности и долговечности изделий. Из меди изготавливают статуэтки, скульптуры, вазы и урны, пьедесталы, часы и многое другое. Ювелиры объединяют медь с серебром или золотом, чтобы закрепить их для изготовления ювелирных изделий.
Бронзовые произведения искусства включают в себя древние греческие бюсты, статуэтки, религиозные суда, скульптуры, статуэтки, маски и монументальные отливки.
Изделия из латуни охватывают широкий спектр направлений в искусстве. Это ювелирные изделия, музыкальные инструменты, латунные штамповки, статуи и скульптуры, мебель и фурнитура.
Выводы: Различные металлы нашли широкое применение во всех отраслях жизни человека. И большую область среди них занимает искусство, которое подразделяется на несколько разных направлений.
Список литературы:
1) Сайт "Krugosvet".
2) Барагузина, В.В. Общая и неорганическая химия: Учебное пособие / В.В. Барагузина, И.В. Богомолова, Е.В. Федоренко. − М.: ИЦ РИОР, 2017. − 272 c.
3) Богомолова, И.В. Неорганическая химия: Учебное пособие / И.В. Богомолова. − М.: Альфа−М, НИЦ ИНФРА−М, 2016. − 336 c.
14. Роль металлов в истории человеческой цивилизации.
Ответ:
Тема проекта: Роль металлов в истории человеческой цивилизации.
Цель: изучить роль металлов в истории человеческой цивилизации.
Задачи:
1) Рассмотреть химические свойства металлов.
2) Рассмотреть способы применения металлов.
Гипотеза исследования: металлы играют огромную роль в истории человеческой цивилизации.
План исследования:
1) Значение сплавов.
2) Стали.
3) Бронза.
4) Латунь.
5) Мельхиор.
6) Дюралюминий.
Исследование:
Металлы были известны человеку с древних времен, однако, их они не нашли применения, пока их не научились обрабатывать.
Железо встречается в природе в самородном состоянии крайне редко, в отличие от меди. Слово «железо» в переводе с древнегреческого означает «звездный». В чистом виде железо в природе встречается в составе осколков метеоритов. Медь можно легко получить из медной руды.
Ещё в глубокой древности люди заметили, что сплавы металлов обладают другими, нередко более полезными для человека свойствами, чем составляющие их чистые металлы. У бронзы, например, прочность выше, чем у составляющих её меди и олова. Сталь и чугун прочнее технически чистого железа. Поэтому в чистом виде металлы используют редко. Значительно чаще применяют их сплавы. Известно немногим более 80 металлов, но из них получены десятки тысяч различных сплавов.
Сплавам присущи свойства, которых нет у чистых металлов. Примерами могут служить получаемая на основе железа нержавеющая сталь − материал с высокой жаропрочностью и коррозионной стойкостью даже в агрессивных средах, магнитные материалы и сплавы с высоким электрическим сопротивлением и др.
Сплавы − это материалы с металлической кристаллической решёткой, обладающие характерными свойствами и состоящие из двух и более компонентов.
Компонентами сплавов могут быть и неметаллы, и соединения. По состоянию компонентов сплавы могут быть однородными, когда при сплавлении образуется как бы раствор одного металла в другом, например сплавы меди и олова, золота и серебра, и неоднородными.
Помимо большей прочности многие сплавы обладают большей коррозионной стойкостью и твердостью, лучшими литейными свойствами. Так, чистая медь очень плохо поддаётся литью, а оловянная бронза − сплав меди и олова − имеет прекрасные литейные свойства: из неё отливают художественные изделия, требующие тонкой проработки деталей. Чугун − сплав железа с углеродом − также великолепный литейный материал. Чистый алюминий − очень мягкий металл, сравнительно непрочный на разрыв. Но сплав, состоящий из алюминия, магния, марганца, меди и никеля, называемый дюралюминием, в четыре раза прочнее алюминия на разрыв.
Сплавы классифицируют по−разному, в зависимости от того, какой признак взят за основу. Чаще всего сплавы подразделяют по составу. Например, выделяют медные, алюминиевые, никелевые, титановые и другие сплавы.
Стали − это основа современного машиностроения, оборонной промышленности, ракетостроения и других отраслей промышленности.
Из цветных сплавов отметим бронзу, латунь, мельхиор, дюралюминий.
Бронза − сплав на основе меди с добавлением (до 20%) олова. Бронза хорошо отливается, поэтому её используют в машиностроении для изготовления подшипников, поршневых колец, клапанов, арматуры и т. д. Используют бронзу также и для художественного литья.
Латунь − медный сплав, содержащий от 10 до 50% цинка. Применяют в моторостроении, для изготовления мебельной фурнитуры.
Мельхиор − сплав, содержащий около 80% меди и 20% никеля, похож по внешнему виду на серебро. Используют его для изготовления сравнительно недорогих столовых приборов и художественных изделий.
Дюралюминий (дюраль, дуралюмин) − сплав на основе алюминия, содержащий медь, магний, марганец и никель. Имеет хорошие механические свойства, его применяют в самолёто− и машиностроении.
Выводы: Различные металлы нашли широкое применение во всех отраслях жизни человека. Использование человеком металлов можно считать условием, предопределившим становление цивилизации.
Список литературы:
1) Барагузина, В.В. Общая и неорганическая химия: Учебное пособие / В.В. Барагузина, И.В. Богомолова, Е.В. Федоренко. − М.: ИЦ РИОР, 2017. − 272 c.
2) Сайт "Chem ege".
3) Богомолова, И.В. Неорганическая химия: Учебное пособие / И.В. Богомолова. − М.: Альфа−М, НИЦ ИНФРА−М, 2016. − 336 c.
15. Региональное силикатное производство.
Ответ:
Тема проекта: Региональное силикатное производство.
Цель: изучить силикатное производство.
Задачи:
1) Рассмотреть способы получения силикатов.
2) Рассмотреть способы применения силикатов.
Гипотеза исследования: Роль силикатной промышленности в регионах огромна.
План исследования:
1) Физические свойства кремния.
2) Силикатная промышленность.
3) Стекло − продукт силикатного производства.
4) Цемент.
Исследование:
Кремний – твёрдый элемент тёмно−серого цвета с металлическим блеском. Проявляет свойства полупроводника. В природе находится в составе песка, кварца, глины.
В реакциях с металлами кремний выполняет функцию окислителя (принимает электроны), с неметаллами – восстановителя (отдаёт электроны). При обычных условиях кремний реагирует только с фтором. С остальными веществами взаимодействует при нагревании.
Кремний используют в составе песка, глины и других природных материалов для изготовления прочных материалов – цемента, стекла, керамики.
Промышленность, которая занимается производством различных строительных материалов, стекла и керамики из природных силикатов называется силикатной и включает в себя три основных направления: производство стекла, производство цемента и производство керамики.
Силикатная промышленность является важным сектором экономики, связанным с производством материалов на основе силиката, таких как стекло, керамика, цемент и другие строительные материалы. Этот сектор играет ключевую роль в развитии инфраструктуры и строительной отрасли.
Стекло − один из наиболее распространенных продуктов силикатной промышленности. Его используют в окнах, зеркалах, автомобильных стеклах и многих других приложениях. Керамические изделия, такие как плитка и кафель, также широко используются в строительстве и декоративных приложениях. Цемент является необходимым компонентом для строительства зданий, мостов, дорог и других инфраструктурных объектов.
В современном мире силикатная промышленность сталкивается с множеством вызовов. Например, уменьшение запасов природных ресурсов, повышение требований к энергоэффективности и соблюдению стандартов экологической безопасности. Однако благодаря техническому прогрессу и инновациям, силикатная промышленность продолжает развиваться и производить новые материалы.
Выводы: Силикатная промышленность остается важным сектором экономики и продолжает играть ключевую роль в развитии строительной отрасли и инфраструктур.
Список литературы:
1) Сайт "Art talant".
2) Барагузина, В.В. Общая и неорганическая химия: Учебное пособие / В.В. Барагузина, И.В. Богомолова, Е.В. Федоренко. − М.: ИЦ РИОР, 2017. − 272 c.
3) Богомолова, И.В. Неорганическая химия: Учебное пособие / И.В. Богомолова. − М.: Альфа−М, НИЦ ИНФРА−М, 2016. − 336 c.

