§17. Водород
Лабораторный опыт №19
Получение и распознавание водорода
В пробирку налейте 2 мл раствора серной кислоты и поместите в неё две гранулы цинка. Что наблюдаете? Закройте отверстие пробирки большим пальцем на несколько секунд, пока не почувствуете давление газа на палец. Направьте пробирку на пламя спиртовки и уберите палец (Внимание! Горлышко пробирки не направлять на себя!) Что наблюдаете? Какой водород вы собрали в пробирке: чистый или в смеси с воздухом? Запишите уравнения реакций и рассмотрите окислительно−восстановительные процессы.
Ответ:
Получение и распознавание водорода
В пробирку налили 2 мл раствора серной кислоты и поместили в неё две гранулы цинка.
Наблюдали выделение газа:
$Zn + H_{2}SO_{4} = ZnSO_{4} + H_{2}↑$
$2H^{+} + 2ē ⟶ H_{2}^{0}$ − окислитель
$Zn^{0} - 2ē ⟶ Zn^{+2}$ − восстановитель
Закрыли отверстие пробирки большим пальцем на несколько секунд, пока не почувствовали давление газа на палец. Направили пробирку на пламя спиртовки и убрали палец.
Наблюдаем горение водорода с характерным звуком, следовательно, водород был в смеси с воздухом:
$2H_{2} + O_{2} = 2H_{2}O$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$H_{2}^{0} - 2ē ⟶ 2H^{+}$ − восстановитель
i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Pandia".
2) Сайт "Elar".
3) Сайт "Stud med".
2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Двойственное положение водорода в Периодической таблице Д.И. Менделеева
Каждому элементу в Периодической системе Д. И. Менделеева отводится одно, строго определённое место. Совсем другое дело химический элемент водород. Это единственный элемент, для которого химики отводят в Периодической системе Д. И. Менделеева два места − да каких! Его записывают в две резко противоположные по свойствам группы химических элементов: в главную подгруппу І группы − подгруппу щелочных металлов, а также в главную подгруппу VII группы. Подобно атомам щелочных металлов, атом водорода содержит на внешнем и единственном энергетическом уровне один электрон, поэтому легко отдаёт его и проявляет восстановительные свойства, образуя при этом соединения в степени окисления +1. Эти особенности сближают водород с щелочными металлами.
Но, подобно атомам галогенов, атому водорода до завершения внешнего энергетического уровня не хватает одного электрона (атом благородного газа 1−го периода, гелия, содержит на первом и единственном завершённом уровне два электрона), поэтому водород способен проявлять окислительные свойства в реакциях с металлами, принимая у них этот электрон и получая в результате степень окисления −1.
Молекулы водорода, как и молекулы галогенов, двухатомны и образованы за счёт неполярной ковалентной химической связи.
?
1. Водород образует три изотопа: $^{1}_{1}H$ – протий, $^{2}_{1}H$ или $^{2}_{1}D$ – дейтерий и $^{3}_{1}H$ или $^{3}_{1}T$ – тритий. Запишите все возможные формулы воды, которые образуют эти изотопы водорода с одним из изотопов кислорода, например $^{16}_{8}O$. В какой из молекул содержание водорода наименьшее? Рассчитайте его.
Ответ:
Все возможные формулы воды из приведенных изотопов:
$^{1}_{1}H_{2}$ $^{16}_{8}O$ , $^{2}_{1}H_{2}$ $^{16}_{8}O$, $^{3}_{1}H_{2}$ $^{16}_{8}O$.
В молекуле с протием содержание водорода наименьшее.
Дано:
$^{1}_{1}H_{2}$ $^{16}_{8}O$
Найти:
ω (H) − ?
Решение:
$M_{r}$ ($H_{2}O$) = 2 * 1 + 16 = 18
ω (H) = $\frac{2 * A_{r} (H)}{M_{r} (H_{2}O)}$ * 100% = $\frac{2 * 1}{18}$ * 100% = 11,1%
Ответ: ω (H) = 11,1%.
2. В лаборатории водород можно получить, как вы знаете, взаимодействием щелочного или щёлочноземельного металла с водой, а также по реакции:
$2Al + 2NaOH + 6H_{2}O = 2Na[Al(OH)_{4}] + 3H_{2}$.
В каком случае объём водорода наибольший, если для получения водорода используются одинаковые количества веществ металлов?
Ответ:
Напишем уравненения реакций:
$2Na + 2H_{2}O = 2NaOH + H_{2}$
$2Ca + 4H_{2}O = 2Ca(OH)_{2} + 2H_{2}$
$2Al + 2NaOH + 6H_{2}O = 2Na[Al(OH)_{4}] + 3H_{2}$
По уравнениям можем сделать вывод, что наибольший объем водорода выделяется в реакции алюминия с раствором щелочи.
3. Вычислите объём водорода (н. у.), который потребуется для восстановления 928 кг оксида вольфрама (VI), содержащего 25% примесей. Вычислите количество вещества металла, которое получится при этом.
Ответ:
Дано:
$m_{техн}$ ($WO_{3}$) = 928 кг
ω (примесей) = 25%
Найти:
V ($H_{2}$) − ?
n (W) − ?
Решение:
$WO_{3} + 3H_{2} = W + 3H_{2}O$
m (примесей) = $m_{техн}$ ($WO_{3}$) * ω (примесей) = 928 * 0,25 = 232 кг
m ($WO_{3}$) = $m_{техн}$ ($WO_{3}$) − m (примесей) = 928 − 232 = 696 кг
n ($WO_{3}$) = $\frac{m}{M}$ = $\frac{696}{232}$ = 3 кмоль
n ($H_{2}$) = 3 * n ($WO_{3}$) = 3 * 3 = 9 кмоль
V ($H_{2}$) = n * $V_{m}$ = 9 * 22,4 = 201,6 $м^{3}$
n (W) = n ($WO_{3}$) = 3 кмоль
Ответ: V ($H_{2}$) = 201,6 $м^{3}$; n (W) = 3 кмоль.
4. Запишите уравнения реакций для следующих переходов: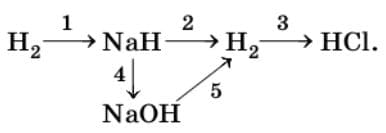
Ответ:
1) $H_{2} + 2Na = 2NaH$
2) $NaH + H_{2}O = NaOH + H_{2}$
3) $H_{2} + Cl_{2} = 2HCl$
4) $NaH + H_{2}O = NaOH + H_{2}$
5) $2NaOH + 2Al + 6H_{2}O = 2Na[Al(OH)_{4}] + 3H_{2}$
5. В стеклянном толстостенном сосуде (эвдиометре) взорвали смесь 4 мл водорода и 3 мл кислорода. Найдите массу продукта реакции и объём непрореагировавшего газа.
Ответ:
Дано:
V ($H_{2}$) = 4 мл
V ($O_{2}$) = 3 мл
Найти:
m ($H_{2}O$) − ?
$V_{непрор}$ (газа) − ?
Решение:
$2H_{2} + O_{2} = 2H_{2}O$
$V_{прор}$ ($O_{2}$) = $\frac{V (H_{2})}{2}$ = $\frac{4}{2}$ = 2 мл
$V_{непрор}$ ($O_{2}$) = V ($O_{2}$) − $V_{прор}$ ($O_{2}$) = 3 − 2 = 1 мл
n ($H_{2}$) = $\frac{V}{V_{m}}$ = $\frac{4}{22,4}$ = 0,179 ммоль
n ($H_{2}O$) = n ($H_{2}$) = 0,179 ммоль
m ($H_{2}O$) = n * M = 0,179 * 18 = 3,22 мг
Ответ: $V_{непрор}$ ($O_{2}$) = 1 мл; m ($H_{2}O$) = 3,22 мг.

