§27. Аммиак
Лабораторный опыт №30
Изучение свойств аммиака
Соблюдая правила техники безопасности, вскройте ампулу с нашатырным спиртом и вылейте её содержимое в пробирку. Каким запахом обладает аммиак?
Добавьте к раствору аммиака 1−2 мл воды, а затем – 2 капли раствора фенолфталеина. Что наблюдаете? Что можно сказать о растворимости аммиака в воде? Подогрейте содержимое пробирки. Что наблюдаете? Объясните результаты проведённого эксперимента.
Ответ:
Изучение свойств аммиака
Соблюдая правила техники безопасности, вскрыли ампулу с нашатырным спиртом и вылили её содержимое в пробирку.
Аммиак обладает резким характерным запахом.
Добавили к раствору аммиака 1−2 мл воды, а затем – 2 капли раствора фенолфталеина.
Наблюдаем изменение окраски индикатора, он приобретает малиновый цвет.
Про растворимость аммиака можно сказать, что он растворим в воде.
i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Disser cat".
2) Сайт "Science journals".
3) Сайт "School science".
2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Строение молекулы аммиака
Рассмотрим строение молекулы аммиака. На внешнем энергетическом уровне атомы азота содержат пять электронов, на которых три электрона неспаренные. Именно они и участвуют в формировании трёх ковалентных связей с тремя атомами водорода при образовании молекулы аммиака.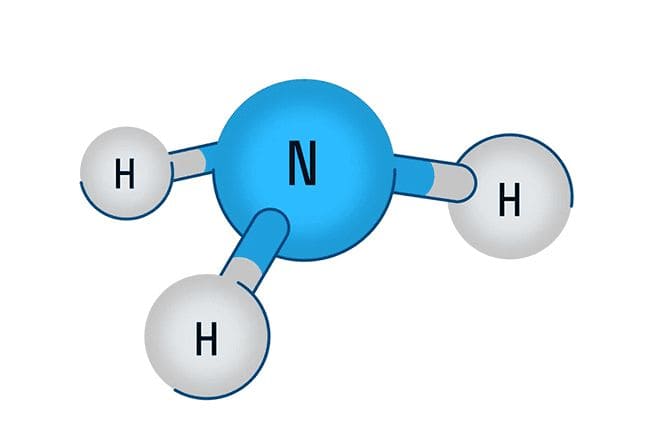
Три общие электронные пары смещены в сторону более электроотрицательного атома азота, а так как молекула аммиака имеет форму треугольной пирамиды, то в результате смещения электронных пар возникает диполь, т.е. молекула с двумя полосами.
Молекулы аммиака (в жидком аммиаке) взаимодействуют, связываясь друг с другом.
?
1. Каково электронное и пространственное строение молекулы аммиака?
Ответ:
На внешнем энергетическом уровне атомы азота содержат пять электронов, из которых три электрона − неспаренные. Именно они и участвуют в образовании трех ковалентных связей с тремя атомами водорода при образовании молекулы аммиака.
Молекула аммиака имеет форму треугольной пирамиды.
2. Перечислите области применения аммиака. Какие свойства аммиака лежат в основе его применения в медицине, холодильных установках?
Ответ:
Аммиак и его соли широко используют в промышленности и технике, в сельском хозяйстве, быту, для получения взрывчатых веществ.
В медицине аммиак применяют, так как он обладает резким запахом; в холодильных установках, так как этот газ легко сжижается при обычном давлении.
3. Какую химическую связь называют водородной? В чём особенности водородной связи? Что можно сказать о прочности водородных связей по сравнению с ковалентными и ионными? Какое значение имеет водородная связь в химии и биологии?
Ответ:
Водородная связь – химическая связь между частично положительно заряженным атомом водорода одной молекулы и частично отрицательно заряженным атомом другой молекулы.
Особенность водородной связи заключается в высокой электроотрицательности атомов, контактирующих с водородом.
Благодаря водородным связям некоторые низкомолекулярные вещества имеют повышенные температуры плавления и кипения, это характерно для воды, спиртов, фтороводорода, аммиака.
Водородная связь играет огромную роль в молекулах важнейших для живых существ соединений — белков и нуклеиновых кислот.
4. Приведите примеры веществ, между молекулами которых образуются водородные связи. Как это отражается на физических свойствах этих веществ?
Ответ:
Примеры веществ, между молекулами которых образуются водородные связи: аммиак, спирты, вода. Благодаря водородной связи вещества имеют высокую температуру кипения и плавления.
5. На примере образования катиона аммония из молекулы аммиака объясните принцип образования ковалентной связи по донорно−акцепторному механизму.
Является ли связь, образованная по донорно−акцепторному механизму, особым типом химической связи? Объясните почему.
Ответ:
И водный раствор аммиака, и соли аммония содержат особый ион − катион аммония, играющий роль катиона металла. Ион аммония образуется в результате возникновения ковалентной связи между атомом азота, имеющим свободную электронную пару, и катионом водорода, который переходит к аммиаку от молекул кислот или воды.
При образовании иона аммония донором свободной электроной пары служит атом азота в аммиаке, а акцептором − катион водорода кислоты или воды.
Связь, образованная по донорно−акцепторному механизму, не является особым типом химической связи потому, что она образуется благодаря неподеленной электронной паре донора.
6. Как изменится окраска фенолфталеина при добавлении его к нашатырному спирту? Объясните ответ, составив уравнение химической реакции.
Ответ:
При добавлении фенолфталеина к нашатырному спирту цвет индикатора изменится на малиновый.
$NH_{3} + H_{2}O ⇄ NH_{4}OH$
$NH_{4}OH ⇄ NH^{4+} + OH^{-}$
7. Какую степень окисления имеет азот: а) в аммиаке; б) в хлориде аммония; в) в нитрате аммония; г) в сульфате аммония?
Ответ:
а) В аммиаке азот имеет степень окисления −3:
$N^{-3}H_{3}$.
б) В хлориде аммония азот имеет степень окисления −3:
$N^{-3}H_{4}Cl$.
в) В нитрате аммония азот имеет степень окисления −3 и +5:
$N^{-3}H_{4}N^{+5}O_{3}$.
г) В сульфате аммония азот имеет степень окисления −3:
$(N^{-3}H_{4})_{2}SO_{4}$.
8. Используя метод электронного баланса, определите коэффициенты в следующей схеме химической реакции:
$CuO + NH_{3} ⟶ N_{2} + Cu + H_{2}O$.
Ответ:
$3CuO + 2NH_{3} = N_{2} + 3Cu + 3H_{2}O$
$Cu^{+2} + 2ē ⟶ Cu^{0}$ − окислитель
$2N^{-3} - 6ē ⟶ N_{2}^{0}$ − восстановитель
9. Почему азот в аммиаке проявляет только восстановительные свойства?
Ответ:
Азот в аммиаке проявляет только восстановительные свойства, так как он находится в минимальной степени окисления −3, то есть он может только повысить ее.
10. Как получают аммиак: а) в промышленности; б) в лабораторных условиях?
Ответ:
а) В промышленности аммиак получают с помощью прямого взаимодействия водорода и азота:
$N_{2} + 3H_{2} = 2NH_{3}$
б) В лабораторных условиях аммиак получают действием гашеной извести на соли аммония:
$Ca(OH)_{2} + 2NH_{2}Cl = CaCl_{2} + 2NH_{3} + 2H_{2}O$

