§2. Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды
Лабораторный опыт №1
Получение гидроксида цинка и исследование его свойств
В две пробирки налейте по 1 мл раствора соли цинка (хлорида, сульфата или нитрата), затем добавьте в каждую с помощью пипетки по 5 капель раствора щелочи (гидроксида натрия или калия). Что наблюдаете? Прилейте к содержимому одной пробирки раствор кислоты (соляной, серной или азотной), а к другой − раствор щелочи. Что наблюдаете? О каком свойстве гидроксида цинка свидетельствует вторая часть опыта? Запишите уравнения проделанных реакций в молекулярной и ионной формах.
Ответ:
Получение гидроксида цинка и исследование его свойств
В две пробирки налили по 1 мл раствора соли цинка (хлорида, сульфата или нитрата), затем добавили в каждую с помощью пипетки по 5 капель раствора щелочи (гидроксида натрия или калия).
$ZnCl_{2} + 2NaOH = Zn(OH)_{2} + 2NaCl$
$Zn^{2+} + 2Cl^{-} + 2Na^{+} + 2OH^{-} = Zn(OH)_{2} + 2Na^{+} + 2Cl^{-}$
$Zn^{2+} + 2OH^{-} = Zn(OH)_ {2}$
Наблюдаем выпадение белого осадка.
Прилили к содержимому одной пробирки раствор кислоты (соляной, серной или азотной), а к содержимому другой − раствор щелочи.
1) $Zn(OH)_{2} + 2HCl = ZnCl_{2} + 2H_{2}O$
$Zn(OH)_{2} + 2H^{+} + 2Cl^{-} = Zn^{2+} + 2Cl^{-} + 2H_{2}O$
$Zn(OH)_{2} + 2H^{+} = Zn^{2+} + 2H_{2}O$
2) $Zn(OH)_{2} + 2NaOH = Na_{2}[Zn(OH)_{4}]$
$Zn(OH)_{2} + 2Na^{+} + 2OH^{-} = 2Na^{+} + [Zn(OH)_{4}]^{2-}$
$Zn(OH)_{2} + 2OH^{-} = [Zn(OH)_{4}]^{2-}$
В первой пробирке наблюдаем растворение осадка в кислоте.
Во второй пробирке также растворяется осадок.
Вторая часть опыта свидетельствует об амфотерных свойствах гидроксида цинка, так как он реагирует и с кислотами, и с щелочами.
i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Химическая энциклопедия Онлайн".
2) Сайт "Chem".
3) Сайт "Studarium".
2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Амфотерность
Амфотерность подтверждает относительный характер деления элементов на металлы и неметаллы, так как амфотерные соединения в зависимости от условий могут проявлять как кислотные, так и основные свойства. Как правило, металлы проявляют основные свойства, а неметаллы − кислотные.
Например, цинк − амфотерный металл, который может вступать в реакции как с кислотами, так и с щелочами:
$Zn + 2NaOH + 2H_{2}O = Na_{2}[Zn(OH)_{4}] + H_{2}$
$Zn + 2HCl = ZnCl_{2} + H_{2}$
?
1. Почему для получения амфотерного гидроксида из раствора соли переходного элемента раствор щёлочи к ней приливают по каплям?
Ответ:
Для получения амфотерного гидроксида из раствора соли переходного элемента раствор щёлочи к ней приливают по каплям, так как амфотерный гидроксид может прореагировать со щелочью, если она будет в избытке. Тогда образуется комплексная соль.
2. Запишите уравнения реакций для следующих превращений: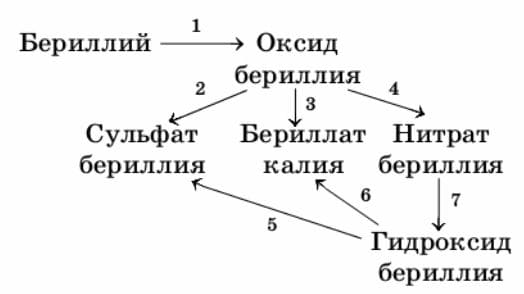
Первую реакцию рассмотрите с позиций окисления−восстановления.
Ответ:
1) $2Be + O_{2} = 2BeO$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$Be^{0} - 2ē ⟶ Be^{+2}$ − восстановитель
2) $BeO + H_{2}SO_{4} = BeSO_{4} + H_{2}O$
3) $BeO + K_{2}O = K2BeO2$
4) $BeO + 2HNO_{3} = Be(NO_{3})_{2} + H_{2}O$
5) $Be(OH)_{2} + H_{2}SO_{4} = BeSO_{4} + H_{2}O$
6) $Be(OH)_{2} + 2KOH = K_{2}BeO_{2} + 2H_{2}O$
7) $Be(NO_{3})_{2} + 2NaOH = 2NaNO_{3} + Be(OH)_{2}↓$
3. Приведите по два молекулярных уравнения реакций, соответствующих сокращённым ионным уравнениям:
а) $Be(OH)_{2} + 2H^{+} ⟶ Be^{2+} + 2H_{2}O$;
б) $Be(OH)_{2} + 2OH^{-} ⟶ BeO_{2}^{2-} + 2H_{2}O$.
Ответ:
а) $Be(OH)_{2} + 2H^{+} ⟶ Be^{2+} + 2H_{2}O$
$Be(OH)_{2} + 2HCl = BeCl_{2} + 2H_{2}O$
$Be(OH)_{2} + H_{2}SO_{4} = BeSO_{4} + 2H_{2}O$
б) $Be(OH)_{2} + 2OH^{-} ⟶ BeO_{2}^{2-} + 2H_{2}O$
$Be(OH)_{2} + 2KOH = K_{2}BeO_{2} + 2H_{2}O$
$Be(OH)_{2} + 2NaOH = Na_{2}BeO_{2} + 2H_{2}O$
4. Докажите, что амфотерность подтверждает относительный характер деления элементов на металлы и неметаллы.
Ответ:
Амфотерность подтверждает относительный характер деления элементов на металлы и неметаллы, так как амфотерные соединения в зависимости от условий могут проявлять как кислотные, так и основные свойства. Как правило, металлы проявляют основные свойства, а неметаллы − кислотные.

