§31. Углерод
Лабораторный опыт №36
Горение угля в кислороде
Поместите в ложечку для сжигания веществ кусочек древесного угля и раскалите его на пламени спиртовки. Внесите ложечку с раскалённым углём в колбу с кислородом (с этой целью получите его из пероксида водорода, используя оксид марганца (IV)). Каков характер пламени горящего угля? Запишите уравнение реакции, рассмотрите окислительно−восстановительные процессы.
Ответ:
Горение угля в кислороде
Поместили в ложечку для сжигания веществ кусочек древесного угля и раскалили его на пламени спиртовки. Внесли ложечку с раскалённым углём в колбу с кислородом (с этой целью получите его из пероксида водорода, используя оксид марганца (IV)). Уголь горит ярким пламенем.
$C + O_{2} = CO_{2}$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$C^{0} - 4ē ⟶ C^{+4}$ − восстановитель
i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "School science".
2) Сайт "Science journals".
3) Сайт "Chem ege".
2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Строение атома углерода
Углерод С − первый элемент главной подгруппы IV группы Периодической системы Д. И. Менделеева. Его атомы содержат на внешнем энергетическом уровне четыре электрона, поэтому они могут принимать четыре электрона, приобретая при этом степень окисления −4, т. е. проявлять окислительные свойства и отдавать свои электроны более электроотрицательным элементам, т. е. проявлять восстановительные свойства, приобретая при этом степень окисления +4.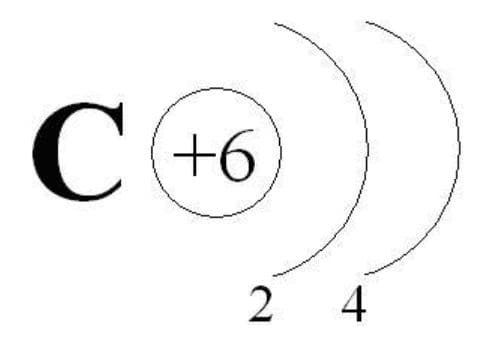
?
1. Сравните строение алмаза и графита и их физические свойства: твёрдость, оптические свойства, электропроводность.
Ответ:
Таблица Сравнение строения алмаза и графита и их физических свойств
Алмаз Графит
Твердость Очень
твердый Мягкий
Оптические
свойства Имеет Имеет
большой металлический
показатель блеск,
преломления непрозрачный
Электро-
провод-
ность Не проводит Хороший
ток проводник
2. Напишите уравнения реакций с участием углерода, которые характеризуют отдельно его восстановительные и окислительные свойства. Рассмотрите окислительно−восстановительные процессы для них.
Ответ:
Реакция, где углерод − окислитель:
$Ca + 2C ⟶ CaC_{2}$
$C^{0} + 1ē ⟶ C^{-2}$ − окислитель
$Ca^{0} - 2ē ⟶ Ca^{+2}$ − восстановитель
Реакция, где углерод − восстановитель:
$C + O_{2} ⟶ CO_{2}$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$C^{0} - 4ē ⟶ C^{+4}$ − восстановитель
3. Вспомните из курса биологии, какой период в истории Земли носит название каменноугольного, или карбона. Каково происхождение каменного угля?
Ответ:
Каменноугольный период получил свое название из−за сильного углеобразования в это время. Каменный уголь образуется из продуктов разложения органических остатков растений.
4. Почему в домашние холодильники рекомендуют помещать по нескольку таблеток карболена?
Ответ:
В домашние холодильники рекомендуют помещать по нескольку таблеток карболена, так как они обладают хорошими адсорбирующими свойствами, что препятствуют появлению запахов.
5. Напишите уравнения реакций взаимодействия угля с оксидом железа (III) и оксидом олова (IV). Рассмотрите окислительно−восстановительные процессы.
Ответ:
Уравнение реакции взаимодействия угля с оксидом железа (III):
$2Fe_{2}O_{3} + 4C = 4Fe + 3CO_{2}$
$Fe^{+3} + 3ē ⟶ Fe^{0}$ − окислитель
$C^{0} - 4ē ⟶ C^{+4}$ − восстановитель
Уравнение реакции взаимодействия угля оксидом олова (IV):
$SnO_{2} + C = Sn + CO_{2}$
$Sn^{+4} + 4ē ⟶ Sn^{0}$ − окислитель
$C^{0} - 4ē ⟶ C^{+4}$ − восстановитель
6. При сжигании 8 г угля было получено 10,64 л (н. у.) углекислого газа, что составляет 95% от теоретически возможного. Вычислите массовую долю примесей в угле.
Ответ:
Дано:
$m_{техн}$ (C) = 8 г
$V_{практ}$ ($CO_{2}$) = 10,64 л
η = 95%
Найти:
ω (примесей) − ?
Решение:
$C + O_{2} = CO_{2}$
$V_{теор}$ ($CO_{2}$) = $\frac{V_{практ}}{η}$ = $\frac{10,64}{0,95}$ = 11,2 л
n ($CO_{2}$) = $\frac{m}{M}$ = $\frac{11,2}{22,4}$ = 0,5 моль
n (C) = n ($CO_{2}$) = 0,5 моль
m (C) = n * M = 0,5 * 12 = 6 г
m (примесей) = $m_{техн}$ − m (C) = 8 − 6 = 2 г
ω (примесей) = $\frac{m (примеси)}{m_{техн}}$ * 100% = $\frac{2}{8}$ * 100% = 25%
Ответ: ω (примесей) = 25%.
7. При недостатке кислорода углерод взаимодействует с углекислым газом согласно уравнению:
$C + CO_{2} = 2CO$.
Какая форма существования элемента углерода проявляет в этой реакции окислительные свойства, а какая – восстановительные?
Ответ:
$C + CO_{2} = 2CO$
$C^{+4} + 2ē ⟶ C^{+2}$ − окислитель
Данная форма углерода проявляет в этой реакции окислительные свойства.
$C^{0} - 2ē ⟶ C^{+2}$ − восстановитель
Данная форма углерода проявляет в этой реакции восстановительные свойства.
8. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
C $\overset{1}{⟶}$ $CaC_{2}$ $\overset{2}{⟶}$ $C_{2}H_{2}$ $\overset{3}{⟶}$ $CO_{2}$ $\overset{4}{⟶}$ CO.
Рассмотрите окислительно−восстановительные процессы.
Ответ:
C $\overset{1}{⟶}$ $CaC_{2}$ $\overset{2}{⟶}$ $C_{2}H_{2}$ $\overset{3}{⟶}$ $CO_{2}$ $\overset{4}{⟶}$ CO
1) $Ca + 2C ⟶ CaC_{2}$
$C^{0} + 1ē ⟶ C^{-2}$ − окислитель
$Ca^{0} - 2ē ⟶ Ca^{+2}$ − восстановитель
2) $CaC_{2} + 2H_{2}O ⟶ Ca(OH)_{2} + C_{2}H_{2}↑$
3) $2C_{2}H_{2} + 5O_{2} ⟶ 2H_{2}O + 4CO_{2}$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$C^{-1} - 5ē ⟶ C^{+4}$ − восстановитель
4) $C + CO_{2} ⟶ 2CO$
$C^{+4} + 2ē ⟶ C^{+2}$ − окислитель
Данная форма углерода проявляет в этой реакции окислительные свойства.
$C^{0} - 2ē ⟶ C^{+2}$ − восстановитель
Данная форма углерода проявляет в этой реакции окислительные свойства.

