§13. Бериллий, магний и щелочноземельные металлы
Лабораторный опыт №15
Получение гидроксида кальция и исследование его свойств
Небольшой кусочек или немного порошка оксида кальция поместите в стаканчик, прилейте в 5 раз больше воды. Размешайте содержимое с помощью стеклянной палочки и дайте постоять 2−3 мин. Отфильтруйте по 1−2 мл содержимого стаканчика в две пробирки. С помощью стеклянной трубочки осторожно продувайте выдыхаемый воздух через раствор в 1−й пробирке. Что наблюдаете? Как называется реакция? Запишите уравнение. К раствору во 2−й пробирке добавьте 2−3 капли спиртового раствора фенолфталеина. Что наблюдаете? Что можно утверждать на основании опыта о растворимости гидроксида кальция?
Ответ:
Получение гидроксида кальция и исследование его свойств
Небольшой кусочек или немного порошка оксида кальция поместили в стаканчик, прилили в 5 раз больше воды. Размешали содержимое с помощью стеклянной палочки и дали постоять 2−3 мин. Отфильтровали по 1−2 мл содержимого стаканчика в две пробирки. С помощью стеклянной трубочки осторожно продували выдыхаемый воздух через раствор в 1−й пробирке.
Наблюдаем помутнение раствора:
$Ca(OH)_{2} + CO_{2} = CaCO_{3} + H_{2}O$
К раствору во 2−й пробирке добавили 2−3 капли спиртового раствора фенолфталеина. Наблюдаем изменение окраски раствора на малиновую.
Можно сделать вывод, что гидроксид кальция малорастворим в воде.
i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Xumuk".
2) Сайт "Prime Chemical Group".
3) Сайт "Химия и жизнь".
2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Строение и свойства атомов берилия, магния и щелочноземельных металлов:
Бериллий Be, магний Mg и щелочноземельные металлы: кальций Са, стронций Sr, барий Ва и радий Ra − элементы главной подгруппы II группы (IIА−группы) Периодической системы Д. И. Менделеева. Атомы этих элементов содержат на внешнем энергетическом уровне два электрона, которые они отдают при химических взаимодействиях и поэтому являются сильнейшими восстановителями.
Во всех соединениях они имеют степень окисления +2. С увеличением порядкового номера сверху вниз в подгруппе восстановительные свойства элементов усиливаются, что связано с увеличением радиусов их атомов.
Радий − радиоактивный элемент, содержание его в природе невелико.
?
1. Массовая доля костей человека составляет 20% от общей массы организма. На долю фосфата кальция, входящего в состав костей, приходится также 20% от массы костей. Зная массу своего тела, рассчитайте, сколько килограммов фосфата кальция содержится в вашем организме. Сколько килограммов кальция содержится в нём?
Ответ:
Дано:
ω (костей) = 20%
ω ($Ca_{3}(PO_{4})_{2}$) = 20%
m (тела) = 50 кг
Найти:
m ($Ca_{3}(PO_{4})_{2}$) − ?
m (Ca) − ?
Решение:
m (костей) = m (тела) * ω (костей) = 50 * 0,2 = 10 кг
m ($Ca_{3}(PO_{4})_{2}$) = m (костей) * ω ($Ca_{3}(PO_{4})_{2}$) = 10 * 0,2 = 2 кг
m (Ca) = m ($Ca_{3}(PO_{4})_{2}$) * ω (Ca)
ω (Ca) = $\frac{3 * A_{r} (Ca)}{M_{r}}$ * 100% = $\frac{3 * 40}{310}$ * 100% = 35%
m (Ca) = 2 * 0,35 = 0,7 кг
Ответ: m ($Ca_{3}(PO_{4})_{2}$) = 2 кг; m (Ca) = 0,7 кг.
2. Вспомните из курса анатомии, что такое гемофилия, почему гемофиликам вводят при кровотечениях раствор хлорида кальция?
Ответ:
Гемофилия − это наследственное заболевание, связанное с нарушением свертывания крови.
Гемофиликам вводят при кровотечениях раствор хлорида кальция, так как ионы кальция способствуют свертыванию крови, тем самым останавливая кровотечение.
3. Вычислите количество вещества гашёной извести, которое может быть получено из 2 т известняка, содержащего 25% примесей.
Ответ:
Дано:
m ($CaCO_{3}$) = 2 т = 2000 кг
ω (примесей) = 25%
Найти:
n ($Ca(OH)_{2}$) − ?
Решение:
$CaCO_{3} = CaO + CO_{2}$
$CaO + H_{2}O = Ca(OH)_{2}$
m (примесей) = m ($CaCO_{3}$) * ω (примесей) = 2000 * 0,25 = 500 кг
m ($CaCO_{3}$) = m ($CaCO_{3}$) − m (примесей) = 2000 − 500 = 1500 кг
n ($CaCO_{3}$) = $\frac{m}{M}$ = $\frac{1500}{100}$ = 15 кмоль
n ($Ca(OH)_{2}$) = n (CaO) = n ($CaCO_{3}$) = 15 кмоль
Ответ: n ($Ca(OH)_{2}$) = 15 кмоль.
4. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения.
$MCO_{3}$ $\overset{1}{⟶}$ MO $\overset{2}{⟶}$ $M(OH)_{2}$ $\overset{3}{⟶}$ $MSO_{3}$ $\overset{4}{⟶}$ $MSO_{4}$
Какие металлы главной подгруппы II группы (IIА группы) Периодической системы Д. И. Менделеева могут быть использованы для этих превращений, а какие – нет? Почему?
Ответ:
$MCO_{3}$ $\overset{1}{⟶}$ MO $\overset{2}{⟶}$ $M(OH)_{2}$ $\overset{3}{⟶}$ $MSO_{3}$ $\overset{4}{⟶}$ $MSO_{4}$
1) $MCO_{3}$ ⟶ MO + $CO_{2}↑$
2) $MO + H_{2}O ⟶ M(OH)_{2}$
3) $M(OH)_{2} + SO_{2} ⟶ MSO_{3} + H_{2}O$
4) $MSO_{3} + H_{2}SO_{4} ⟶ MSO_{4} + H_{2}O + SO_{2}↑$
Кальций, сронций и барий − металлы главной подгруппы II группы (IIА группы) Периодической системы Д. И. Менделеева могут быть использованы для этих превращений, магний и бериллий − не могут быть использованы, так как оксиды магния и бериллия не реагируют с водой.
5. Напишите уравнения реакций для осуществления превращений.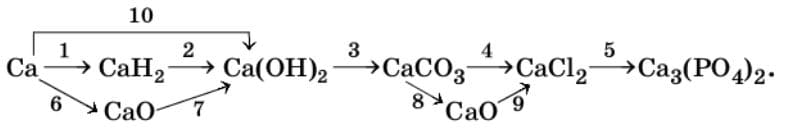
Уравнение последней реакции запишите также в ионной форме.
Ответ:
1) $Ca + H_{2} = CaH_{2}$
2) $CaH_{2} + 2H_{2}O = Ca(OH)_{2} + 2H_{2}$
3) $Ca(OH)_{2} + CO_{2} = CaCO_{3} + H_{2}O$
4) $CaCO_{3} + 2HCl = CaCl_{2} + H_{2}O + CO_{2}↑$
5) $3CaCl_{2} + 2Na_{3}PO_{4} = 6NaCl + Ca_{3}(PO_{4})_{2}↓$
$3Ca^{2+} + 6Cl^{-} + 6Na^{+} + 2PO_{4}^{3-}$ → $6Na^{+} + 6Cl^{-} + Ca_{3}(PO_{4})_{2}↓$
$3Ca^{2+} + 2PO_{4}^{3-} → Ca_{3}(PO_{4})_{2}↓$
6) $2Ca + O_{2} = 2CaO$
7) $CaO + H_{2}O = Ca(OH)_{2}$
8) $CaCO_{3} = CaO + CO_{2}↑$
9) $CaO + 2HCl = CaCl_{2} + H_{2}O$
10) $Ca + 2H_{2}O = Ca(OH)_{2} + H_{2}↑$
6. Используя в качестве примера приведенное в предыдущем параграфе сочинение ученицы, напишите свое сочинение о химическом веществе или процессе, посвященное химии щелочноземельных металлов.
Ответ:
Добрый кальций
В большом семиэтажном доме, в подъезде щелочноземельных металлов, на четвертом этаже жил Кальций – металл. Он, как и все щелочноземельные металлы, очень активно взаимодействовал с кислородом, неметаллами, водородом и водой.
Он с охотой отдавал свои электроны и кислороду, и азоту, и многим другим элементам.
Кальций отдавал молекуле Кислорода два электрона:
$2Ca + O_{2} = 2CaO$
Оксид Кальция был добрым и с водой давал гидроксид:
$CaO + H_{2}O = Ca(OH)_{2}$.
Только Стронций и Барий поддерживали в этом Кальций, оксид Магния не дружил с водой.
7. Почему в медицине для гипсовых повязок используют не гипс $CaSO_{4} * 2H_{2}O$, а алебастр $2CaSO_{4} * H_{2}O$? Какой процесс происходит при наложении такой повязки?
Ответ:
В медицине для гипсовых повязок используют не гипс $CaSO_{4} * 2H_{2}O$, а алебастр $2CaSO_{4} * H_{2}O$, так как алебастр быстрее сохнет. Происходит процесс кристаллизации:
$2CaSO_{4} * H_{2}O + 3H_{2}O ⟶ 2CaSO_{4} * 4H_{2}O$

