Основания. Часть 2
Задание №1
Поиграйте в "крестики−нолики". Покажите выигрышный путь, который составляют формулы щелочей.
| NaOH | $Cr(OH)_{2}$ | LiOH |
| $Mn(OH)_{2}$ | $Ba(OH)_{2}$ | $Fe(OH)_{2}$ |
| $Fe(OH)_{3}$ | $Mg(OH)_{2}$ | RbOH |
Впишите в соответствующие столбцы формулы и названия всех приведенных выше оснований.
| Растворимые | Нерастворимые |
Распределите все приведенные выше основания по другому признаку.
| Однокислотные | Двухкислотные | Трехкислотные |
Ответ
Щелочи − NaOH, LiOH, $Ba(OH)_{2}$, RbOH:
| NaOH | $Cr(OH)_{2}$ | LiOH |
| $Mn(OH)_{2}$ | $Ba(OH)_{2}$ | $Fe(OH)_{2}$ |
| $Fe(OH)_{3}$ | $Mg(OH)_{2}$ | RbOH |
Выигрышного пути нет!
| Растворимые | Нерастворимые |
| NaOH | $Cr(OH)_{2}$ |
| LiOH | $Mn(OH)_{2}$ |
| $Ba(OH)_{2}$ | $Fe(OH)_{2}$ |
| RbOH | $Fe(OH)_{3}$ |
| $Mg(OH)_{2}$ |
| Однокислотные | Двухкислотные | Трехкислотные |
| NaOH | $Cr(OH)_{2}$ | $Fe(OH)_{3}$ |
| LiOH | $Mn(OH)_{2}$ | |
| $Ba(OH)_{2}$ | ||
| $Fe(OH)_{2}$ | ||
| $Mg(OH)_{2}$ |
Задание №2
Составьте формулы оснований и соответствующих им оксидов металлов для следующих ионов:
1) $Ag^{+}$ _ → _
2) $Pb^{2+}$ _ → _
3) $Fe^{3+}$ _ → _
Ответ
1) AgOH → $Ag_{2}O$
2) $Pb(OH)_{2}$ → PbO
3) $Fe(OH)_{3}$ → $Fe_{2}O_{3}$
Задание №3
В пробирках А и Б находятся известковая вода и раствор гидроксида натрия. Какие качественные реакции необходимо провести, чтобы определить содержимое каждой из пробирок?
Ответ. _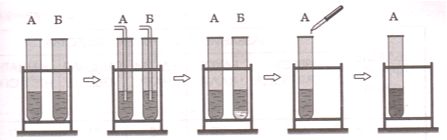
Ответ
Сначала пропустим углекислый газ в две пробирке. В пробирке Б (с известковой водой) выпадет осадок. Затем в пробирку А добавим несколько капель фенолфталеина − раствор приобретет малиновую окраску.
$Ca(OH)_{2} + CO_{2} = CaCO_{3} + H_{2}O$
$NaOH = Na^{+} + OH^{-}$
Ответ. А − известковая вода; Б − гидроксид натрия.
Задание №4
Определите заряды ионов металлов и степени окисления элементов в основаниях.
| СОЕДИНЕНИЕ | ЗАРЯД ИОНА МЕТАЛЛА | С.О. ЭЛЕМЕНТОВ |
| $Ba(OH)_{2}$ | ||
| $Al(OH)_{3}$ | ||
| KOH |
Ответ
| СОЕДИНЕНИЕ | ЗАРЯД ИОНА МЕТАЛЛА | С.О. ЭЛЕМЕНТОВ |
| $Ba(OH)_{2}$ | 2+ | 2+ |
| $Al(OH)_{3}$ | 3+ | 3+ |
| KOH | 1+ | 1+ |
Задание №5
Запишите в таблицу "Области применения некоторых оснований" формулы веществ.
| Область применения | Известковая вода _ | Едкое кали _ | Едкий натр _ | Гашеная известь _ | Нашатырный спирт _ |
| Строительство | ВА | ЛЕ | ИН | БА | ДИ |
| Для распознавания $CO_{2}$ | РИ | ГЕ | МЫ | ТЫ | ОН |
| Медицина | ЛЕЙ | УЯ | КЕ | ТА | ТО |
| Производство мыла | РА | ВАЯ | КА | НА | РЫ |
| Получение тугоплавкого стекла | АР | ША | МУ | МА | БА |
Установите соответствие между веществом и областями его применения. Из слогов, соответствующих правильным ответам, вы составите название насыщенного водного раствора гидроксида бария (II): _ _ _ _ _ _ _ _ _ _ _ _ _.
Ответ
Области применения некоторых оснований
| Область применения | Известковая вода _ | Едкое кали _ | Едкий натр _ | Гашеная известь _ | Нашатырный спирт _ |
| Строительство | ВА | ЛЕ | ИН | БА | ДИ |
| Для распознавания $CO_{2}$ | РИ | ГЕ | МЫ | ТЫ | ОН |
| Медицина | ЛЕЙ | УЯ | КЕ | ТА | ТО |
| Производство мыла | РА | ВАЯ | КА | НА | РЫ |
| Получение тугоплавкого стекла | АР | ША | МУ | МА | БА |
Название насыщенного водного раствора гидроксида бария (II): баритовая каша.
Задание №6
Вычислите количество вещества, которое составляют 196 г гидроксида калия. Сколько ионов каждого вида будет содержать эта порция щелочи?
Решение:
1) n ( _ ) = _
2) Анализ формулы гидроксида калия показывает, что n ($K^{+}$) = n ( _ ), а n ($OH^{-}$) = n ( _ )
3) N ($K^{+}$) = _
4) N ($OH^{-}$) = _
Ответ: _
Ответ
Дано:
m (KOH) = 196 г
Найти:
m (KOH) − ?
N ($K^{+}$) − ?
N ($OH^{-}$) − ?
Решение:
1) n (KOH) = m : M
M (KOH) = 39 + 16 + 1 = 56 г/моль
n (KOH) = 196 г : 56 г/моль = 3,5 моль
2) Анализ формулы гидроксида калия показывает, что n ($K^{+}$) = n (KOH), а n ($OH^{-}$) = n (KOH)
3) N ($K^{+}$) = n ($K^{+}$) * $N_{a}$
N ($K^{+}$) = 3,5 моль* $6 * 10^{23}$ ионов/моль = $2,1 * 10^{24}$ ионов
4) N ($OH^{-}$) = n ($OH^{-}$) * $N_{a}$
N ($OH^{-}$) = 3,5 моль* $6 * 10^{23}$ ионов/моль = $2,1 * 10^{24}$ ионов
Ответ: N ($K^{+}$) = $2,1 * 10^{24}$ ионов; N ($OH^{-}$) = $2,1 * 10^{24}$ ионов
Задание №7
Рассчитайте массу 2,5 кмоль гидроксида бария. Сколько ионов каждого вида будет содержать эта порция щелочи?
Ответ
Дано:
n ($Ba(OH)_{2}$) = 2,5 кмоль
Найти:
m ($Ba(OH)_{2}$) − ?
N ($Ba^{2+}$) − ?
N ($OH^{-}$) − ?
Решение:
1) m ($Ba(OH)_{2}$) = n * M
M ($Ba(OH)_{2}$) = 137 + 16 * 2 + 1 * 2 = 171 г/моль
m ($Ba(OH)_{2}$) = 2,5 кмоль * 171 г/моль = 427,5 кг
2) Анализ формулы гидроксида калия показывает, что n ($Ba^{2+}$) = n ($Ba(OH)_{2}$), а n ($OH^{-}$) = 2 * n ($Ba(OH)_{2}$)
3) N ($Ba^{2+}$) = n ($Ba^{2+}$) * $N_{a}$
N ($Ba^{2+}$) = 2,5 кмоль* $6 * 10^{23}$ ионов/моль = $1,5 * 10^{24}$ ионов
4) N ($OH^{-}$) = 2 * n ($OH^{-}$) * $N_{a}$
N ($OH^{-}$) = 2 * 2,5 кмоль* $6 * 10^{23}$ ионов/моль = $3 * 10^{24}$ ионов
Ответ: N ($Ba^{2+}$) = $1,5 * 10^{24}$ ионов; N ($OH^{-}$) = $3 * 10^{24}$ ионов

