Окислительно-восстановительные реакции (ОВР). Часть 1
Задание №1
ОВР − это реакции, в результате которых _
Ответ
ОВР − это реакции, в результате которых происходит изменение степени окисления химических элементов.
Задание №2
Восстановитель − это элемент или вещество, _ _ _ _ _ _ _ _ электроны. Само оно при этом _ _ _ _ _ _ _ _ _ _ .
Окислитель − это элемент или вещество, _ _ _ _ _ _ _ _ _ _ _ электроны. Само оно при этом _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ .
Ответ
Восстановитель − это элемент или вещество, отдающее электроны. Само оно при этом окисляется.
Окислитель − это элемент или вещество, принимающее электроны. Само оно при этом восстанавливается.
Задание №3
Некоторые активные окислители:
1) галогены: $Г_{2} + 2e → 2Г^{-1}$;
2) кислород: $O_{2} + 4e →2O_{-2}$;
3) азот в азотной кислоте: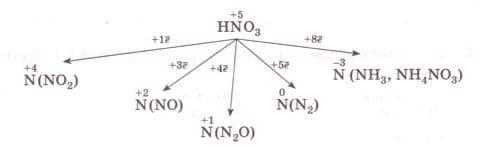
4) сера в серной кислоте: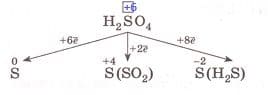
Ответ
Некоторые активные окислители:
1) галогены: $Г_{2} + 2e → 2Г^{-1}$;
2) кислород: $O_{2} + 4e →2O_{-2}$;
3) азот в азотной кислоте:
4) сера в серной кислоте:
Задание №4
Некоторые активные восстановители:
1) металлы: $M - ne → M^{+2}$;
2) водород: $H_{2}^{0} - 2e → 2H^{+1}$;
3) азот в аммиаке:
$N^{+2}$ $(NO)\overset{-5e}{←}$ $N^{-}H_{3}$ $\overset{-3e}{→}$ $N^{0} (N_{2})$
4) сера в сероводороде:
$S^{+4}$ $(SO_{2})\overset{-4e}{←}$ $H_{2}S^{-}$ $\overset{-3e}{→}$ $S^{0}$
Ответ
Некоторые активные восстановители:
1) металлы: $M - ne → M^{+2}$;
2) водород: $H_{2}^{0} - 2e → 2H^{+1}$;
3) азот в аммиаке:
$N^{+2}$ $(NO)\overset{-5e}{←}$ $N^{-3}H_{3}$ $\overset{-3e}{→}$ $N^{0} (N_{2})$
4) сера в сероводороде:
$S^{+4}$ $(SO_{2})\overset{-4e}{←}$ $H_{2}S^{-2}$ $\overset{-3e}{→}$ $S^{0}$

