Реакции замещения. Часть 2
Задание №1
Запишите уравнения реакций замещения.
1) $Zn + HCl → ... + ...$
2) $Al + ... → Al_{2}(SO_{4})_{3} + ...$
3) $... + HBr → MgBr_{2} + ...$
4) $CuCl_{2} + Cr → CrCl_{3} + ...$
5) $Fe_{2}O_{3} + Mg → ... + ...$
Ответ
1) $Zn + 2HCl = ZnCl_{2} + H_{2}$
2) $2Al + 3H_{2}SO_{4} = Al_{2}(SO_{4})_{3} + 3H_{2}$
3) $Mg + 2HBr = MgBr_{2} + H_{2}$
4) $3CuCl_{2} + 2Cr = 2CrCl_{3} + 3Cu$
5) $Fe_{2}O_{3} + 3Mg = 2Fe + 3MgO$
Задание №2
Запишите уравнения возможных реакций.
1) $HgCl_{2} + Fe →$ _
2) $CuCl_{2} + Al →$ _
3) $AgNO_{3} + Zn →$ _
4) $ZnCl_{2} + Fe →$ _
5) $AgNO_{3} + Au →$ _
6) $Cu + H_{2}SO_{4(разб)} →$ _
7) $Ag + HCl →$ _
Ответ
1) $HgCl_{2} + Fe = FeCl_{2} + Hg$
2) $3CuCl_{2} + 2Al = 2AlCl_{3} + 3Cu$
3) $2AgNO_{3} + Zn = Zn(NO_{3})_{2} + 2Ag$
4) $ZnCl_{2} + Fe ↛$
5) $AgNO_{3} + Au ↛$
6) $Cu + H_{2}SO_{4(разб)} ↛$
7) $Ag + HCl ↛$
Задание №3
Напишите уравнения реакций замещения:
1) между алюминием и оксидом меди (II) _
2) между оксидом кремния (IV) и магнием _
3) между бромидом хрома (III) и хлором _
Ответ
Уравнения реакций замещения:
1) между алюминием и оксидом меди (II)
$2Al + 3CuO = Al_{2}O_{3} + 3Cu$
2) между оксидом кремния (IV) и магнием
$SiO_{2} + 2Mg = 2MgO + Si$
3) между бромидом хрома (III) и хлором
$2CrBr_{3} + 3Cl_{2} = 2CrCl_{3} + 3Br_{2}$
Задание №4
Допишите уравнение реакции $Zn + H_{2}SO_{4} → ... + ... $ + Q
Дайте характеристику записанной реакции по следующим признакам:
1) число и состав исходных веществ и продуктов реакции _
2) тепловой эффект _
3) направление протекания _
4) участие катализатора _
Ответ
$Zn + H_{2}SO_{4} → ZnSO_{4} + H_{2}$ + Q
1) число и состав исходных веществ и продуктов реакции − реакция замещения
2) тепловой эффект − экзотермическая
3) направление протекания − необратимая
4) участие катализатора − некаталитическая
Задание №5
39 г технического цинка, содержащего 20% примесей, растворили в избытке соляной кислоты. Найдите объем полученного водорода (н.у.) и количество вещества соли.
Ответ
Дано:
$m_{тех}$ (Zn) = 39 г
$ω_{прим}$ = 20%
Найти:
V ($H_{2}$) − ?
n ($ZnCl_{2}$) − ?
Решение:
$Zn + 2HCl = ZnCl_{2} + H_{2}$
$ω_{чист}$ = 100% − $ω_{прим}$ = 100% − 20% = 80%
$m_{чист}$ (Zn) = $m_{тех}$ (Zn) * $ω_{чист}$ = 39 г * 0,8 = 31 г
n (Zn) = m : M = 31 г : 65 г/моль = 0,48 моль
n ($ZnCl_{2}$) = n (Zn) = 0,48 моль
n ($H_{2}$) = n (Zn) = 0,48 моль
V ($H_{2}$) = $V_{m}$* n = 22,4 л/моль * 0,48 моль = 10,8 л
Ответ: n ($ZnCl_{2}$) = 0,48 моль; V ($H_{2}$) = 10,8 л
Задание №6
Железо массой 1,12 г полностью прореагировало с раствором сульфата меди (II). Найдите массу образовавшегося осадка меди. Какое количество вещества сульфата железа (II) при этом получилось?
Ответ
Дано:
m (Fe) = 1,12 г
Найти:
m (Cu) − ?
n ($FeSO_{4}$) − ?
Решение:
$Fe + CuSO_{4} = FeSO_{4} + Cu$
n (Fe) = m : M = 1,12 г : 56 г/моль = 0,02 моль
n ($FeSO_{4}$) = n (Fe) = 0,02 моль
n (Cu) = n (Fe) = 0,02 моль
m (Cu) = M * n = 64 г/моль * 0,02 моль = 1,28 г
Ответ: n ($FeSO_{4}$) = 0,02 моль; m (Cu) = 1,28 г
Задание №7*
Придумайте рисунки "Взаимодействия различных металлов с соляной кислотой" и "Взаимодействие различных кислот с цинком", иллюстрирующие зависимость скорости протекания реакций от природы металла и кислоты.
Ответ
Взаимодействия различных металлов с соляной кислотой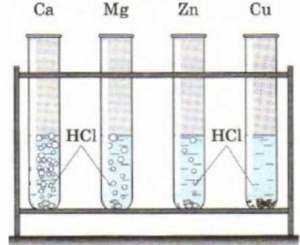
Взаимодействие различных кислот с цинком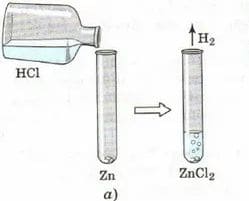
При взаимодействии всех кислот с цинком выделяется водород.

