Кислоты, их классификация и химические свойства в свете ТЭД. Часть 1
Задание №1
Кислоты − это _
Ответ
Кислоты − это сложные вещества, состоящие из атомов металла и кислотного остатка.
Задание №2
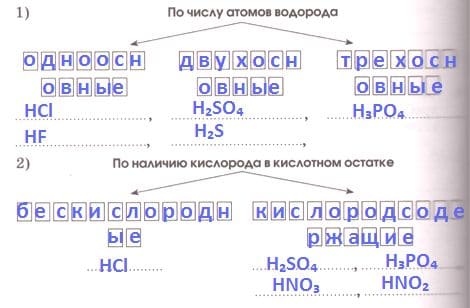
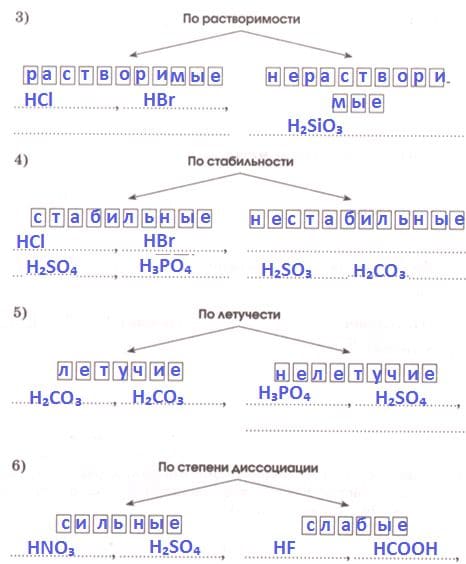
Вспомните классификацию кислот и распределите кремниевую, соляную, азотную, угольную, фосфорную кислоты в соответствующие группы, вписав их формулы.
Ответ
Задание №3
Общие химические свойства кислот.
1) Кислота + _ _ _ _ _ _ → соль + $H_{2}$↑,
если:
− _
− _
− _
− _
2) Кислота + оксид металла → _ + _
3) Кислота + _ → _ + _
Если щелочь, то реакция _ _ _ _ _ _ _ _ _ _ _ _ _ .
4) Кислота + _ → новая _ _ _ _ _ _ _ + новая _ _ _ _,
если:
− _
− _
Ответ
Общие химические свойства кислот.
1) Кислота + металл → соль + $H_{2}$↑,
если:
−металл стоит до водорода в ряду напряжений металлов;
−металл не является щелочным или щелочноземельным;
−кислота растворима, но не концентрированная азотная/серная;;
−образуется растворимая соль.
2) Кислота + оксид металла → соль + вода
3) Кислота + основание → соль + вода
Если щелочь, то реакция нейтрализации.
4) Кислота + соль → новая кислота + новая соль,
если:
−образуется осадок/газ;
−кислота сильнее вытесняемой кислоты.
Задание №4
Приведите примеры уравнений реакций, характеризующих общие свойства кислот, в молекулярном, полном ионном и сокращённом ионном видах:
1) $...HCl + ... → ZnCl_{2} + ...$
2) $H_{2}SO_{4} + ... → CuSO_{4} + ...$
3) $HNO_{3} + ... → NaNO_{3} + ...$
4) $H_{2}SO_{4} + ... → BaSO_{4} + ...HCl$
5) $HCl + Fe(OH)_{3} → ... + ...$
6) $HNO_{3} + ... → H_{2}SiO_{3}↓ + ...$
Ответ
1) $2HCl + Zn = ZnCl_{2} + H_{2}$
$2H^{+} + 2Cl^{-} + Zn = Zn^{2+} + 2Cl^{-} + H_{2}$
$2H^{+} + Zn = Zn^{2+} + H_{2}$
2) $H_{2}SO_{4} + CuO = CuSO_{4} + H_{2}O$
$2H^{+} + SO_{4}^{2-} + CuO = Cu^{2+} + SO_{4}^{2-} + H_{2}O$
$2H^{+} + CuO = Cu^{2+} + H_{2}O$
3) $HNO_{3} + NaOH = NaNO_{3} + H_{2}O$
$H^{+} + NO_{3}^{-} + Na^{+} + OH^{-} = Na^{+} + NO_{3}^{-} + H_{2}O$
$H^{+} + OH^{-} = H_{2}O$
4) $H_{2}SO_{4} + BaCl_{2} = BaSO_{4} + 2HCl$
$2H^{+} + SO_{4}^{2-} + Ba^{2+} + 2Cl^{-} = BaSO_{4} + 2H^{+} + 2Cl^{-}$
$SO_{4}^{2-} + Ba^{2+} = BaSO_{4}$
5) $3HCl + Fe(OH)_{3} = FeCl_{3} + 3H_{2}O$
$3H^{+} + 3Cl^{-} + Fe(OH)_{3} = Fe^{3+} 3Cl^{-} + 3H_{2}O$
$3H^{+} + Fe(OH)_{3} = Fe^{3+} + 3H_{2}O$
6) $2HNO_{3} + Na_{2}SiO_{3} = H_{2}SiO_{3}↓ + 2NaNO_{3}$
$2H^{+} + 2NO_{3}^{-} + 2Na^{+} + SiO_{3}^{2-} = H_{2}SiO_{3}↓ + 2Na^{+} + 2NO_{3}^{-}$
$2H^{+} + SiO_{3}^{2-} = H_{2}SiO_{3}↓$

