Растворы. Растворение. Часть 2
Задание №1
Подпишите схему "Значение растворов".
Ответ
Значение растворов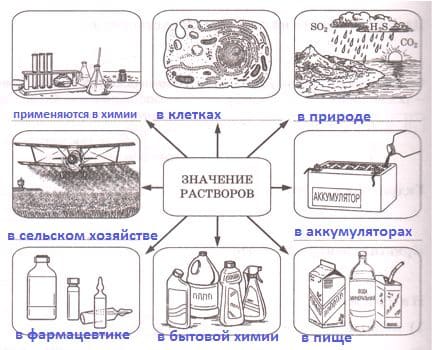
Задание №2
Заполните таблицу "Теории растворов".
| Признаки сравнения | Физическая теория | Химическая теория |
| Сторонники теории | ||
| Определение раствора |
Ответ
Теории растворов
| Признаки сравнения | Физическая теория | Химическая теория |
| Сторонники теории | С.А. Аррениус | Д.И. Менделеев |
| Определение растворения | Результат диффузии | Результат химического взаимодействия |
| Определение раствора | Однородная система, состоящая из растворителя и растворённого вещества | Однородная система, состоящая из растворителя, растворённого вещества и продуктов их взаимодействия |
Задание №3
Сформулируйте основные положения физико−химической теории растворов, которая принята в настоящее время.
Ответ
Основные положения физико−химической теории растворов, которая принята в настоящее время:
1) Раствор − это сложная равновесная химическая система, образованная растворителем, растворенным веществом и продуктами их взаимодействия.
2) Растворитель является инертной средой, в которую могут диффундировать частицы растворенного вещества.
Задание №4
Составьте формулы кристаллогидратов.
Образец. На 1 моль сульфата цинка приходится 7 моль воды → формула − $ZnSO_{4} * 7H_{2}O$.
а) Медный купорос (на 1 моль сульфата меди (II) приходится 5 моль воды) _
б) Соль кристаллическая (на 1 моль карбоната катрия приходится 10 моль воды) _
в) Гипс (на 1 моль сульфата кальция приходится 2 моль воды) _
Ответ
Формулы кристаллогидратов:
а) Медный купорос (на 1 моль сульфата меди (II) приходится 5 моль воды) → формула − $CuSO_{4} * 5H_{2}O$.
б) Соль кристаллическая (на 1 моль карбоната катрия приходится 10 моль воды) → формула − $Na_{2}CO_{2} * 10H_{2}O$.
в) Гипс (на 1 моль сульфата кальция приходится 2 моль воды) → формула − $CaSO_{4} * 2H_{2}O$.
Задание №5
Заполните текст формулами и названиями соединений, числовыми значениями.
Примечание. Воспользуйтесь данными графиков растворимости веществ (см. рис. 126 в учебнике) и таблицей растворимости.
Растворимость твердых веществ в воде зависит:
1) от температуры:
−растворимость хлорида калия _ при 30℃ _ _ г, а при _ _ ℃ − 50 г;
−растворимость _ _ _ _ _ _ _ _ _ _ _ _ _ при 40℃ 10 г, а при 80℃ − _ _ г;
−растворимость хлорида бария _ при 90℃ _ _ г, а при _ ℃ − 30 г;
2) от природы веществ:
−хорошо растворимые _
−малорастворимые _
−практически нерастворимые _
Ответ
Растворимость твердых веществ в воде зависит:
1) от температуры:
−растворимость хлорида калия KCl при 30℃ 40 г, а при 65℃ − 50 г;
−растворимость сульфата калия при 40℃ 10 г, а при 80℃ − 20 г;
−растворимость хлорида бария $BaCl_{2}$ при 90℃ 60 г, а при 0℃ − 30 г;
2) от природы веществ:
−хорошо растворимые − более 1 г на 100 г $H_{2}O$
−малорастворимые − 0,1−1 г наи 100 г $H_{2}O$
−практически нерастворимые − менее 0,1−1 г наи 100 г $H_{2}O$
Задание №6
Установите соответствие между действием, которое нужно совершить для получения раствора, и типом раствора. Из букв, соответствующих правильным ответам, вы составите название раствора сахара в воде: _ _ _ _ _ .
| Исходный раствор → получаемый раствор | Добавить воду | Добавить соль | Нагреть раствор | Охладить раствор | Выпарить раствор |
| Ненасыщенный → насыщенный | А | С | Н | И | Р |
| Ненасыщенный → насыщенный | О | Е | П | К | У |
Ответ
Название раствора сахара в воде: сироп.
| Исходный раствор → получаемый раствор | Добавить воду | Добавить соль | Нагреть раствор | Охладить раствор | Выпарить раствор |
| Ненасыщенный → насыщенный | А | С | Н | И | Р |
| Ненасыщенный → насыщенный | О | Е | П | К | У |
Задание №7
Растворимость хлорида калия в воде при 60°C равна 50 г. Определите массовую долю соли в растворе, насыщенном при указанной температуре.
Ответ
Дано:
m ($CaCl_{2}$) = 50 г
t = 50℃
Найти:
ω − ?
Решение:
Растворимость рассчитывается на 100 г воды, значит $m_{р-ра}$ = 100 г + 50 г = 150 г
ω = $\frac{m_в-ва}{m_р-ра}$ * 100% = 50 г : 150 г * 100% = 33,3%
Ответ: ω = 33,3%
Задание №8
По графику (см. рис. 126 в учебнике) определите растворимость сульфата калия при 80°C. Рассчитайте массовую долю соли в растворе, насыщенном при указанной температуре.
Ответ
Дано:
m ($K_{2}SO_{4}$) = 20 г
t = 80℃
Найти:
ω − ?
Решение:
Растворимость рассчитывается на 100 г воды, значит $m_{р-ра}$ = 100 г + 20 г = 120 г
ω = $\frac{m_в-ва}{m_р-ра}$ * 100% = 20 г : 120 г * 100% = 16,7%
Ответ: ω = 16,7%
Задание №9
Навеску 161 г глауберовой соли $Na_{2}SO_{4} * 10H_{2}O$ растворили в 180 л воды. Вычислите массовую долю сульфата натрия в полученном растворе. Сколько ионов каждого вида в нём находится?
Ответ
Дано:
m ($Na_{2}SO_{4} * 10H_{2}O$) = 161 г
V ($H_{2}O$) = 180 л
Найти:
ω − ?
N ($Na^{+}$) − ?
N ($SO_{4}^{2-}$) − ?
Решение:
m ($H_{2}O$) = V * ρ = 180 л * 1 кг/л = 180 кг = 180000 г
$m_{р-ра}$ = m ($H_{2}O$) + m ($Na_{2}SO_{4} * 10H_{2}O$) = 180000 г + 161 г = 180161 г
M ($Na_{2}SO_{4} * 10H_{2}O$) = 23 * 2 + 32 + 16 * 4 + 1 * 2 * 10 + 16 * 10 = 322 г/моль
n ($Na_{2}SO_{4} * 10H_{2}O$) = m : M = 161 г/моль : 322 г/моль = 0,5 моль
n ($Na_{2}SO_{4}$) = n ($Na_{2}SO_{4} * 10H_{2}O$) = 0,5 моль
M ($Na_{2}SO_{4}$) = 23 * 2 + 32 + 16 * 4 = 142 г/моль
m ($Na_{2}SO_{4}$) = M * n = 142 г * 0,5 моль = 71 г
ω = m ($Na_{2}SO_{4}$) : $m_{р-ра}$
ω = 71 г : 180161 г * 100% = 0,0394%
n ($Na^{+}$) = 2 * n ($Na_{2}SO_{4}$) = 2 * 0,5 моль = 1 моль
N ($Na^{+}$) = n * $N_{a}$ = 1 моль * $6 * 10^{23}$ ионов/моль = $6 * 10^{23}$ ионов
n ($SO_{4}^{2-}$) = n ($Na_{2}SO_{4}$) = 0,5 моль
N ($SO_{4}^{2-}$) = 0,5 моль * $6 * 10^{23}$ ионов/моль = $3 * 10^{23}$ ионов
Ответ: ω = 0,0394%; N ($Na^{+}$) = $6 * 10^{23}$ ионов; N ($SO_{4}^{2-}$) = $3 * 10^{23}$ ионов
Задание №10
Заполните таблицу "Научные достижения Д.И. Менделеева и С. Аррениуса".
| Портрет ученого | Имя ученого | Точка зрения на растворы и растворение | Другие научные достижения |
 |
|||
 |
Ответ
Научные достижения Д.И. Менделеева и С. Аррениуса
| Портрет ученого | Имя ученого | Точка зрения на растворы и растворение | Другие научные достижения |
 |
Д.И. Менделеев | Считал, что растворение − это процесс взаимодействия растворяемого вещества с водой | Создание периодической таблицы химических элементов |
 |
С. Аррениус | Считал, что растворение − это процесс диффузии | Разработал теорию электролитической диссоциации |

