Кислоты. Часть 2
Задание №1
Поиграйте в "крестики−нолики". Покажите выигрышный путь, который составляют формулы одноосновных кислот.
| HCl | $H_{2}SiO_{3}$ | $H_{2}CO_{3}$ |
| HF | $HNO_{3}$ | $H_{3}PO_{4}$ |
| $H_{2}SO_{3}$ | $H_{2}S$ | $HNO_{2}$ |
Распределите все приведенные выше кислоты по группам. Запишите их названия.
| Кислородсодержащие | Бескислородные |
| Нестабильные | |
Ответ
Одноосновные кислоты − HCl, HF, $HNO_{2}$, $HNO_{3}$
| HCl | $H_{2}SiO_{3}$ | $H_{2}CO_{3}$ |
| HF | $HNO_{3}$ | $H_{3}PO_{4}$ |
| $H_{2}SO_{3}$ | $H_{2}S$ | $HNO_{2}$ |
| Кислородсодержащие | Бескислородные |
| $H_{2}SiO_{3}$ | HCl |
| $HNO_{3}$ | HF |
| $H_{3}PO_{4}$ | $H_{2}S$ |
| $H_{2}CO_{3}$ | Нестабильные |
| $H_{2}SO_{3}$ | $H_{2}SO_{3}$ |
| $HNO_{2}$ | $HNO_{2}$ |
| $H_{2}CO_{3}$ |
Задание №2
Дайте характеристику фосфорной кислоты _ по всем признакам классификации.
1) _
2) _
3) _
4) _
Ответ
$H_{3}PO_{4}$ − фосфорная кислота
1) трехосновная
2) кислородсодержащая
3) растворимая
4) стабильная
Задание №3
Напишите формулы кислот и соответствующих им оксидов, образованных неметаллами в следующих степенях окисления:
1) $S^{+6}$ _ → _
2) $S^{+2}$ _ → _
3) $N^{+5}$ _ → _
Ответ
1) $H_{2}SO_{4} → SO_{3}$
2) сера не имеет степени окисления равной +2
3) $HNO_{3} → N_{2}O_{5}$
Задание №4
Определите заряды ионов, степени окисления элементов в кислотах.
| СОЕДИНЕНИЕ | ЗАРЯДЫ ИОНОВ | С.О. ЭЛЕМЕНТОВ |
| $HNO_{3}$ | ||
| $H_{2}SO_{4}$ | ||
| $H_{3}PO_{4}$ |
Ответ
| СОЕДИНЕНИЕ | ЗАРЯДЫ ИОНОВ | С.О. ЭЛЕМЕНТОВ |
| $HNO_{3}$ | $H^{+}, NO_{3}^{-}$ | $H^{+1}N^{+5}O^{-2}_{3}$ |
| $H_{2}SO_{4}$ | $H^{+}, SO_{4}^{2-}$ | $H^{+1}_{2}S^{+6}O^{-2}_{4}$ |
| $H_{3}PO_{4}$ | $H^{+}, PO_{4}^{3-}$ | $H^{+1}_{3}P^{+5}O^{-2}_{4}$ |
Задание №5
Установите соответствие между опасной ситуацией и необходимыми действиями по оказанию первой помощи во избежание химического ожога.
ПРИ ПОПАДАНИИ НА КОЖУ РАСТВОРА
А) кислоты
Б) щелочи
↑↓
НЕОБХОДИМО
1) смыть химические растворы большим количеством воды
2) промыть место ожога слабым раствором питьевой соды
3) промыть место ожога раствором борной кислоты или слабым раствором уксусной кислоты
Ответ.
| А | Б |
Ответ
Ответ.
| А | Б |
| 1, 2 | 1, 3 |
Задание №6
В пробирках А и Б находятся растворы гидроксида калия и соляной кислоты. Какие качественные реакции необходимо провести, чтобы определить содержимое каждой из пробирок?
Ответ. _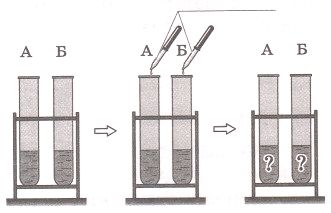
Ответ
Ответ: чтобы определить содержимое каждой пробирки надо использовать индикатор − лакмус. Тогда раствор щелочи приобретет синий цвет, а кислоты − красный.
$KOH = K^{+} + OH^{-}$
$H_{2}SO_{4} = 2H^{+} + SO_{4}^{2-}$
Задание №7
Установите соответствие между свойством или применением кислоты и ее формулой. Из букв, соответствующих правильным ответам, вы составите название кислоты, которая широко распространена в природе и легко удаляет с тканей пятна ржавчины: _ _ _ _ _ _ _ _.
| Свойства кислот и особенности применения | HCl | $H_{2}SiO_{3}$ | $H_{2}CO_{3}$ | $H_{2}SO_{3}$ | $H_{2}SO_{4}$ | HF |
| Нерастворима в воде | ХЛ | ЛИ | СЕ | АЗ | ПЛ | СО |
| В нее нельзя вливать воду | ОТ | ОР | РН | ЛЯ | МО | АВ |
| Концентрированная кислота дымит на воздухе | Н | Т | И | Т | Р | С |
| Нестабильна | Л | М | Н | А | Т | В |
| Растворяет стекло | В | А | П | Р | Л | Я |
Ответ
Название кислоты, которая широко распространена в природе и легко удаляет с тканей пятна ржавчины: лимонная.
| Свойства кислот и особенности применения | HCl | $H_{2}SiO_{3}$ | $H_{2}CO_{3}$ | $H_{2}SO_{3}$ | $H_{2}SO_{4}$ | HF |
| Нерастворима в воде | ХЛ | ЛИ | СЕ | АЗ | ПЛ | СО |
| В нее нельзя вливать воду | ОТ | ОР | РН | ЛЯ | МО | АВ |
| Концентрированная кислота дымит на воздухе | Н | Т | И | Т | Р | С |
| Нестабильна | Л | М | Н | А | Т | В |
| Растворяет стекло | В | А | П | Р | Л | Я |
лимонная
Задание №8
Вычислите количество вещества, которое составляют 392 кг фосфорной кислоты. Сколько атомов водорода будет содержаться в этой порции кислоты?
Ответ
Дано:
m ($H_{3}PO_{4}$) = 392 кг
Найти:
n ($H_{3}PO_{4}$) − ?
N ($H^{+}$) − ?
Решение:
n ($H_{3}PO_{4}$) = m : M
M ($H_{3}PO_{4}$) = 1 * 3 + 31 + 16 * 4 = 98 г/моль
n ($H_{3}PO_{4}$) = 392 кг : 98 г/моль = 4 кмоль
N ($H^{+}$) = n ($H^{+}$) * $N_{a}$
n ($H^{+}$) = 3 * n ($H_{3}PO_{4}$) = 3 * 4 кмоль = 12 кмоль
N ($H^{+}$) = 12 кмоль * $6 * 10^{23}$ атомов/моль = $7,2 * 10^{27}$ атомов
Ответ: n ($H_{3}PO_{4}$) = 4 кмоль; N ($H^{+}$) = $7,2 * 10^{27}$ атомов

